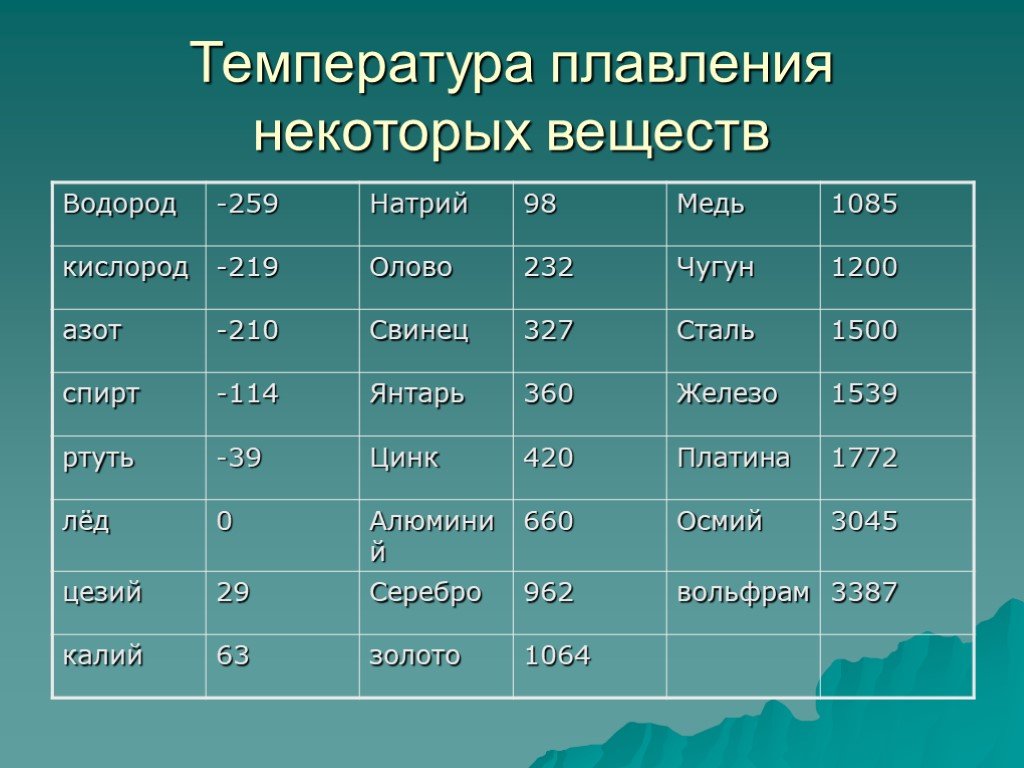
Температура плавления свинца в градусах по Цельсию
Свинец считается элементом химии из 14 группы, таблицы Д. И. Менделеева. Свинец получил 82 номер. Свинец считается ковким и мягким металлом серебрянного оттенка, включая синеватый оттенок. Компонент повсеместнораспространен по поверхности Земли, легко добывается и поддается воздействию. Первые украшения и свинцовые дорогие предметы (Бусинды) с использованием металлургической деятельности, дают право утверждения, что плавление металла как свинца, стала первой в человеческой истории около 6400 г. до н. э. Самым старым изделием из свинцового сплава считается женская фигурка в одежде из храма Осириса (3100 – 2900 гг. до н.э.). Старинный Рим производил до 80 тыс. тонн свинца в течении года, в том числе для водомерного узла. На территории Руси металл отыскал использование в обустройстве крыш, для печатей при разработке грамот. Происхождения слов «свинец» даже в наше время не ясно, на латини наименование происходит от слова plumber (водопроводчик).
Алхимики связывали компонент с Сатурном. К 1840 г. промышленная революция стала причиной производство свинца до отметки 100 тыс. тонн, а ко второй пол. XIX ст. производилось уже 250 тыс. тонн. До 1990 годов компонент широко использовали в типографии.
Свинец характеристика
Элемент нечасто находится в самородном виде. Есть намного 80 минеральных пород с включением элемента, к примеру: церуссит, галенит, англезит.
Технологичные свойства и характеристики металла
Свинец получил обычные характерности и технологичные свойства собственной группы и отличается очень высокой тяжестью, и плотностью с обычным серым оттенком. При контакте с воздухом металл теряет блеск.
Не обращая внимания на большую плотность металл проявляет значительную мягкость, при температуре 20 градусов на нем можно оставить отпечаток ногтем.
Плотность свинца и его масса
Масса элемента равняется 82, что считается основой внушительного веса. Кристаллическая решётка обрела кубическую форму.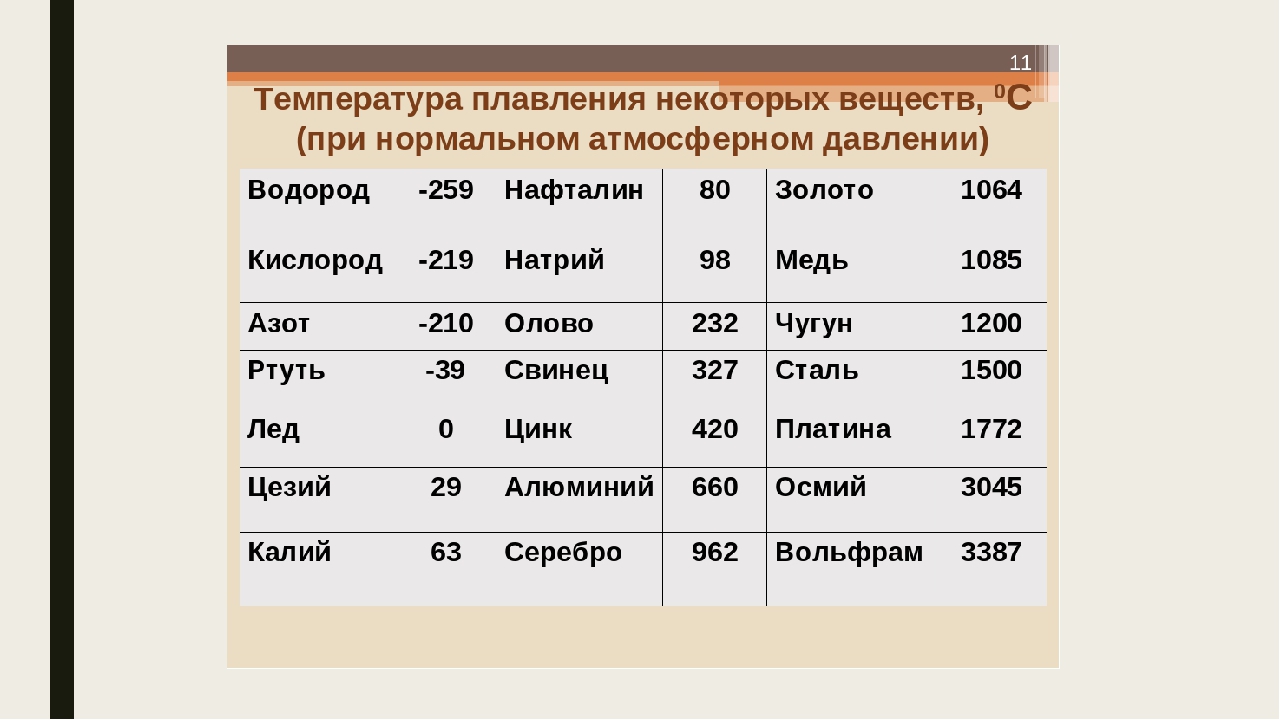 В углу модели молекулы и посередине всех граней находится атом.
В углу модели молекулы и посередине всех граней находится атом.
Высокая масса относит вещество в состав перечня тяжёлых элементов. При нагреве плотность материала падает.
Какая температура плавки свинца?
Свинец не считается тугоплавким веществом, что выделяет его из прочих плотных компонентов. Вещество легко можно деформировать и прокатить в фольгу.
Температура полного плавления свинца – 327,46 °С. Что бы выяснить какая точная температура плавления свинца достаточно применить формулу F = 1,8 °C + 32. Аналогичным образом плавление свинца происходит при температуре 620,6 F.
Температура кипения элемента приходит при – 1749 °С. Чтобы провести процедуру литья нужно довести элемент до 400–450 °С.
Нужно отметить что при температуре -7,26 К, элемент получает сверхпроводимость. При плавлении элемент получает текучие свойства, возрастает вязкость и меняется поверхностное напряжение.
Механичные свойства
Большая гибкость стала основой скверных качеств прочности.
- Сопротивление разрыву – до 13 Мпа (у железа критерий – 250 МПа).
- Твердость по Бринеллю составляет – 3,2 – 8 НВ.
- Предел при сжатии – до 50 Мпа.
- Удлинение материала не больше 50-70%.
Проводимость тепла меньше практически вдвое, чем у Феррума, в 11 раз ниже критерия меди и составляет 33,5 вт/(м·К). При температуре 20 градусов значение теплоемкости – 0,12 кДж/(кг·К).
Проводимость электричества в нормальных условиях проявляет плохую проводимость электричества: удельное сопротивление равно 0,22 Ом-кв. мм/м. У меди подобный показатель может достигать 0,017
Сопротивление коррозии
По собственным инертным особенностям свинец приближается к категории драгоценных металлов. Большой порог вступления в реакцию и наличие оксидной пленки, предоставляют большую сопротивляемость ржавчине. Серная кислота, а еще угольный ангидрид, растр сероводорода не действует на компонент.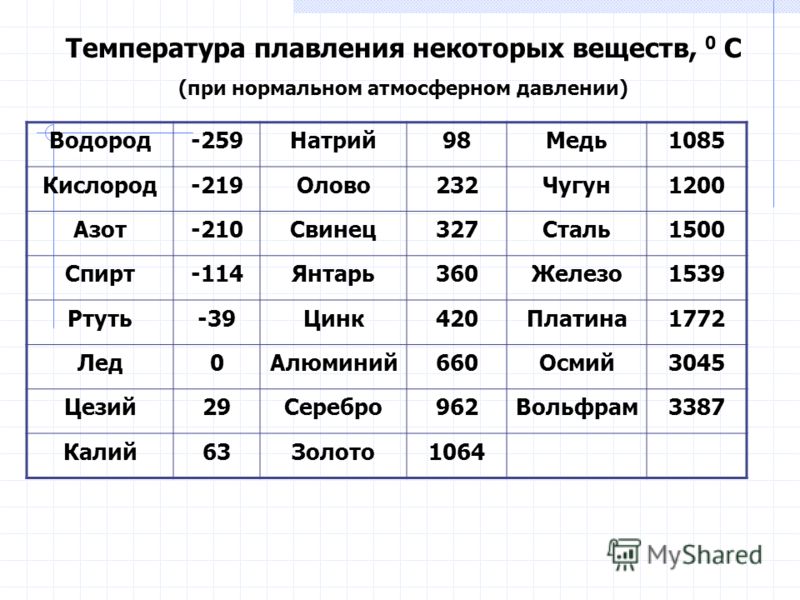 В городской местности уровень коррозии достигает -0,00068 мм/год.
В городской местности уровень коррозии достигает -0,00068 мм/год.
Свинец стойкий к хромовой, концентрированной уксусной, ортофосфорной кислоте. Элемент быстро рушиться в азотной и разбавленной уксусной кислоте и концентрированной серной (90%).
Сфере использования свинцовых сплавов
Свинец успешно используется для источника тока полученного химическим путем. Около ? всей массы произведенного металла применяется для создания свинцовых аккумуляторов. Не обращая внимания на конкуренцию щелочных источников энергии, свинец формирует электричество более большого напряжения. Компонент используется для обмоток сверхпроводящих трансформаторных систем. Элемент был одним из первых замеченных веществ с характеристиками сверхпроводимости. Свинцовый сплав (баббит) отыскал использование в создании подшипников, благодаря антифрикционным особенностям. Свинец широко используется для изготовления электрических предохранительных систем из-за возможности создания легкоплавких соединений с другими металлами (кадмием или оловом).
Подшипники из свинцового сплава
20% всего объема компонента идет для создания оболочки кабеля силового для подземных и подводных линий. Свинец начали использовать в военном деле в период Римского государства, в качестве снарядов для катапульты. Сегодняшняя промышленность производит из свинца пули и остальные комплектующие для инвентаря для занятий спортом, боевого и охотничьего оружия. Свинец популярен в качестве многофункционального припоя, включая ситуации, когда объединить метал иным вариантом трудно.
Металл успешно используется для защиты от радиоактивного излучения, благодаря собственной массе. За счёт дешевизны элемент монтируется в рентген кабинетах, и на ядерных полигонах.
Также компонент применяется, как часть звукоизоляционного покрытия и в кровельном деле. Также материал применяют в сейсмостойких фундаментах зданий, и уплотнений между кладкой. Краска со свинцом применяется на технических сооружениях (мосты, строения по каркасной технологии).
Бытовые и промышленные способы
Для выделения и плавления чистого свинца, очень часто применяют галенит, как основу плавки. Способом флотации обогащают экстракт до 40-70%. Дальше используют несколько методов плавления:
Способом флотации обогащают экстракт до 40-70%. Дальше используют несколько методов плавления:
- Электротермическое плавление.
- Способ термического плавления Ванюкова (расплавление в жидкой ванне).
- Плавление в шахтной (ватержакетной) печи.
После обработки химическим путем убирают примеси иных элементов, в результате чистота свинца может достигать более 99%.
Главными изготовителями считаются: страны ЕС (плавление 2200 килотонн), Соединённых Штатов (1400), КНР (1200), РФ (1100). Также широкое производство плавления компонента находится в Южной Корейской республике, Украине и Казахстане.
Приготовление расплава
Для начала плавления дома выбирается емкость с огнеупорной ручкой, которая удержит большую температуру. Для этой функции подходит устаревший кухонный чайник или аналогичная домашняя утварь. Дома можно использовать чугунную посуду, при отсутствии иных вариантов применяют консервные емкости, с применение плоскогубцев в виду большой температуры операции.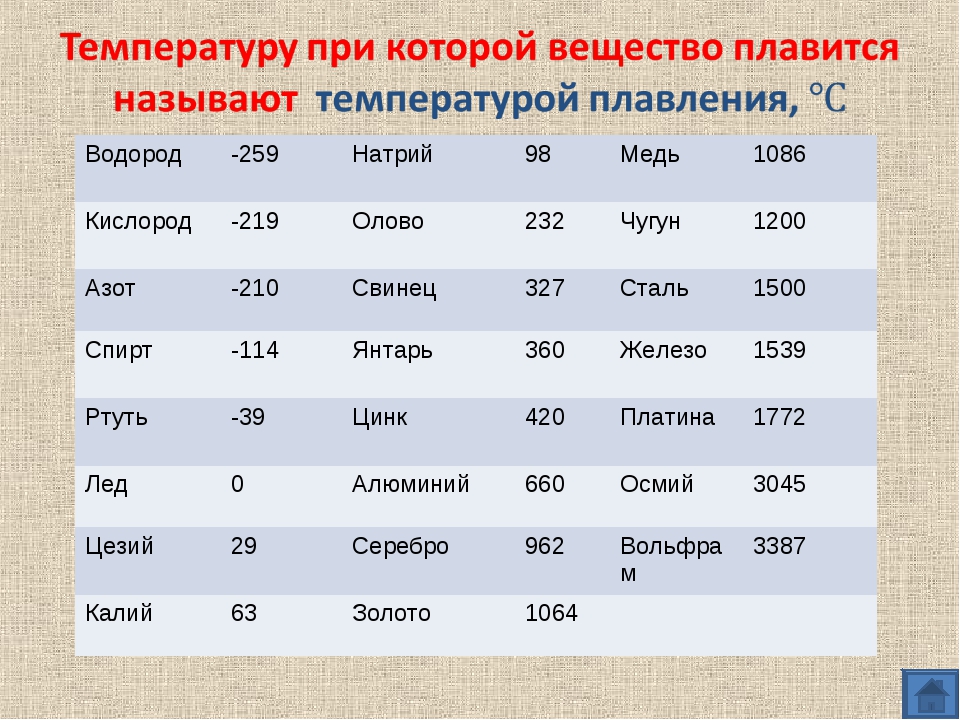
Обрабатываемый материал размельчают и избавляют массу от лишних включений любыми доступными способами. Чем будет хорошо размельчен металл, тем быстрее он расплавится. Емкость нужно надежно установить над источником огня и прогреть для устранения влаги и посторонних примесей.
Кипение свинца достигается при температуре более 1700 °C. Дома подобную температуру создать невозможно, но при температуре 700 °C компонент проявляет высокую летучесть. Таким образов при отсутствии особенного оборудования и практической надобности, не стоит доводить свинец до температуры с оттенком красного, в виду вредности испарений для находящихся вокруг лиц.
Процесс плавления и заливка
В подогреваемую емкость не нужно сразу погружать весь лом. Контактировать с нагретым дном будет только тоненький слой, а остальная приобретенная температура будет рассеиваться в массе свинца. Для эффектной плавки лучше кинуть немного в уже разогретую ванную понемногу помещая другие части. Это повысит площадь разогретой массы с большой температурой.
После разогрева всей массы лома. На поверхности образуется шлаковый слой, который необходимо удалить ложкой с длинной ручкой или таким средством. Если масса обрела единую разогретую консистенцию ее стоит переставить в заранее разогретую форму. Невысокая температура плавления провоцирует быстрое застывание в кристаллический вид. Если форма не разогрета, свинец начнет неравномерно ложится прямо во время заливки, и изделие выйдет неоднородным с присутствием недостатков.
Рыбацкие лаки
Свинцовые изделия, фигурки или рыбацкие снасти можно лакировать, применяемым рыбаками.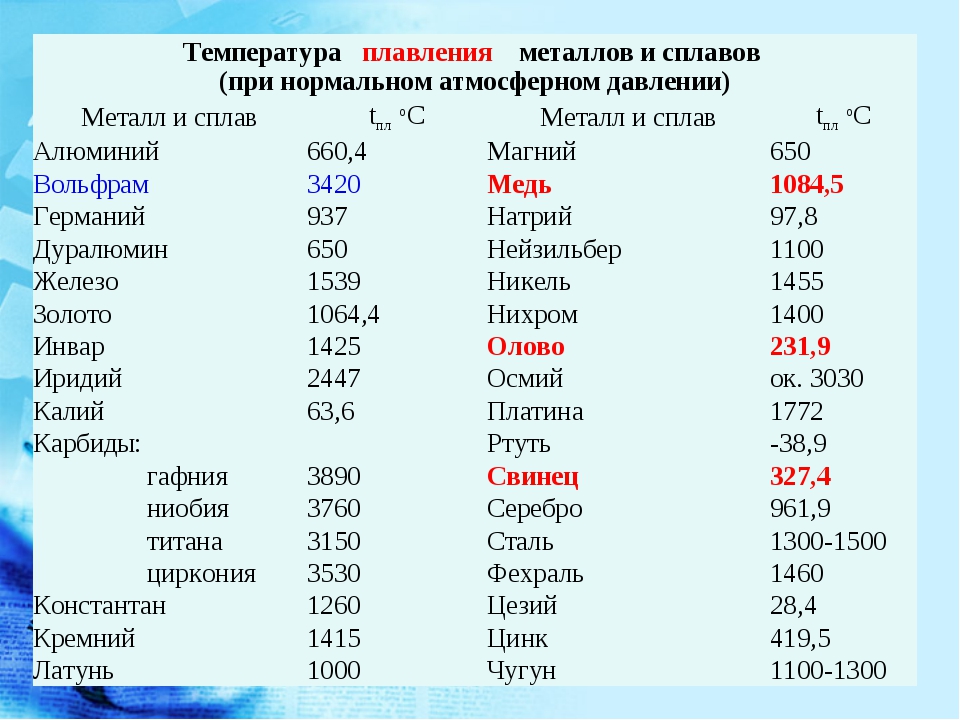 У поклонников ловли рыбы существует несколько функций для этого ингредиента. Впрочем с предотвращением оксидного слоя на поверхности, раствор также хорошо справляется. Делают жидкость чтобы придать старым наживкам и грузилом прежнего блеска.
У поклонников ловли рыбы существует несколько функций для этого ингредиента. Впрочем с предотвращением оксидного слоя на поверхности, раствор также хорошо справляется. Делают жидкость чтобы придать старым наживкам и грузилом прежнего блеска.
Методы спасения от оксида
Во время взаимные действия с воздухом между атомами металла и внешней средой образуется ионная связь. Кислород отдает два электрона. На поверхности быстро появляется окислительный слой. Такая оксидная пленка способна устранить последующее влияние враждебной среды. Пленка, также становится барьером во время передачи электричества.
Оксидная пленка на продукте, сделанном из свинца рождается через небольшой временной промежуток. Механическая очистка – довольно тяжелое и бесполезное занятие. Сразу же после успешного снятия слоя, организуя поле, и оголенные атомы вступают в связь с новыми атомами воздуха. Создать защиту для предмета можно во время использования масла подсолнуха. Также важен вариант с графитовой смазкой и лаком.
Также важен вариант с графитовой смазкой и лаком.
Для домашнего быта прекрасно подходит масло подсолнуха. Масло льют в мисочку, после этого в жидкость помещают нужное изделие из свинца. При правильной выдержки (около 5 минут), нужно вынуть изделие из масла и дать ему высохнуть на подготовленных салфетках.
В условиях производства Для снижения распространения оксидных включений на поверхности деталей используют графитовую смазку. Смазка не считается редкой или дорогой, однако в домашних условиях она нечасто оказывается в наличии. Это средство реализуется в автомагазинах и хозяйственных точках продажи. При правильном отношении свинцовая поверхность будет долгое время показывать блеск.
Графитовая смазка для свинца
Если оксидная пленка уже удачно покрыла поверхность, есть способы ее убирания. Для этого, применяется концентрированный раствор кислоты. Для этих действий нужна специализированная подготовка, включая наличие химического стеклянного инвентаря. Обыкновенные столовые банки или миски не подходят.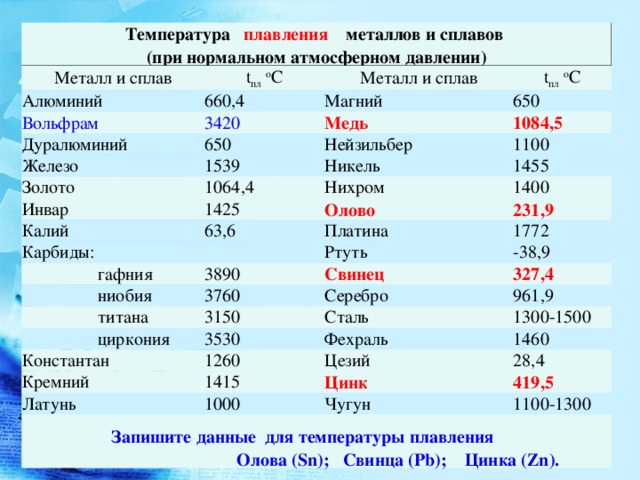 Реактивные компоненты могут навредить человеку, оставить ожоги на теле.
Реактивные компоненты могут навредить человеку, оставить ожоги на теле.
Приветствуется применение защитных очков и маски.
Обрабатываемое изделие погружается в кислотный раствор. Нужно обождать пока пленка оксида будет разрушена. После успешного подъема из раствора отделывается поверхность для защиты маслом или лаком.
Техника безопасности
Расплавленный свинец способен произвести важные повреждения и ожоги. Капля очень быстро пропалит одежду и попадет на открытую кожную поверхность. Жидкая форма свинца может при вытекании попасть на предметы которые легко загораются и спровоцировать пожар в помещении. Если в жидкий расплав проникает вода происходит резкая вспышка с распространением очень маленьких брызг металла по всей территории. Такие включения могут попасть на поверхность кожи и глаза, что больно и страшно для органов человека. Аналогичным образом, в первую очередь в рабочий период нужно применение одежды, которая покроет все тело включая рукава, одевайте головной убор.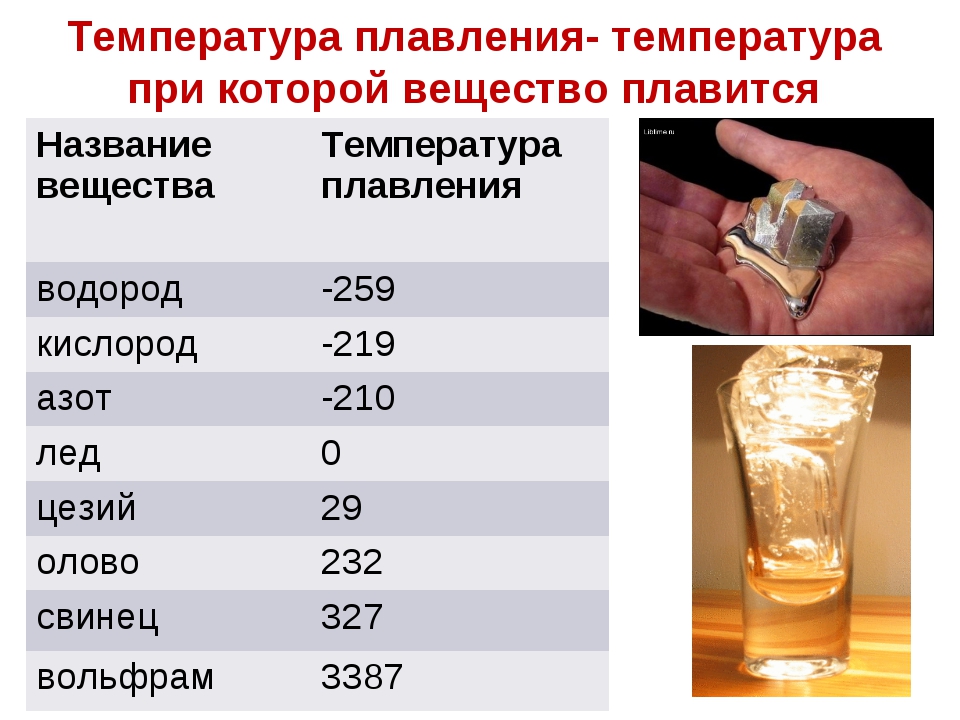 Ткань должна быть с высокой огнеустойчивостью и термической устойчивостью. На лицо нужно одеть маску и очки для защиты.
Ткань должна быть с высокой огнеустойчивостью и термической устойчивостью. На лицо нужно одеть маску и очки для защиты.
Помещение, в котором проводят плавку, нужно отлично проветривать, ввиду токсичности испарения свинца. Если маски нет в наличии применяйте ватно-марлевую повязку. При попадании в организм свинец провоцирует и ухудшить ряд болезненных процессов, накапливаясь в органах, компонент вызывает острое отравление.
Если вы нашли погрешность, пожалуйста, выдилите фрагмент текста и нажмите Ctrl+Enter.
Похожие статьи
Плавление свинца. Плавим свинец
Cтраница 4
Плавкостью называется способность металлов при определенной температуре переходить из твердого состояния в жидкое. Эта температура называется температурой плавления. Различные металлы имеют различную, но определенную (для данного металла) температуру плавления. Сплавы не имеют постоянной и определенной температуры плавления, она зависит от количества и свойств элементов, входящих в сплав. Так, например, если температура плавления свинца 327 С, а олова 232 С, то сплав олова в количестве 62 % со свинцом в количестве 38 % (так называемый припой) имеет температуру плавления 183 С.
Сплавы не имеют постоянной и определенной температуры плавления, она зависит от количества и свойств элементов, входящих в сплав. Так, например, если температура плавления свинца 327 С, а олова 232 С, то сплав олова в количестве 62 % со свинцом в количестве 38 % (так называемый припой) имеет температуру плавления 183 С.
Плавкостью называется способность металлов при определенной температуре переходить из твердого состояния в жидкое. Эта температура называется температурой плавления. Различные металлы имеют различную, но определенную (для данного металла) температуру плавления. Сплавы не имеют постоянной и определенной температуры плавления, она зависит от количества и свойств элементов, входящих в сплав. Так, например, если температура плавления свинца 327 С, а олова 232 С, то сплав олова (62 %) со свинцом (38 %), называемый припоем, имеет температуру плавления 183 С.
В тигельных печах обычно нет термопары или термометра для измерения температуры. О примерной температуре в печи судят по цвету нагретого керамического муфеля: темно-красное каление — 700 С, ярко-красное — 950 С, желтое — 1100 С.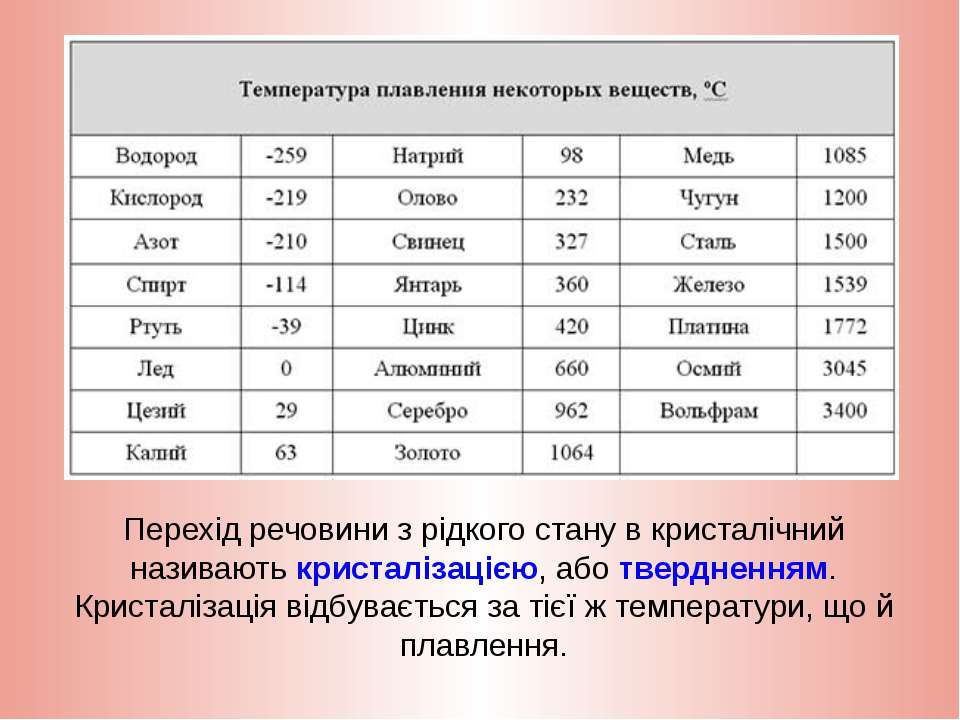 Через 10 — 12 мин тигель осторожно вынимают, захватив тигельными щипцами. Нужно подчеркнуть, что эту операцию целесообразно выполнять без задержки, не давая тиглю охладиться. При охлаждении металл может иногда приплавиться к тиглю и тогда его трудно извлечь, не разбив тигель. Для восстановления выбирают оксиды низкоплавких металлов (температура плавления свинца 327 С, олова 232 С), чтобы получить расплавленный металл в лабораторных условиях.
Через 10 — 12 мин тигель осторожно вынимают, захватив тигельными щипцами. Нужно подчеркнуть, что эту операцию целесообразно выполнять без задержки, не давая тиглю охладиться. При охлаждении металл может иногда приплавиться к тиглю и тогда его трудно извлечь, не разбив тигель. Для восстановления выбирают оксиды низкоплавких металлов (температура плавления свинца 327 С, олова 232 С), чтобы получить расплавленный металл в лабораторных условиях.
Свинец пластичен и вязок, легко поддается обработке. Свежий разрез свинца на воздухе быстро тускнеет, так как свинец окисляется кислородом воздуха. Вследствие большой вязкости свинец трудно ломается. Механическая прочность свинца весьма невысокая. Он настолько мягок, что чертится ногтем, легко режется ножом, легко сгибается и рвется даже при сравнительно небольшом усилии. Теплопроводность свинца между 0 и 50 равна 30 ккал мчас С, теплоемкость между О и 100 равна 0 031 ккал. С, коэфициент линейного расширения равен 0 0000276 — 0 0000293, уд. Температура плавления свинца 327 5, поэтому его очень легко можно расплавить в ковше на простом очаге и отлить в любую форму. Простота обработки является наиболее ценным свойством свинца по сравнению с другими материалами.
Температура плавления свинца 327 5, поэтому его очень легко можно расплавить в ковше на простом очаге и отлить в любую форму. Простота обработки является наиболее ценным свойством свинца по сравнению с другими материалами.
Температура плавления свинца позволяет использовать металл в технических целях для изготовления деталей, образования сплавов. Переплавку материала можно проводить в кустарных условиях, соблюдая при этом меры предосторожности.
Свинец легко плавится.
Приготовление расплаваПлавление материала предусматривает процесс перехода из твердого состояния в жидкость под влиянием температурного градиента. Этот показатель имеет зависимость от характеристик компонентов, формирующих сплав.
К примеру, температура плавления свинца составляет 327 °C, а олова — 232 °C. Для припоя, состоящего из этих материалов, температура перехода в жидкость составляет 183 °C.
Плавка материалов происходит при нагревании. Показатель перехода в жидкое состояние называется температурой плавления.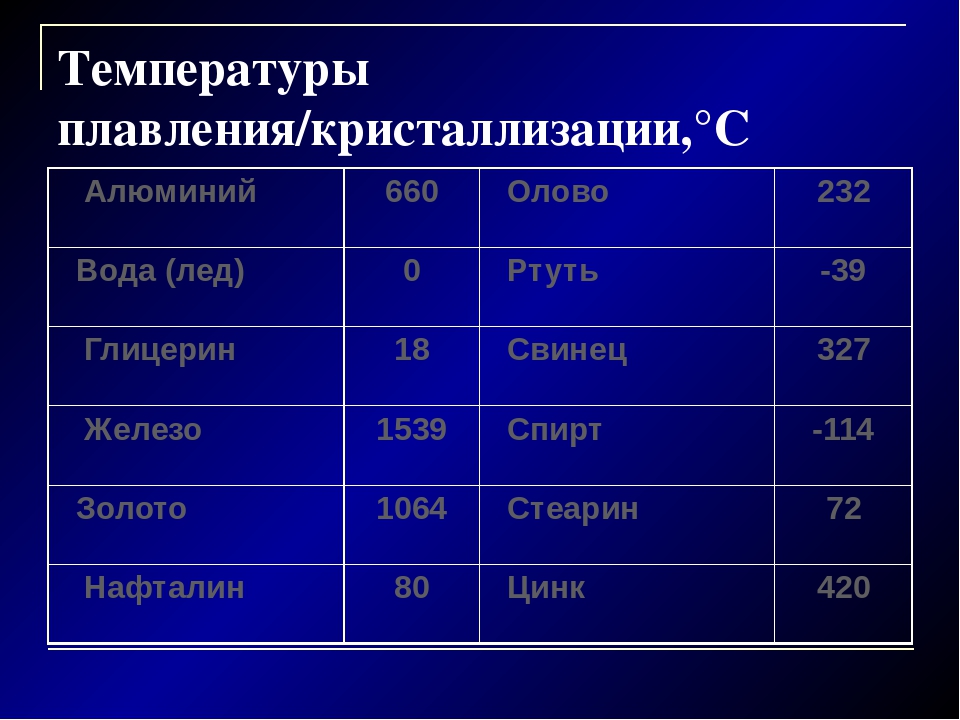
Свинец является пластичным и вязким химическим элементом, легко поддающимся обработке. Он легко образует на воздухе оксид. Свежий срез металла быстро тускнеет. Материал непрочный и легко поддается механическому воздействию. составляет 11,3 г/см³.Удельная теплота плавления свинца составляет 25 кДж/кг. Материал отличается большой вязкостью, его трудно разломать на части. В то же время он очень мягкий, на нем остается вмятина от нажатия ногтем. Металл легко разрезается ножом.
Температура плавления -температура, при которой металл переходит в жидкое состояние.
Температура плавления свинца позволяет разогревать его в ковше на простом очаге с последующим отливом в формы.
Удельная теплоемкость свинца при комнатной температуре равна 127,5 Дж/кг, а при нагревании металла до кипения показатель увеличивается.
Переплавка в кустарных условиях- Свинец, температура плавления которого низкая, позволяет его использование для литья разнообразных поделок, грузил для рыбалки в домашних условиях.
 Формировать расплав несложно, но при этом необходимо соблюдать элементарную безопасность и внимательность.
Формировать расплав несложно, но при этом необходимо соблюдать элементарную безопасность и внимательность. - Плавку металла следует проводить в хорошо проветриваемом помещении. Источником тепла можно выбрать ручную горелку, а в качестве сосуда использовать емкость из более прочного и устойчивого к нагреванию металла.
- Поместив материал в емкость для нагревания, включить источник тепла на максимальную мощность и направить температурный поток ближе к расплавляемому материалу. Для перевода в жидкость значительного количества сырья потребуется некоторое время.
- После выключения горелки расплавленный материал можно заливать в подготовленную форму для литья. Надев специальные рукавицы, аккуратно взять емкость с жидкостью, слегка вращая для предотвращения образования пузырей.
- Заливать металл в форму нужно на расстоянии, чтобы не обжечь открытые части тела горячими испарениями свинца. После заливки форму оставить остывать до безопасной температуры.
- Пролитый расплав можно легко механически удалить с поверхности с помощью отвертки или долота и использовать его при следующей плавке.

- Материал хорошо смешивается с другими металлами, что влияет на состав и качество отливки. При работе необходимо использовать спецодежду и плотные рукавицы для защиты кожи рук от попадания металлической пыли.
- Перед заливкой нужно удостовериться, что форма абсолютно сухая. При наличии влаги может произойти мгновенное ее испарение, что повлечет за собой попадание расплава на тело.
Свинец известен человечеству несколько тысячелетий. Еще в Древнем Риме его использовали для изготовления труб для транспортировки воды.
В природе существует примерно 180 минералов, включающих в состав химический элемент №82. Месторождения свинца часто сочетаются с рудами меди, висмута, цинка, серебра.
На сегодня применение металла в промышленном производстве позволяет изготавливать:
пластины для аккумуляторов;
оболочки силовых кабелей;
типографские шрифты;
сплавы и припои;
сплавы для изготовления подшипников;
красители;
пули и дроби для охоты.
А также он используется как средство защиты от радиоактивного излучения.
Свинец широко используется в жизнедеятельности человека.
До недавнего времени металл применяли с целью увеличения октанового числа топлива и обнаружения h3S, но постепенно от данного метода начали отказываться.
Свинец является токсичным химическим элементом. Отравление металлом и его соединениями возможно при разработке рудных месторождений, выплавке и использовании в производстве.
Бытовые отравления происходят по причине длительного хранения продуктов в упаковках или посуде, покрытой глазурью, содержащей свинец.
Вопрос о том, как расплавить свинец , появляется у многих, как начинающих, так и видавших виды рыболовов. Чай надобность в плавке свинца в домашних условиях вытекает, как водится, из мечты изготовить грузила, блесны и мормышки по своему уникальному эскизу. Нужно сказать, что данный процесс довольно примитивен и не представляет специальных сложностей. Температура плавления свинца равна 327,4 градусам Цельсия. Это дозволяет плавить его в керамических, стальных и даже алюминиевых емкостях прямо на газовой горелке бытовой плиты.
Температура плавления свинца равна 327,4 градусам Цельсия. Это дозволяет плавить его в керамических, стальных и даже алюминиевых емкостях прямо на газовой горелке бытовой плиты.
Вам понадобится
- Керамический тигель, либо железная посуда с жаростойкой ручкой. Железные щипцы либо лопатка.
Инструкция
1. Подготовьте емкость для плавления. Удостоверитесь в том, что она довольно чистая и не содержит органических засорений. Проверьте безопасность крепления рукояти, если таковая имеется.
2. Подготовьте свинец . Если имеется довольно крупный кусок металла, поделите его на небольшие фрагменты. Если свинец физически объединен с огромным числом чужеродных веществ (как в ветхих аккумуляторах), по вероятности удалите их.
3. Прогрейте емкость, в которой будет производиться плавление. Верно установите емкость над газовой горелкой. Зажгите огонь. Отрегулируйте подачу газа так, дабы пламя было небольшим. Подождите, пока емкость прогреется. Прогрев нужен для выпаривания влаги с поверхности емкости, выгорания органических веществ и предотвращения уничтожения керамической посуды из-за стремительного неравномерного термического растяжения.
Прогрев нужен для выпаривания влаги с поверхности емкости, выгорания органических веществ и предотвращения уничтожения керамической посуды из-за стремительного неравномерного термического растяжения.
4. Расплавьте свинец . Разместите в емкость несколько ломтиков свинца. Для того дабы избежать ожога, делайте это щипцами либо лопаткой. Дождитесь их полного расплавления. Добавляйте в расплав доли свинца до приобретения нужного числа жидкого металла. Постепенное добавление свинца в расплав ускоряет процесс плавления, от того что твердые фрагменты контактируют с жидкой фракцией, что увеличивает площадь соприкосновения и улучшает теплопередачу.
Свинец сразу распознается по внешним знакам, он довольно эластичен, не ломается, с легкостью плавится под молотком, имеет темно-серый цвет. Он относится к легкоплавким металлам, потому что плавится при 327 градусах. В том случае если он находится в сплаве с иным металлом, температура плавления может гораздо снизиться либо повыситься. Свинец абсолютно подходит для литейных работ в домашних условиях
Свинец абсолютно подходит для литейных работ в домашних условиях
Инструкция
1. Достать свинец идеально не трудно, это дозволено сделать в организациях, занимающихся утилизацией сырья. Желанно приобретать больше чистый свинец. Перед началом плавки свинца, приготовьте форму, в которую будете его заливать. Возьмите ветхую чугунную кастрюлю, поставьте ее на огонь, ломтики свинца сложите в кастрюлю и удерживаете на огне до тех пор, пока свинец не станет схожим на сверкающую жидкость. Следите, дабы не оставалось мелких ломтиков. Если температура, нужная для плавления свинца, будет превышена, он начнет приобретать красноватый оттенок.
2. В то время пока свинец находится на огне, подготовьте форму для заливки, немножко разогрев ее, что дозволит избежать частичной либо неровной отливки. Позже этого форму зажмите в тисках, прикрепленных к столу. Для этих целей также существуют особые струбцины и формы с приваренными ручками.
3. Как только свинец расплавится, соскребите с его поверхности ножиком либо ложкой каждый мусор. После этого крупный ложкой зачерпните малое число свинца и осмотрительно залейте в форму, заранее поставив ее вблизи кастрюли, потому что он может расплескаться и оставить важные ожоги на руках. Люди, непрерывно работающие со свинцом, выбирают разливать его в форму особой ложкой, имеющей сбоку небольшую выемку.
После этого крупный ложкой зачерпните малое число свинца и осмотрительно залейте в форму, заранее поставив ее вблизи кастрюли, потому что он может расплескаться и оставить важные ожоги на руках. Люди, непрерывно работающие со свинцом, выбирают разливать его в форму особой ложкой, имеющей сбоку небольшую выемку.
4. Подождите несколько минут, пока свинец застынет, позже этого освободите форму от тисков, откройте ее. Трудиться класснее в перчатках, потому что форма будет дюже жгучей.
5. Окончательно готовое изделие остынет не менее чем через час. Все издержки из-за неровного прилегания частей формы дозволено обрезать ножиком.
6. Свинец дозволено достать и из обыкновенного аккумулятора. Для этого аккумулятор разберите, слив заблаговременно кислоту и оставив в опрокинутом состоянии на один день. Позже отколите боковые стороны аккумулятора и достаньте свинцовые пластины, которые находятся в резиновых пакетах. Расплавьте их описанным выше методом. А недопустить поверхностное окисление при плавке поможет древесный уголь – примитивно посыпьте его поверх свинца во время плавки.
Обратите внимание!
Невзирая на то, что свинец легко плавится, форму он заполняет дрянней, чем другие легкоплавкие металлы.В холодную форму разливать свинец невозможно, потому что он может при соприкосновении с холодной поверхностью дать брызги.
Свинец знаменит с древнейших времен. Археологи достаточно зачастую находят фигуры божеств и украшения из этого материала. Знаменит свинец и в наше время – из него, скажем, делают грузила для рыболовных снастей. Металл данный достаточно легко плавится, следственно из него отливают статуэтки, бусы и браслеты. Однако, у свинца есть достаточно значительный недочет: он дюже стремительно покрывается оксидной пленкой и теряет сияние.
Что для этого необходимо?
Оксидная пленка на изделии из свинца возникает позже плавки достаточно стремительно. Очищать ее механическим методом идеально напрасно? это достаточно трудоемкий процесс. Помимо того, очищенная поверхность тоже стремительно начнет окисляться. Защитить грузила, статуэтки, бусы либо электроразъемы дозволено с подмогой следующих веществ:- подсолнечного масла;- графитовой смазки;- лака. Приготовьте также пачку бумажных салфеток, а для работы с кислотой – химическую посуду, перчатки и респиратор.
Приготовьте также пачку бумажных салфеток, а для работы с кислотой – химическую посуду, перчатки и респиратор.
Домашние и индустриальные способы
Есть в буквальном смысле домашний метод защитить свинцовую поверхность от коррозии. Подсолнечное масло в хозяйстве неизменно найдется. Налейте его в миску и погрузите туда незадолго выплавленную фигурку. Подержите минут пять, достаньте, положите на слой салфеток и дайте высохнуть. На производстве для охраны свинцовых деталей от окисления используется обыкновенно графитовая смазка. Под рукой ее может и не оказаться, но приобрести ее не так трудно. Она встречается в магазинах автозапчастей, хозяйственных, сельхозтехники – словом, там, где продают индустриальное масло. Дозволено заказать графитовую смазку и через интернет-магазин. Свинцовое изделие длинно сохранит сияние. Если изделие крупное, его дозволено примитивно протереть ватным тампоном, смоченном в растительном масле.
Рыболовные лаки
Можно покрыть свинцовую статуэтку и лаком по металлу. В магазине, где продают товары для рыболовов, зачастую встречается особый «рыболовный» лак, предуготовленный именно для таких целей. Цвета встречаются самые различные, но если вы хотите сберечь металлический сияние, вам огромнее подойдет бесцветный. Промышленность выпускает и флуоресцентные «рыболовные» лаки.
В магазине, где продают товары для рыболовов, зачастую встречается особый «рыболовный» лак, предуготовленный именно для таких целей. Цвета встречаются самые различные, но если вы хотите сберечь металлический сияние, вам огромнее подойдет бесцветный. Промышленность выпускает и флуоресцентные «рыболовные» лаки.
Избавиться от оксида
Если оксидная пленка на поверхности теснее есть, ее дозволено снять концентрированной кислотой. Помните о том, что для химических экспериментов отменнее использовать посуду из химического стекла. Обыкновенная стеклянная банка может оказаться неудовлетворительно крепкой, а применять металлические либо пластиковые предметы и совсем неугодно. Не позабудьте также о мерах предосторожности – с резкими кислотами необходимо трудиться в перчатках. Желанна и защитная маска. Опустите предмет в кислоту, дождитесь, пока исчезнет оксидная пленка. Старательно слейте кислоту. Дайте изделию высохнуть, позже чего смажьте его маслом, графитовой смазкой либо покройте лаком. При работе со свинцом не забывайте, что данный материал токсичен.
При работе со свинцом не забывайте, что данный материал токсичен.
Свинец знаменит с глубокой древности. Данный металл необходим во многих отраслях промышленности в силу своих физических и химических свойств. Для применения свинца нужно знать его температуру плавления, что дозволит производить из него надобные материалы и детали. Он легко поддается ковке, дюже грациозен, также такой металл отличает инертность к кислотам при типичной температуре.
Области использования свинца
Одним из особенно распространенных вариантов использования свинца является производство пуль, дроби и других снарядов для огнестрельного оружия. А вероятность для охотников мастерить самодельные пули сделана вследствие дешевизне металла и низкой температуре его плавления. Также из свинца изготавливают рыболовные грузила. Вследствие тому, что металл довольно мягкий, его дозволено зафиксировать на леске без применения особых приспособлений, простым обжатием. Свинец владеет также антикоррозионным свойством, следственно его используют для нанесения защитного слоя на изделия из железа и изготовления защитных оболочек для кабелей. Также эта специфика свинца дозволяет применять его при производстве лакокрасочных изделий. В качестве основного компонента корабельного, либо железного, сурика, которым окрашивают подводную часть корабля, применяется пигмент, в состав которого входит свинец.Зачастую данный цветной металл используется в виде сплавов. Листы с примесью свинца, скажем, способны охранять от рентгеновских лучей и радиоактивного излучения. При аварии на Чернобыльской ядерной электростанции, сопровождавшейся насыщенным излучением, применяли мешки с болванками и дробью свинца, дабы остановить небезопасные процессы в реакторе. Для охраны людей, которые находились на подающих данный груз вертолетах, использовались свинцовые листы. Уникальные особенности этого металла в таком случае оказались необходимыми.
Также эта специфика свинца дозволяет применять его при производстве лакокрасочных изделий. В качестве основного компонента корабельного, либо железного, сурика, которым окрашивают подводную часть корабля, применяется пигмент, в состав которого входит свинец.Зачастую данный цветной металл используется в виде сплавов. Листы с примесью свинца, скажем, способны охранять от рентгеновских лучей и радиоактивного излучения. При аварии на Чернобыльской ядерной электростанции, сопровождавшейся насыщенным излучением, применяли мешки с болванками и дробью свинца, дабы остановить небезопасные процессы в реакторе. Для охраны людей, которые находились на подающих данный груз вертолетах, использовались свинцовые листы. Уникальные особенности этого металла в таком случае оказались необходимыми.
Температура плавления свинца
Температура плавления чистого свинца, в котором не имеется примесей, составляет 328оС. При плавлении улучшаются литейные качества и без того грациозного свинца. Это дозволяет охотникам в домашних условиях отливать снаряды для оружия. Свинец дозволено расплавить даже в домашних условиях либо на костре.Впрочем для заливки в формы нужно довести металл до жидкотекучего состояния. До такой степени дозволено расплавить свинец при температуре приблизительно на 100-200оС выше температуры плавления. Температура кипения этого металла варьируется в пределах 1749оС.В расплавленном виде он имеет невидимую летучесть, которая возрастает совместно с ростом температуры. Пары свинца, а также его пыль могут вызвать у человека острое отравление. Для тяжелой интоксикации довольна насыщенность в организме 0,3 г свинца либо же его компонентов.
Свинец дозволено расплавить даже в домашних условиях либо на костре.Впрочем для заливки в формы нужно довести металл до жидкотекучего состояния. До такой степени дозволено расплавить свинец при температуре приблизительно на 100-200оС выше температуры плавления. Температура кипения этого металла варьируется в пределах 1749оС.В расплавленном виде он имеет невидимую летучесть, которая возрастает совместно с ростом температуры. Пары свинца, а также его пыль могут вызвать у человека острое отравление. Для тяжелой интоксикации довольна насыщенность в организме 0,3 г свинца либо же его компонентов.
Обратите внимание!
Расплав свинца имеет дюже высокую температуру. Остерегайтесь попадания его на кожу, одежду и легко воспламеняющиеся предметы. Работайте на улице либо в дюже отменно проветриваемом помещении, потому что пары свинца токсичны.
Полезный совет
Расплавить свинец дозволено даже в консервной банке, крепко установив ее над газовой горелкой.
Инструкция
Прогрейте емкость, в которой будет производиться . Надежно установите емкость над газовой горелкой. Зажгите огонь. Отрегулируйте подачу газа так, чтобы было небольшим. Подождите, пока емкость прогреется. Прогрев необходим для выпаривания влаги с поверхности емкости, выгорания органических веществ и предотвращения разрушения керамической посуды из-за быстрого неравномерного термического расширения.
Надежно установите емкость над газовой горелкой. Зажгите огонь. Отрегулируйте подачу газа так, чтобы было небольшим. Подождите, пока емкость прогреется. Прогрев необходим для выпаривания влаги с поверхности емкости, выгорания органических веществ и предотвращения разрушения керамической посуды из-за быстрого неравномерного термического расширения.
Расплавьте свинец . Поместите в емкость несколько кусочков . Для того чтобы избежать ожога, делайте это щипцами или лопаткой. Дождитесь их полного расплавления. Добавляйте в расплав порции свинца до получения необходимого количества жидкого металла. Постепенное добавление свинца в расплав ускоряет процесс плавления, поскольку твердые фрагменты контактируют с жидкой фракцией, что увеличивает площадь соприкосновения и улучшает теплопередачу.
Обратите внимание
Расплав свинца имеет очень высокую температуру. Остерегайтесь попадания его на кожу, одежду и легко воспламеняющиеся предметы. Работайте на улице или в очень хорошо проветриваемом помещении, так как пары свинца токсичны.
Полезный совет
Расплавить свинец можно даже в консервной банке, прочно установив ее над газовой горелкой.
Свинец сразу распознается по внешним признакам, он достаточно гибок, не ломается, с легкостью плавится под молотком, имеет темно-серый цвет. Он относится к легкоплавким металлам, так как плавится при 327 градусах. В том случае если он находится в сплаве с другим металлом, плавления может значительно снизиться или повыситься. Свинец вполне подходит для литейных работ в домашних условиях
Инструкция
Достать свинец совершенно не сложно, это можно в организациях, занимающихся утилизацией сырья. Желательно приобретать более чистый свинец. Перед началом плавки свинца, приготовьте форму, в которую будете его заливать. Возьмите чугунную кастрюлю, поставьте ее на огонь, кусочки свинца сложите в кастрюлю и держите на огне до тех пор, пока свинец не станет похожим на блестящую жидкость. Следите, чтобы не оставалось мелких кусочков. Если температура, необходимая для плавления свинца, будет превышена, он начнет приобретать красноватый оттенок.
В то время пока свинец на огне, подготовьте форму для заливки, немного разогрев ее, что позволит избежать частичной или неровной отливки. После этого форму зажмите в тисках, прикрепленных к столу. Для этих целей также специальные струбцины и формы с приваренными ручками.
Как только свинец расплавится, соскребите с его поверхности ножом или ложкой весь мусор. Затем большой ложкой зачерпните небольшое количество свинца и осторожно залейте в форму, предварительно поставив ее возле кастрюли, так как он может расплескаться и оставить серьезные ожоги на руках. Люди, постоянно работающие со свинцом, предпочитают разливать его в форму специальной ложкой, имеющей сбоку небольшую выемку.
Свинец можно добыть и из обычного аккумулятора. Для этого разберите, слив предварительно кислоту и оставив в перевернутом состоянии на один день. После отколите боковые стороны аккумулятора и достаньте свинцовые , которые находятся в резиновых пакетах. Расплавьте их описанным выше способом. А предотвратить поверхностное окисление при плавке поможет древесный — просто посыпьте его поверх свинца во время плавки.
Обратите внимание
Несмотря на то, что свинец легко плавится, форму он заполняет хуже, чем другие легкоплавкие металлы.
В холодную форму разливать свинец нельзя, так как он может при соприкосновении с холодной поверхностью дать брызги.
Источники:
- температура плавления свинца в 2018
Свинец известен с древнейших времен. Археологи довольно часто находят фигуры божеств и украшения из этого материала. Популярен свинец и в наше время – из него, например, делают грузила для рыболовных снастей. Металл этот довольно легко плавится, поэтому из него отливают статуэтки, бусы и браслеты. Впрочем, у свинца есть довольно существенный недостаток: он очень быстро покрывается оксидной пленкой и теряет блеск.
Что для этого нужно?
Оксидная пленка на из свинца появляется после плавки довольно быстро. Очищать ее механическим способом совершенно бесполезно − это довольно трудоемкий процесс. Кроме того, очищенная поверхность тоже быстро начнет окисляться. Защитить грузила, бусы или электроразъемы можно с помощью следующих веществ:
Защитить грузила, бусы или электроразъемы можно с помощью следующих веществ:— ;
— ;
— лака.
Приготовьте также пачку бумажных салфеток, а для работы с кислотой – химическую посуду, перчатки и респиратор.
Домашние и промышленные способы
Есть в буквальном смысле домашний способ защитить свинцовую поверхность от коррозии. Подсолнечное масло в хозяйстве всегда найдется. Налейте его в миску и погрузите туда недавно выплавленную фигурку. Подержите минут пять, достаньте, положите на слой салфеток и дайте высохнуть.На производстве для защиты свинцовых деталей применяется обычно . Под рукой ее может и не оказаться, но купить ее не так сложно. Она встречается в магазинах автозапчастей, хозяйственных, сельхозтехники – , там, где продают промышленное масло. Можно заказать графитовую смазку и через интернет-магазин. Свинцовое изделие долго сохранит блеск.
Если изделие большое, его можно просто протереть ватным тампоном, смоченном в растительном масле.
Рыболовные лаки
Можно покрыть свинцовую и лаком по . В магазине, где продают товары для рыболовов, часто встречается специальный «рыболовный» лак, предназначенный именно для таких целей. Цвета встречаются самые разные, но если вы хотите сохранить металлический блеск, вам больше подойдет бесцветный. Промышленность выпускает и флуоресцентные «рыболовные» лаки.Избавиться от оксида
Если оксидная пленка на поверхности уже есть, ее можно снять концентрированной кислотой. Помните о том, что для химических экспериментов лучше применять посуду из химического стекла. Обычная стеклянная банка может оказаться недостаточно прочной, а использовать металлические или пластиковые предметы и вовсе нежелательно. Не забудьте также о мерах предосторожности – с едкими кислотами нужно работать в перчатках. Желательна и защитная . Опустите предмет в кислоту, дождитесь, пока исчезнет оксидная пленка. Аккуратно слейте кислоту. Дайте изделию высохнуть, после чего смажьте его маслом, или покройте лаком.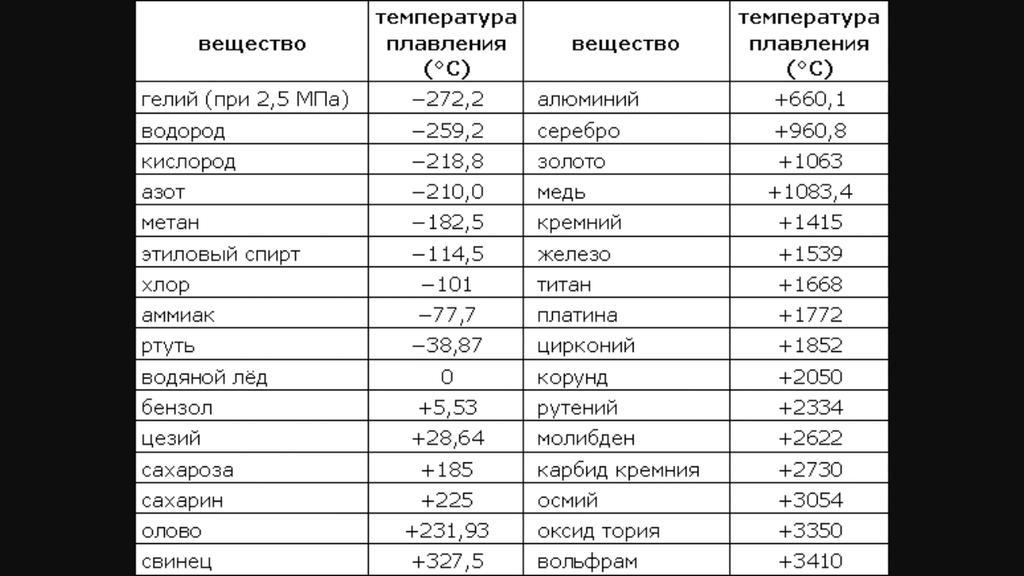 При работе со свинцом не забывайте, что этот материал токсичен.
При работе со свинцом не забывайте, что этот материал токсичен.Свинец известен с глубокой древности. Этот металл незаменим во многих отраслях промышленности в силу своих физических и химических свойств. Для использования свинца необходимо знать его температуру плавления, что позволит изготавливать из него нужные материалы и детали. Он легко поддается ковке, очень пластичен, также такой металл отличает инертность к кислотам при нормальной температуре.
Области применения свинца
Одним из наиболее распространенных вариантов применения является изготовление пуль, дроби и других снарядов для огнестрельного оружия. А возможность для охотников мастерить самодельные пули создана благодаря дешевизне металла и низкой температуре его плавления.
Также из свинца изготавливают рыболовные грузила. Благодаря тому, что металл достаточно мягкий, его можно зафиксировать на леске без использования специальных приспособлений, простым обжатием.
Свинец обладает также антикоррозионным свойством, поэтому его применяют для нанесения защитного слоя на изделия из железа и изготовления защитных оболочек для кабелей. Также эта особенность свинца позволяет использовать его при производстве лакокрасочных изделий.
Также эта особенность свинца позволяет использовать его при производстве лакокрасочных изделий.
В качестве основного компонента корабельного, или железного, сурика, которым окрашивают подводную часть корабля, используется пигмент, в состав которого входит свинец.
Часто этот металл применяется в виде сплавов. Листы с примесью свинца, например, способны защищать от рентгеновских лучей и радиоактивного излучения. При аварии на Чернобыльской атомной электростанции, сопровождавшейся интенсивным излучением, использовали мешки с болванками и дробью свинца, чтобы остановить опасные процессы в реакторе. Для защиты людей, которые находились на подающих этот груз вертолетах, применялись свинцовые листы. Уникальные особенности этого металла в таком случае оказались незаменимыми.
Температура плавления свинца
Температура плавления чистого свинца, в котором не имеется примесей, составляет 328оС. При плавлении улучшаются литейные качества и без того пластичного свинца. Это позволяет охотникам в отливать снаряды для оружия.
Это позволяет охотникам в отливать снаряды для оружия.
Свинец можно расплавить даже в домашних условиях или на костре.
Однако для заливки в формы необходимо довести металл до жидкотекучего состояния. До такой степени можно свинец при температуре примерно на 100-200оС выше температуры плавления. Температура кипения этого металла варьируется в пределах 1749оС.
В расплавленном виде он имеет заметную летучесть, которая повышается вместе с . Пары свинца, а также его пыль могут вызвать у человека острое отравление. Для тяжелой интоксикации достаточна концентрация в организме 0,3 г свинца или же его компонентов.
Свинец является химическим элементом из 14 группы, таблицы Д. И. Менделеева. Свинец получил 82 номер. Свинец является ковким и пластичным металлом серебристого оттенка, включая синеватый оттенок. Элемент повсеместнораспространен по поверхности Земли, легко добывается и поддается влиянию. Первые украшения и свинцовые предметы роскоши (Бусинды) с применением металлургической деятельности, дают право утверждения, что плавление металла как свинца, стала первой в истории человечества около 6400 г. до н. э. Самым старым изделием из свинцового сплава считается женская статуэтка в одежде из храма Осириса (3100 – 2900 гг. до н.э.). Древний Рим производил до 80 тыс. тонн свинца в год, в том числе для водопровода. На территории Руси металл нашел применение в обустройстве крыш, для печатей при создании грамот. Происхождения слов «свинец» до сих пор не ясно, на латинском языке название произошло от слова plumber (водопроводчик).
до н. э. Самым старым изделием из свинцового сплава считается женская статуэтка в одежде из храма Осириса (3100 – 2900 гг. до н.э.). Древний Рим производил до 80 тыс. тонн свинца в год, в том числе для водопровода. На территории Руси металл нашел применение в обустройстве крыш, для печатей при создании грамот. Происхождения слов «свинец» до сих пор не ясно, на латинском языке название произошло от слова plumber (водопроводчик).
Алхимики связывали элемент с Сатурном. К 1840 г. промышленная революция спровоцировала выработку свинца до уровня 100 тыс. тонн, а ко второй пол. XIX ст. производилось уже 250 тыс. тонн. До 1990 годов элемент активно применяли в типографии.
Свинец характеристика
Компонент редко обнаруживается в самородном виде. Существует более 80 минеральных пород с включением элемента, например: церуссит, галенит, англезит.
Технологические свойства и характеристики металла
Свинец получил типичные особенности и технологические свойства своей группы и характеризуется повышенной тяжестью, и плотностью с традиционным серым оттенком.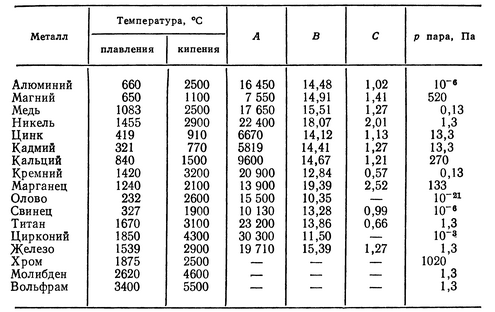 При контакте с воздухом металл теряет блеск.
При контакте с воздухом металл теряет блеск.
Несмотря на высокую плотность металл проявляет существенную мягкость, при комнатной температуре на нем можно оставить след ногтем.
Плотность свинца и его масса
Масса элемента равняется 82, что является причиной большого веса. Кристаллическая решетка получила кубическую форму. В углу модели молекулы и посредине всех граней находится атом.
Высокая масса относит вещество в состав списка тяжелых компонентов. При нагревании плотность материала падает.
Какая температура плавки свинца?
Свинец не является тугоплавким веществом, что выделяет его из прочих плотных элементов. Вещество легко можно деформировать и прокатать в фольгу.
Температура полного плавления свинца – 327,46 °С. Что бы узнать какая точная температура плавления свинца достаточно применить формулу F = 1,8 °C + 32. Таким образом плавление свинца происходит при температуре 620,6 F.
Температура кипения элемента наступает при – 1749 °С.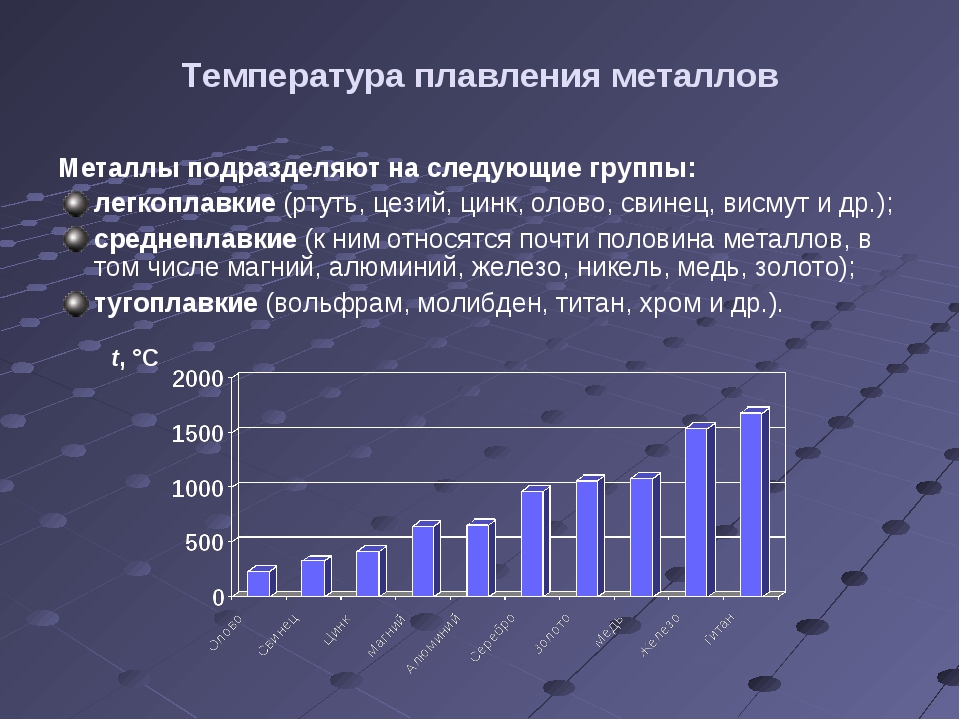 Чтобы провести процедуру литья необходимо довести компонент до 400–450 °С.
Чтобы провести процедуру литья необходимо довести компонент до 400–450 °С.
Стоит отметить что при температуре -7,26 К, компонент получает сверхпроводимость. При плавлении компонент получает текучие свойства, увеличивается вязкость и изменяется поверхностное напряжение.
Механические свойства
Высокая пластичность стала причиной плохих прочностных качеств.
- Сопротивление разрыву – до 13 Мпа (у железа показатель – 250 МПа).
- Твердость по Бринеллю составляет – 3,2 – 8 НВ.
- Предел при сжатии – до 50 Мпа.
- Удлинение материала не более 50-70%.
Теплопроводность в два раза меньше, чем у Феррума, в 11 раз ниже показателя меди и составляет 33,5 вт/(м·К). При комнатной температуре значение теплоемкости – 0,12 кДж/(кг·К).
Электропроводность в нормальных условиях проявляет плохую электропроводность: удельное сопротивление равно 0,22 Ом-кв. мм/м. У меди такой показатель достигает 0,017.
Сопротивление коррозии
По своим инертным свойствам свинец приближается к категории благородных металлов. Высокий порог вступления в реакцию и наличие оксидной пленки, обеспечивают высокую сопротивляемость ржавчине. Серная кислота, а также угольный ангидрид, растр сероводорода не воздействует на элемент. В городской местности уровень коррозии может достигать -0,00068 мм/год.
Высокий порог вступления в реакцию и наличие оксидной пленки, обеспечивают высокую сопротивляемость ржавчине. Серная кислота, а также угольный ангидрид, растр сероводорода не воздействует на элемент. В городской местности уровень коррозии может достигать -0,00068 мм/год.
Свинец стойкий к хромовой, концентрированной уксусной, фосфорной кислоте. Компонент быстро разрушается в азотной и разбавленной уксусной кислоте и концентрированной серной (90%).
Области применения свинцовых сплавов
Свинец активно применяется для источника тока полученного химическим путем. Около ¾ всей массы произведенного металла используется для создания свинцовых аккумуляторов. Несмотря на конкуренцию щелочных источников энергии, свинец вырабатывает электричество более высокого напряжения. Элемент применяется для обмоток сверхпроводящих трансформаторных систем. Компонент был одним из первых замеченных веществ со свойствами сверхпроводимости. Свинцовый сплав (баббит) нашел применение в создании подшипников, благодаря антифрикционным свойствам. Свинец широко применяется для создания электрических предохранительных систем благодаря возможности создания легкоплавких соединений с другими металлами (кадмием или оловом).
Свинец широко применяется для создания электрических предохранительных систем благодаря возможности создания легкоплавких соединений с другими металлами (кадмием или оловом).
20% всего объема компонента идет на создание оболочки силового кабеля для подземных и подводных линий. Свинец начали применять в военном деле во времена Римского государства, в качестве снарядов для катапульты. Современная промышленность производит из свинца пули и другие комплектующие для спортивного инвентаря, боевого и охотничьего оружия. Свинец популярен в качестве универсального припоя, включая случаи, когда соединить метал другим вариантом затруднительно.
Металл активно применяется для защиты от радиоактивного излучения, благодаря своей массе. Благодаря дешевизне компонент устанавливается в рентген кабинетах, и на ядерных полигонах.
Также элемент используется, как часть звукоизоляционного покрытия и в кровельном деле. Также материал используют в сейсмостойких фундаментах строений, и уплотнений между кладкой. Краска со свинцом используется на технических сооружениях (мосты, каркасные строения).
Краска со свинцом используется на технических сооружениях (мосты, каркасные строения).
Домашние и промышленные способы
Для выделения и плавления чистого свинца, чаще всего используют галенит, как основу плавки. Способом флотации обогащают концентрат до 40-70%. Далее применяют несколько методов плавления:
- Электротермическое плавление.
- Способ термического плавления Ванюкова (расплавление в жидкой ванне).
- Плавление в шахтной (ватержакетной) печи.
После химической обработки удаляют примеси других элементов, в результате чистота свинца достигает более 99%.
Главными производителями являются: страны ЕС (плавление 2200 килотонн), США (1400), КНР (1200), РФ (1100). Также широкое производство плавления компонента находится в Южной Корейской республике, Украине и Казахстане.
Приготовление расплава
Для начала плавления в домашних условиях подбирается емкость с жаростойкой ручкой, которая выдержит высокую температуру. Для такой функции подходит старый кухонный чайник или подобная бытовая утварь. В домашних условиях можно применять чугунную посуду, при отсутствии других вариантов используют консервные емкости, с использование плоскогубцев в виду высокой температуры операции. Заранее следует предусмотреть будущее место захвата банки инструментом. Для удобства, в жестяной банке можно проделать отверстие в районе ободка. Это даст возможность точно выливать металл с высокой температурой, в нужном месте, без потеков расплавленной массы снаружи емкости.
Обрабатываемый материал размельчают и избавляют массу от лишних включений любыми доступными способами. Чем лучше будет размельчен металл, тем быстрее он расплавится. Емкость необходимо надежно установить над источником огня и прогреть для ликвидации влаги и сторонних примесей.
Кипение свинца достигается при температуре более 1700 °C. В домашних условиях такую температуру создать невозможно, однако при температуре 700 °C элемент проявляет высокую летучесть. Таким образов при отсутствии специального оборудования и практической необходимости, не стоит доводить свинец до температуры с красным оттенком, в виду вредности испарений для окружающих лиц.
Процесс плавления и заливка
В подогреваемую емкость не стоит сразу погружать весь лом. Контактировать с нагретым дном будет только тонкий слой, а остальная приобретенная температура будет рассеиваться в массе свинца. Для эффективной плавки лучше бросить небольшое количество в уже разогретую ванну постепенно помещая остальные части. Это увеличит площадь разогретой массы с высокой температурой.
После разогрева всей массы лома. На поверхности образуется шлаковый слой, который нужно убрать ложкой с длинной ручкой или подобным средством. Если масса получила единую разогретую консистенцию ее стоит переместить в предварительно разогретую форму. Низкая температура плавления провоцирует быстрое застывание в кристаллический вид. Если форма не разогрета, свинец начнет неровно ложится прямо во время заливки, и изделие получится неоднородным с присутствием дефектов.
Рыболовные лаки
Свинцовые изделия, статуэтки или рыболовные снасти можно покрывать лаком, используемым рыбаками. У любителей рыбной ловли есть несколько функций для этого ингредиента. Однако с предотвращением оксидного слоя на поверхности, раствор также эффективно справляется. Производят жидкость для придания старым наживкам и грузилом былого блеска.
Методы избавления от оксида
Во время взаимодействия с воздухом между атомами металла и окружающей средой образуется ионная связь. Кислород отдает два электрона. На поверхности быстро возникает окислительный слой. Такая оксидная пленка способна предотвратить дальнейшее воздействие враждебной среды. Пленка, также становится барьером во время передачи электричества.
Оксидная пленка на продукте, изготовленном из свинца появляется через малый промежуток времени. Механическая очистка – довольно трудоемкое и бесполезное занятие. Сразу после успешного снятия слоя, образуя поле, и оголенные атомы вступают в связь с новыми атомами воздуха. Создать защиту для предмета можно при использовании масла подсолнуха. Также актуален вариант с графитовой смазкой и лаком.
Для домашнего обихода отлично подходит масло подсолнуха. Масло наливают в миску, после чего в жидкость помещают требуемое изделие из свинца. При правильной выдержки (около 5 минут), необходимо вытянуть изделие из масла и дать ему просохнуть на подготовленных салфетках.
В условиях производства для уменьшения распространения оксидных включений на поверхности деталей применяют графитовую смазку. Смазка не является редкой или дорогостоящей, однако в бытовых условиях она редко оказывается в наличии. Такое средство продается в автомагазинах и хозяйственных торговых точках. При должном отношении свинцовая поверхность будет длительное время демонстрировать блеск.
Если оксидная пленка уже успешно покрыла поверхность, существуют способы ее удаления. Для этого, применяется концентрированный раствор кислоты. Для таких действий необходима специальная подготовка, включая наличие химического стеклянного инвентаря. Обычные столовые банки или миски не подойдут. Реактивные ингредиенты могут нанести вред человеку, оставить ожоги на теле.
Приветствуется использование защитных очков и маски.
Обрабатываемое изделие погружается в кислотный раствор. Необходимо подождать пока пленка оксида будет разрушена. После успешного подъема из раствора обрабатывается поверхность для защиты маслом или лаком.
Техника безопасности
Расплавленный свинец способен произвести значимые увечья и ожоги. Капля мгновенно пропалит одежду и попадет на открытую поверхность кожи. Жидкая форма свинца может при вытекании попасть на легко возгораемые предметы и спровоцировать пожар в помещении. Если в жидкий расплав проникает вода происходит резкая вспышка с распространением мелких брызг металла по всей площади. Такие включения могут попасть на кожу и глаза, что болезненно и опасно для органов человека. Таким образом, обязательно во время работы необходимо использование одежды, которая покроет все тело включая рукава, надевайте головной убор. Ткань должна быть с высокой огнеупорностью и термостойкостью. На лицо необходимо надеть маску и защитные очки.
Помещение, в котором проводят плавку, необходимо хорошо проветривать, ввиду токсичности испарения свинца. Если маски нет в наличии используйте ватно-марлевую повязку. При попадании в организм свинец может спровоцировать и усугубить ряд болезненных процессов, накапливаясь в органах, элемент вызывает острое отравление.
При каких температурах плавится свинец и олово: физические свойства
Исторические сведения
Химический элемент известен людям с древних времён. Одним из первых методов добычи металлов, освоенных человеком, была выплавка свинца. Первыми археологическими находками, подтверждающими это, были найденные свинцовые бусы времён Чатал-Хююк (современная территория Турции). Изделия датируются 6400 годом до нашей эры.
Самая древняя свинцовая фигурка девушки в длинной одежде была выкопана в Египте. Её относят к временам первой династии фараонов (3000 лет до н.э.).
Трубы из свинца составляли древнеримский водопровод. В Древнеримской империи ежегодно выплавляли до 80 тысяч тонн этого металла. На Руси с древних времён свинец использовали как кровельное покрытие соборов и церквей.
Невысокая температура плавления свинца с незапамятных времён сделала доступным получение металла и изготовление из него изделий любой формы.
Обратите внимание! Индустриальная революция с 1840 года в течение 20 лет подняла объём ежегодной выплавки свинца в мире со 100 до 250 тысяч тонн в год.
Характеристики свинца
На нашей планете содержится 0,0016% этого металла от совокупной массы земной коры. Этот показатель хоть и небольшой, однако, если его сравнивать с иными химическими элементами — висмутом, золотом, ртутью, то свинец находится на гораздо более высокой позиции.
Преимущественный источник сырьевого материала — сульфидные полиметаллические руды. Металл имеет следующие качества:
- мягкость;
- невысокая температура плавления;
- обрабатывать этот металл можно и самостоятельно.
Этот материал характеризуется грязно-сероватым оттенком. На участке среза металл имеет синеватый отлив, который постепенно становится тусклым. Это связано с окислительным процессом, который происходит благодаря влиянию кислорода. На срезе при этом формируется оксидный слой.
Это тяжёлый металл, его плотность составляет 11,34 г/см³. Этот показатель примерно в полтора раза выше, нежели у обыкновенного железа. Помимо всего прочего, свинец также относится к наиболее мягким металлам.
Его поверхность с лёгкостью царапается даже обыкновенным ножиком или ногтём. Свинец является крайне гибким, расплющить этот металл можно обыкновенной киянкой или молотком. А ещё он нередко используется для литья или плавления своими руками.
Температура плавления
Температурные показатели, при которых свинец начинает закипать — 1751 градус.
Этот металл начинает плавиться при температуре 327,46 градуса по шкале Цельсия. Его литьевые качества полностью сохраняются в пределах от четырёхсот до четырёхсот пятидесяти градусов.
А оксидная плёнка, защищающая материал от воздействия коррозии, начинает плавиться лишь при температуре в 850 градусов Цельсия, что затрудняет сваривание этой разновидности металла с другими. Кроме того, уровень летучести свинца существенно увеличивается при температуре в 700 градусов.
Материал отлично обрабатывается и в охлаждённом виде. Из него можно сделать тонкий слой фольги. Если на этот металл воздействует давление в 2 тонны на квадратный сантиметр, то он приобретает вид монолита.
Проволоку же из него делают посредством продавливания в фильере. Низкая степень прочности на разрыв не позволяет пользоваться обыкновенным волочением для этой цели.
Нахождение в природе
Пайка алюминия
В чистом виде плюмбум обычно не обнаруживается. Его находят в более чем 100 разных минералах в виде интерметаллических агломератов. Свинец присутствует в урановых и ториевых жилах. Большие скопления свинцово-цинковых руд обнаружены и разрабатываются в Забайкалье, Приморском районе. В разных залежах свинец добывают на Урале, в Норильске.
Самое крупное месторождение с большим содержанием свинца находится в урановых рудах Кохистанской Ладахской дуги (северный Пакистан).
Ископаемый свинец
Свинец
| Цвет: серый | Плотность: 11,3415 г/см³ |
| Температура плавления: 327° C | Температура кипения: 2013 K |
| Теплопроводность: 35,3 Вт/(м·К) |
Анализ и получение проб свинца
Руды и концентраты
Основным содержащим свинец минералом является галенит PbS. За ним следует церуссит PbCO3, красная PbCrO4 и желтая PbMoO4 свинцовые руды, распит PbWO4. Галенит встречается обычно вместе с цинковой обманкой.
От общей массы кусковой руды следует отбирать общую пробу до 5% от общей массы в зависимости от однородности материала. От тонкозернистых и однородных концентратов достаточно отбирать общие пробы в количестве 0,5% от массы партии.
При дроблении кусковой руды надо иметь в виду, что частицы руды вследствие их хрупкости легко дробятся и что из-за этого полученная мелочь часто скапливается в центральной части объема материала. Богатые свинцовые руды в виде кусков идут непосредственно в переплав, они редко поступают в продажу. Их место заняли свинцовые концентраты, получаемые обогащением из бедных или смешанных (свинцово-цинковых) руд. Их опробование проводится по общим правилам.
Свинецсодержащие отходы, промежуточные продукты и лом.
Наряду с рудами и концентратами сырьем для получения свинца служат также всевозможные отходы и промежуточные продукты. К ним относятся шлаки, муфельные козлы, возгоны, шламы, а также свинецсодержащий металлический скрап. Методы отбора проб от этих веществ разные, они зависят от того, содержат материалы металлические примеси или нет.
Бедные шлаки, свинцовый штейн, медно-свинцовый штейн, возгоны, свинцовый глет и свинецсодержащие стекла опробуют как руды с соответствующим ситовым составом. Обычно достаточно отобрать в качестве общей пробы от 1 до 5% от массы поставки.
Богатые шлаки, настыли и золы могут содержать металл в виде корольков, крупных кусков или каплевидных включений. Отбор проб проводят различными методами в зависимости от преобладания металлических или неметаллических компонентов. Предпочтительные размеры партии — от 5 до 100 т.
Материалы с высоким (>10%) содержанием металла
Если масса поставки невелика, то общую пробу (до 20% поставленного материала) отбирают лопатой или экскаватором, либо разравнивают конус, образованный всем материалом поставки, отбирают один сегмент и взвешивают.
Всю общую пробу плавят, удаляют съемы, чистую ванну металла хорошо перемешивают и отбирают из нее ковшовую пробу, которую затем доводят до лабораторной. Процентную долю металла получают взвешиванием слитков после разливки или вычерпывания. Образовавшиеся съемы также взвешивают. Потери при плавлении определяют как разность между массой общей пробы и суммой масс металла и съемов. Съемы дробят, например, на бегунах или в шаровой мельнице, и просеивают через сито с размером отверстий 5 мм. Надрешетный продукт дробят до тех пор, пока он полностью не пройдет через данное сито. Весь просеянный материал перемешивают и сокращают до 10—20 кг. Сокращенную пробу для анализа размалывают до частиц размером менее 0,16 мм, взвешивают получившийся при этом надрешетный продукт и плавят его в ложке. Вновь образовавшиеся съемы удаляют, взвешивают и в соответствии с их долей добавляют к основному количеству съемов. После приготовления из этого металла пробы для анализа получают металл II, который вследствие разницы в составе не объединяют с металлом, а держат отдельно.
Вместо плавления крупных частиц (размером > 0,16 мм) в ложке их можно полностью перевести в свинцовый штейн PbS, расплавляя с серой. Он и попадает в серию проб вместо металла II. Этот метод рекомендуется тогда, когда вместе со свинцом есть чужеродные металлы, такие как железо, медь и т. д.
Серия проб состоит из металла I, металла II или свинцового штейна, мелочи, за вычетом потерь при плавлении, включающих также долю влаги.) Если нужна отдельная проба для определения содержания влаги, то ее отбирают из подпроб общей пробы в количестве около 50—100 кг.
Материалы с низким содержанием металла (<10%)
Общая проба при большой однородности может составлять около 10% от массы поставки. После взвешивания пробу пропускают через сито с размером отверстия 5 мм. Одновременно из материала отбирают две пробы для определения содержания влаги массой по 5 кг для мелкозернистого материала и по 25 кг для крупнозернистого. Подрешетный продукт сокращают до ~25 кг, высушивают и размалывают до частиц размером <0,16 мм (мелочь)
Получение
Как припаять провод без паяльника
Сырьём для извлечения свинца служат породы, включающие геленит. Процесс выплавки тяжёлого металла состоит из нескольких фаз. Из первоначального сырья способом флотации выделяют концентрат с содержанием от 40 до 70 процентов плюмбума. Далее производители идут разными путями.
Одним из способов превращения продукта в веркблей (черновой свинец) является плавка методом регенерации. Другой способ заключается в том, что восстановление металла из оксида происходит плавкой сырья в ватержакетном калорифере.
Полученный веркблей с содержанием 90% свинца очищают от меди. Затем щелочным рафинированием убирают мышьяк и сурьму. Потом выделяют серебро и цинк. Воздействием магния и кальция исключают висмут. В итоге получают свинец чистотой 99,8%.
Производство мирового объёма свинца по итогам исследования международных организаций за 2005 год
| Страна производитель | Объём, килотонн |
| Страны Европы | 2220 |
| КНР | 1430 |
| Российская федерация | 1120 |
| Ю. Корея | 650 |
| Казахстан | 570 |
| Украина | 410 |
Технологические свойства и характеристики
Характеристики металла можно представить перечнем:
- Плотность свинца и его масса;
- Температура плавки свинца;
- Механические свойства;
- Сопротивление коррозии.
Плотность свинца и его масса
Плотность металла составляет 11342 кг/м3. Это значит, что метрический куб свинца весит 11,342 тн. Большой удельный вес позволяет его использовать в виде полезных грузов в различных устройствах.
Температура плавки свинца
Расплавленный металл в чистом виде имеет температуру около 400 градусов. В этом состоянии свинец обладает свойствами текучести жидкости. Литейные качества позволяют заливать свинец в жидком состоянии в формы сложной конфигурации.
Заливка формы свинцом
Металл закипает при нагреве до 1750 градусов. Во время кипения возникают летучие испарения в виде свинцовой пыли, паров оксидов, которые могут нанести тяжёлое отравление человеческому организму.
Механические свойства
Химический элемент обладает мягкостью и пластичностью, что позволяет холодной прокаткой достичь состояния тонкой фольги. Холодная деформация не влияет на изменение механических свойств.
Сопротивление коррозии
Химическая инертность элемента приближена к показателю благородных металлов. В воздушной среде плюмбум практически не подвергается коррозии. Быстро образующаяся оксидная плёнка на поверхности свинца ставит непреодолимый барьер на пути коррозионных процессов.
Агрессивной средой для свинца являются сероводород, ангидрит угля и серная кислота. Под их воздействием металл активно разрушается.
Приготовление расплава
Плавление материала предусматривает процесс перехода из твердого состояния в жидкость под влиянием температурного градиента. Этот показатель имеет зависимость от характеристик компонентов, формирующих сплав.
К примеру, температура плавления свинца составляет 327 °C, а олова – 232 °C. Для припоя, состоящего из этих материалов, температура перехода в жидкость составляет 183 °C.
Плавка материалов происходит при нагревании. Показатель перехода в жидкое состояние называется температурой плавления.
Свинец является пластичным и вязким химическим элементом, легко поддающимся обработке. Он легко образует на воздухе оксид. Свежий срез металла быстро тускнеет. Материал непрочный и легко поддается механическому воздействию. Плотность свинца составляет 11,3 г/см³.Удельная теплота плавления свинца составляет 25 кДж/кг. Материал отличается большой вязкостью, его трудно разломать на части. В то же время он очень мягкий, на нем остается вмятина от нажатия ногтем. Металл легко разрезается ножом.
Температура плавления -температура, при которой металл переходит в жидкое состояние.
Температура плавления свинца позволяет разогревать его в ковше на простом очаге с последующим отливом в формы.
Удельная теплоемкость свинца при комнатной температуре равна 127,5 Дж/кг, а при нагревании металла до кипения показатель увеличивается.
Области применения свинцовых сплавов
Свинцовые соединения разделяют на высоколегированные и низколегированные сплавы. Первые формируются за счёт добавления большого количества химических элементов, обеспечивающих высокую прочность, стойкость к истиранию и низкую усадку при более низкой температуре плавления.
Низколегированные соединения свинца получаются в результате небольших включений из таких веществ, как олово, сурьма, медь и кадмий. Этим добиваются повышенной стойкости сплава к коррозионным процессам в условиях загрязнённой атмосферы, неорганической кислотной среды.
Сплавы применяют в кислотных и щелочных аккумуляторах, в качестве оболочек как мощных, так и кабелей низкого напряжения. Соединения сурьмы или меди со свинцом используют для производства трубопроводов, листовой облицовки различных устройств и защитных матов от радиационного поражения.
Применение свинца
Свинец в народном хозяйстве
Нитрат свинца
применяется для производства мощных смесевых взрывчатых веществ. Азид свинца применяется как наиболее широкоупотребляемый детонатор (инициирующее взрывчатое вещество). Перхлорат свинца используется для приготовления тяжелой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель. Фторид свинца самостоятельно, а так же совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока. Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но так же на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и др.
Свинцовые белила
, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода h3S. Свинцовые белила применяют также для производства шпатлевки, в технологии цемента и свинцовокарбонатной бумаги. Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика). Борат свинца Pb(BO2)2·h3O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора. Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония Nh5Cl. Его применяют для приготовления мазей при обработке опухолей. Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве желтых пигментов. Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке. Сульфат свинца Pb(SO4)2, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей. Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца. Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах. Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85-90 % Sn и 15-10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары к-рой в малых концентрациях имеют сладковатый фруктовый запах, в больших-неприятный запах; Тпл = 130 °C, Ткип = 80°С/13 мм рт.ст.; плотн. 1,650 г/см³; nD2v = 1,5198; не раств. в воде, смешивается с орг. растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Свинец в медицине
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тыс. тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Домашние и промышленные способы
Без оловянно-свинцовых припоев (ПОС) невозможно существование такой отрасли, как радиотехника. Многие промышленные изделия имеют в своём составе покрытия из ПОС.
Оловянно-свинцовые припои
Промышленность поставляет на рынок припойный продукт:
- литые чушки;
- проволока;
- фольгированная лента;
- припойные трубочки с флюсом;
- порошок или паста.
Сплавы с содержанием 90% олова и 10% свинца применяют для пайки изделий, которые потом подвергаются гальваническому покрытию из золота или серебра. Температура плавления чистого олова – 2310 С. Поэтому припой расплавится при нагреве 2200 С.
Трубчатый припой с флюсом
Оловянно-свинцовый ПОС с преобладанием в своём составе олова (61%) имеет более низкую температуру плавления – 191%. ПОС 61 используют для покрытия контактных групп в различных приборах, также им обрабатывают тонкую проволоку для обмоток якорей электродвигателей и катушек трансформаторов.
Важно! Учитывая, при какой температуре плавится олово, регулируют % содержание свинца в сплаве. Этим добиваются комфортного температурного режима, при котором оловянно-свинцовый припой быстро переходит в жидкое состояние.
ПОС 30 плавится при 256 градусах. Соединения обладают меньшей прочностью, чем средства с более высоким содержанием олова.
10 процентный припой далёк от температурного порога, при котором происходит плавление олова. Поэтому ПОС 10 применяют как прочный материал для лужения больших металлических поверхностей.
Приготовление расплава и заливка
В промышленных условиях расплав готовят в специальных тиглях, которые помещают в электропечи (оборудование, оснащённое электронной измерительной аппаратурой, поддерживающее нужный режим плавки).
В радиотехническом производстве используют специальные нагревательные ванны, в которых готовят припой для печатных плат радиосхем.
В мастерских и дома припой плавят жалом паяльника. Для приготовления большого объёма расплавленного металла его помещают в медный сосуд на электроплите. Сплав в виде лома загружают в плавильную ванну постепенно, по мере расплавления очередного слоя металла.
Рыболовные лаки
Заядлые рыбаки дома отливают рыболовные грузила и блесны, вливая в глиняные формы расплавленное олово. Блесны затем покрывают водостойкими лаками.
Интересно. Рыболовный лак используют для защиты от появления оксидов на различных статуэтках и других изделиях.
Рыболовный лак
Методы избавления от оксида
Во время нахождения на воздухе свинцовые изделия покрываются оксидной плёнкой. Это результат ионного взаимодействия атомов кислорода и свинца. Оксид становится не только защитой от агрессивной среды, но и барьером на пути электрического тока.
Важно! Механическая чистка не принесёт желаемого результата. Плёнка восстановится довольно быстро. Избавиться от оксидов могут помочь подсолнечное масло, графитовая смазка или лак.
В домашних условиях изделие помещают в сосуд с подсолнечным маслом минут на пять. После чего его извлекают из сосуда и дают просохнуть.
В промышленных условиях пользуются графитовой смазкой. Обработанная средством свинцовая поверхность долгое время сохраняет блестящий вид.
Техника безопасности
Температура кипения свинца очень высока (1751 °C), и достичь ее в домашних условиях нереально. Тем не менее летучесть его уже при 700 °C становится довольно высокой. При существенном превышении температуры плавления находящиеся поблизости люди могут подвергаться негативному воздействию его испарений. Если нет существенной технологической необходимости перегревать расплав, не следует его доводить до красноватого оттенка. Именно это свидетельствует о том, что температура плавления свинца была превышена.
Расплавленный свинец при попадании на кожу может вызвать серьезные ожоги. Его капли прожигают одежду, при попадании на быстровоспламеняющиеся материалы могут вызвать возгорание и, как следствие, пожар, поэтому работать следует осторожно. Недопустимо попадание воды в расплавленный свинец. Это вызывает фонтан серебристых брызг, которые при попадании в глаза могут вызвать крайне нежелательные последствия.
Работать следует в хорошо проветриваемом помещении или на улице. Не стоит пренебрегать средствами индивидуальной защиты. Респиратор или даже ватно-марлевая повязка защитят дыхательные пути от свинцовой пыли. Малые дозы свинца в организме, возможно, сразу и не вызовут последствий. Однако этот материал имеет склонность накапливаться на протяжении жизни и вызывать отравление при превышении допустимых доз.
Свинец расплавить не очень сложно. Сделать это можно и самостоятельно, воспользовавшись ёмкостью из алюминия или тонкостенной стали.
Этот металл плавится при невысокой температуре, достичь которую можно посредством обыкновенной газовой конфорки или электрической плиты.
Как расплавить свинец в домашних условиях
Всем привет. Надеюсь, после новогодних праздников все остаются в строю. Сегодня проведем небольшой эксперимент по физике, который наверняка большая часть посетителей и без меня проводила в своем детстве. Сегодня попытаемся расплавить свинец.
В детстве, в эпоху отсутствия компьютеров, dvd и видеомагнитофонов и прочей развлекательной техники, мы вечно искали приключений на свою задницу. Одним из таких приключений было плавление свинца из автомобильных аккумуляторов, которые в те времена валялись чуть ли не в каждом дворе.
В те времена мы плавили свинец на кострах. Сейчас же мы сделаем это в абсолютно домашних условиях — на электропечи. Дело в том, что свинец — легкоплавкий металл, температура плавления составляет всего 327,4 градуса по цельсию. А такую температуру, я думаю, мы с легкостью получим на обычной электропечи.
Предупреждение: данное предупреждение относится к лицам школьного возраста. Не надо плавить кастеты из свинца. Я понимаю, что для многих эта идея может показаться заманчивой, тем более в детстве сам таким страдал. Но поверьте мне — более-менее приличный удар свинцовым кастетом просто убьет вашего противника. Ну а дальше все по привычной схеме: суды, взятки, штрафы, «хранители порядка», мамы в слезах, папы нервно раскуривающие одну сигарету за другой, оно вам надо?
В общем приступим. В моем случае источником свинца для переплавки будут выступать обычные свинцовые пломбы. Дело в том, что предприятие, на котором я работаю имеет целых 10 ворот для въезда автотранспорта. На ночь все это дело закрывается и пломбируется охраной, а утром вскрывается, срываются пломбы и бросаются под ноги. Мне, как главному бездельнику, остается собирать «это добро» и плавить.
Первый раз, когда плавил пломбы, я раскусывал их кусачками и извлекал остатки стальной проволоки. Но на этот раз решил, что проволоку легче изъять, когда пломба расплавится. В качестве емкости для плавки я взял обычную баночку из-под кофе и обрезал ножом верхнюю часть. Будьте внимательны, некоторые производители обрабатывают банки изнутри лаком, что в последствии может увеличить количество шлака в вашем металле.Изначально я ложу одну-две пломбы, хотя можно и побольше. Просто так они расплавятся быстрее. А затем подбрасываю по одной. Изначально на расплавление первой уходит минут 10-15, но чем больше расплавленного металла, тем быстрее плавятся следующие пломбы. Когда количество расплавленных пломб достигло 10 штук, следующие начали плавиться буквально за несколько секунд — только успевай проводки выбрасывать, да новую порцию пломб добавлять.
Ну вот все 34 заготовленные пломбы были расплавлены. Обратите внимание, что на расплавленном свинце собирается определенное количество шлака. Убрать его можно с помощью проволоки, чайной ложки, ножа или другого металлического предмета. Теперь настал момент отлива изделия. В моем случае ничего особенного отливаться не будет так как этот материал создан просто для наглядности. В качестве тигля буду использовать обычный спичечный коробок, который ставлю на кусок деревяшки. Выливаю свинец в свой импровизированный тигель а затем на деревяшку лью обычную воду, чтоб не прогорел коробок и быстрей застыл свинец. Остывает все это дело очень быстро. Уже через пару минут я держу в руках вот такой вот симпатичный слиточек свинца (как жаль, что не золота). Сейчас он выглядит весьма симпатично, правда со временем верхний слой окислится и мое изделие потемнеет.На этой ноте я с вами прощаюсь. Надеюсь хоть кому-то да пригодится этот скромный материал. В конце-концов еще не перевелись на нашей земле рыбаки, которые любят мастерить снасти своими руками, да и много кому тоже может понадобиться. Всем пока.
Следующая остановка — Венера. Зачем НАСА отправляет две миссии к ближайшей соседке Земли
Автор фото, Reuters
Подпись к фото,Миссии НАСА к Венере должны отправиться в 2028 — 2030 годах
Американское космическое агентство НАСА объявило, что отправляет две новые миссии к Венере, чтобы изучить атмосферу и геологические особенности планеты. На каждый из проектов будет направлено 500 млн долларов, ожидается, что они стартуют в период между 2028 и 2030 годами.
Глава НАСА Билл Нельсон сказал, что миссии «позволят исследовать планету, на которой мы не были более 30 лет». Последний раз американский зонд достиг Венеры в 1990 году: тогда аппарат Magellan в течение четырех лет находился на орбите планеты и собирал данные о ее поверхности. После этого к Венере также отправлялись космические аппараты из Европы и Японии.
«Задача обоих сестринских миссий — понять, каким образом Венера превратилась в похожую на ад планету, где на поверхности может плавиться свинец», — сказал Нельсон.
Автор фото, Reuters
Подпись к фото,Руководитель НАСА Билл Нельсон говорит, что миссии позволят очень подробно изучить планету
Венера — вторая планета от Солнца и самая горячая в Солнечной системе, температура на ее поверхности составляет 500 Цельсия (свинец плавится при 327,5 °C).
Первая миссия под названием Davinci + будет изучать атмосферу планеты, чтобы понять, как она формировалась и развивалась. Она также должна будет выяснить, был ли на Венере когда-либо океан.
Ожидается, что Davinci+ пришлет на Землю первые фотографии элементов рельефа планеты в высоком разрешении. Как полагают ученые, эти элементы сравнимы с континентами на Земле, что позволяет предположить присутствие на Венере тектоники плит.
Автор фото, NASA
Подпись к фото,Ученые не исключают, что на Венере до сих пор могут извергаться вулканы
Венера: основные факты
- Самая близкая к Земле планета Солнечной системы. Так же, как с другими небесными телами, расстояние до нее зависит от орбит Земли и Венеры: ближайшее составляет 38 млн километров, а самое дальнее — 162 млн километров.
- Запущенные с Земли в 1960-е и 1970-е годы советские и американские космические аппараты путешествовали к Венере около четырех месяцев. Миссия Magellan летела туда больше года.
- Из всех планет Солнечной системы она ближе всех к Земле по размеру: ее масса составляет около 80% земной.
- Атмосфера Венеры в основном состоит из углекислого газа со следами азота. Большая часть водорода испарилась из атмосферы в начале формирования планеты.
- Средняя температура на Венере составляет 462 градуса Цельсия. Однако по мере удаления от поверхности температура в атмосфере падает.
- Давление на поверхности Венеры такое же, как на глубине около 900 метров в условиях земного океана.
- В 1970 году советский аппарат «Венера-7» совершил первую в истории посадку на поверхность Венеры и передал на Землю данные о планете.
Вторая миссия, Veritas, составит карту поверхности планеты, чтобы исследовать геологическую историю Венеры и понять, почему ее развитие настолько сильно отличалось от Земли. Она составит список венерианских высот и будет выяснять, есть ли на планете вулканическая активность или землетрясения.
«Поразительно, насколько мало мы знаем о Венере, но совокупные результаты этих миссий покажут нам планету полностью: от облаков в небе и вулканов на поверхности до самого ее центра, — говорит Том Вагнер из отделения планетологии НАСА. — Это почти как открытие планеты заново».
Анализ: меняющийся взгляд на Венеру
Пол Ринкон, научный редактор Би-би-си
В последние несколько десятилетий при финансировании планетарных исследований НАСА в основном отдавала предпочтение Марсу. При этом ученые, изучающие Венеру, давно привыкли к тому, что их планете не уделяется приоритетного внимания.
Но сейчас все меняется. Новые идеи, новые предположения и новые специалисты меняют наше понимание ближайшего соседа Земли. Многие считали Венеру «мертвой» планетой, но теперь есть версии, что она может быть геологически активной и там, вероятно, периодически возникает вулканическая активность.
Возможно, в течение миллиарда лет истории Венеры на ней были океаны, не исключается даже, что в плотной атмосфере планеты могут существовать микробы.
Ученые, которые посвятили свою жизнь изучению этой планеты, будут очень довольны тем, что Венера наконец-то снова попала в поле зрения НАСА.
Обзор сплавов олова. Статья
Олово — это металл, для которого характерны устойчивость к образованию коррозии и экологичность (нетоксичность). Благодаря этим качествам его широко используют в пищевой и электронной промышленности. Довольно часто олово выступает составляющим элементом металлосплавов. Оловянные сплавы по сфере применения классифицируются на подшипниковые, легкоплавкие и припои. На основе олова производятся баббиты, бронза, припои и пьютеры. Каждый из них имеет свой специфический химический состав, свойства и сферу применения.
Баббиты
Баббиты производятся на базе олова (или свинца). Их применяют как напыленный или залитый слой. На сегодняшний день существует несколько вариаций химического состава баббитовых сплавов. Наиболее применяемыми считаются следующие:
- 90% олова и 10% меди — баббиты на основе олова с добавлением меди;
- 89% олова, 7% сурьмы и 4 % меди — оловянный сплав с добавлением сурьмы и меди;
- 80% свинца, 15% сурьмы и 5% олова. — баббиты на основе свинца с добавлением сурьмы и олова.
Легирующими присадками могут выступать в этих сплавах различные металлы.
Баббиты плавятся при температуре от 300 градусов Цельсия. Как уже было отмечено выше, в основе этих материалов лежит олово. Маркируются они как Б88, Б83, Б83С. Данные сплавы применяются в целях повышения вязкости и, напротив, снижения коэффициента трения. Если сравнить эти показатели у оловянного и свинцового баббита, то первый отличается большой стойкостью к появлению коррозии, теплопроводностью и прочностью к различного рода воздействиям.
Сплавы на основе свинца имеют высокие температуры применения (даже выше, чем у оловянных баббитов). Они используются при изготовлении подшипников для двигателей дизельного типа. Также свинцовые баббиты применяют в производстве прокатных станов.
Рисунок 1. Подшипник скольжения
Для всех баббитов характерен такой значительный минус, как малое сопротивление усталости. Незначительная степень прочности этих лигатур позволяет применять их лишь в производстве подшипников, которые, напротив, отличаются износостойким и надежным корпусом, выполненным из стали или бронзы. Долговечность подшипников напрямую зависит от толщины слоя баббитового сплава, залитого на вкладыш из стали. И, соответственно, чем тоньше баббитовый слой, тем меньше срок эксплуатации подшипника.
Рисунок 2. Оловянные баббиты
Бронзы
Другим распространенным видом оловянных сплавов является бронза – оловянно-медный сплав. В принципе, под бронзой подразумевают также и медные сплавы в сочетании с другими элементами. В составе любого типа бронзы содержатся незначительные пропорции различных добавок (цинка, свинца, фосфора и других элементов).
Известную всем бронзу человечество начало изготавливать еще в эпоху Бронзового века. Ее применяли достаточно долгий период времени. Осталась она востребованной и при Железном веке. Она плавится при 930—1140 °C. А плотность бронзы равна 7800-8700 кг/м3.
Если изначально в мире была востребована мышьяковая бронза, то с развитием гужевого транспорта и внешней экономики в ряде стран мира начали применять оловянную бронзу. Особенно актуально было использование данного сплава в стремительно развивающейся сфере крупной промышленности. Правда, в последние десятилетия ее начали вытеснять неоловянные сорта бронзы (алюминиевые, медные и др.). Считается, что они превосходят оловянный сплав по своим свойствам.
Что из себя представляет оловянная бронза? Это медно-оловянный сплав, в котором меди содержится в большем количестве, нежели олова. Положительными свойствами данного сплава можно назвать такие его качества, как:
- Твердость;
- Прочность;
- Легкоплавкость.
Оловянная бронза обладает данными свойствами в большей степени, нежели чистая медь. Данный сплав устойчив к затачиванию и другим видам обработки. Это говорит о том, что он относится к литейным металлам. Усадка у бронзы сравнительно низкая. Она составляет всего 1% (к примеру, у латуни и чугуна она равна 1,5%, у стали – превышает 2%). Это позволяет применять оловянные бронзы для изготовления отливок.
Их плюсами являются такие качества, как устойчивость к образованию коррозии и отличные антифрикционные свойства. Это объясняет использование данных сплавов в химической промышленности. В частности, их применяют для изготовления литой арматуры. Не менее популярны оловянные бронзы и в других промышленных отраслях.
Легирующими компонентами в данных сплавах выступают такие элементы, как:
- Цинк;
- Никель;
- Фосфор;
- Свинец;
- Мышьяк.
И другие металлы. Содержание цинка в бронзах не превышает 10%. Такое незначительное содержание данного компонента никак не влияет на качества этих сплавов. При этом его использование помогает снизить расходы на изготовление оловянных бронз и повышает их устойчивость к коррозии. Добавление в качестве легирующих компонентов свинца и фосфора положительно сказывается на антифрикционные свойства данных сплавов. К тому же так оловянные бронзы легче поддаются резке и давлению.
Их маркировка представлена следующим образом:
- Бр ОФ 6,5-0,15;
- Бр.ОЦ 4-3;
- Бр.ОЦ10-2;
- Бр.ОФ 10-1;
- Бр.ОНС 11-4-3.
Сегодня эти сплавы широко применяются в транспортной промышленности.
Устойчивость оловянных бронз к ржавчине и механическим повреждениям позволяет использовать их в производстве деталей машин. Производимые элементы относятся к расходным материалам, поскольку необходима их регулярная замена.
Бронза отличается долговечностью. Она устойчива к атмосферным осадкам и механическим воздействиям. Изделия, выполняющие декоративную функцию в театрах и дворцах, также производятся из бронз.
Рисунок 3. Изделия из бронзы для нефтегазового оборудования
Пьютер
Пьютером называется сплав олова с такими элементами периодической системы, как медь, сурьма и висмут. Иногда олово смешивают со свинцом. Сплав маркируется символами JJ. Пьютер плавится уже при 170-230 градусах. Следует отметить внешнюю эстетичность данных сплавов. Их легко полировать. Пьютеры необходимы при изготовлении декоративной посуды. Также сплавы используются в производстве различных украшений. Одним из существенных минусов изделий, изготавливаемых с применением пьютеров, является их низкая устойчивость перед так называемой оловянной чумой. Еще один не менее значимый недостаток данных сплавов – их токсичность. В некоторых странах (к примеру, в Англии) их запретили к использованию. Однако пьютер все же содержится в изделиях, относящихся к антиквариату.
Припои
Припои – это тоже лигатуры/сплавы.Они бывают легкоплавкими и твердыми. К первой группе относятся оловянно-свинцовые сплавы. В них также включают и другие элементы. Однако, как правило, их содержание в припоях бывает незначительно. Легирующие элементы обычно добавляют в данные сплавы для улучшения показателей тех или иных свойств (антикоррозийной защите, прочности и т.д.).
Легкоплавкие припои используются для монтажа и сборки радиоаппаратуры и различной электроники. Хотя они не такие прочные, как твердые сплавы, однако для данных целей они наиболее приемлемы. Их температура плавления составляет 300-450 градусов Цельсия (иногда меньше).
На сегодняшний день более популярной и востребованной считается припой марки ПОС. В маркировочных таблицах можно заметить несколько ПОС с различными номерами, следующими за данной аббревиатурой. Эти цифры являются показателями объема олова в них. К примеру, в припоях марки ПОС-40 количество олова составляет 40% от общего объема. Кстати, те сплавы, в которых содержится много олова, отличаются ярким металлическим блеском. Особенно значительно содержание данного элемента в марках ПОС-61 и ПОС–90. Те же сплавы, в составе которых преобладает свинец (а не олово), имеют матовую поверхность темно-серого цвета. Еще одна их отличительная особенность – хорошая пластичность. Те припои, в которых больше олова, жестки и прочны. Их невозможно легко и быстро погнуть.
Оловянно-свинцовые припои находят применение в самых разных отраслях промышленности. Так,
- ПОС-90 используют при восстановлении пищевой посуды и медицинских приборов и устройств. Низкое содержание известного своей токсичностью свинца (10%) позволяет применять данные сплавы для вышеназванных целей;
- ПОС-40 используется в процессе запаивания электроприборов и различных деталей из оцинкованного железа. Он подходит для ремонта радиаторов отопления и труб из латуни и меди;
- ПОС-30. Часто используется в производстве кабелей и обработки листового цинка. Его полное плавление происходит при температуре в 220-265 градусов Цельсия;
- ПОС-61. Аналогичен с ПОС-60. Практически один и тот же сплав. Применяется для запаивания печатных плат радиоприборов. Довольно часто используется при сборке электронного оборудования. Он начинает плавиться при 183 градусах Цельсия и выше. При 190 градусах припой расплавляется полностью.
Сплавы ПОС-40 и ПОС-90 также, как и ПОС-30, полностью расплавляются при 220-265 градусах Цельсия. Однако такую температуру «выдерживают» далеко не все электро- и радиоприборы. Поэтому оптимальным вариантом ля применения являются припои ПОС-61.
Поскольку припои выпускаются в тюбиках, то их состав можно прочитать на самих упаковках. Там бывает четко обозначено процентное соотношение олова и других элементов в данном сплаве.
Существует еще один сорт оловянных припоев. Речь идет о марке ПОССу. Этот сплав содержит в себе олово, свинец и сурьму. Его используют в производстве автотранспорта и холодильников, а также в целях запаивания обмоток машин электрического типа, электроники и кабелей. Содержание сурьмы в таких припоях варьируется от 0,5 % до 2%. ПОССу плавится при 189 градусах Цельсия.
И, пожалуй, наиболее «оловянным» можно назвать припой марки ПОССу 95-5. Олова и свинца в данном сплаве соответственно 95 к 5 процентам. Он плавится при 234-240 градусах.
Существуют также низкотемпературные припои. Это те сплавы, которые вследствие своей низкой температуры плавления можно без опасений использовать при запайке чувствительных к высоким температурам деталей приборов. Один из таких припоев – ПОСК-50-18. Он расплавляется при 142-145 градусах Цельсия. В данном сплаве олово составляет половину от всего содержимого припоя. В ПОСК–50-18 также бывает добавлен кадмий, который увеличивает его антикоррозийную устойчивость. Однако этот же легирующий компонент повышает токсичность данного сплава.
Таким образом, олово способно сочетаться в сплавах с другими металлами. Полученные металлопродукты отличаются высокой устойчивостью к появлению коррозии и внешней эстетичностью (яркий металлический блеск). В те или иные оловянные сплавы нередко добавляют легирующие компоненты для улучшения их свойств. Благодаря большому разнообразию соединений такого рода олово нашло применение в ряде отраслей промышленности.
Температура плавления свинца в домашних условиях
Расплавить свинец нетрудно. Это можно сделать даже в домашних условиях, используя подходящую тонкостенную стальную или даже алюминиевую емкость. Температура плавления свинца невысокая. Чтобы ее достичь, достаточно пламени конфорки бытовой газовой или электрической плиты.
Свинец: характеристика
Распространение в общей массе земной коры – 0,0016 %. Это вроде бы и мало, но если сравнивать данный показатель с ближайшими соседями по таблице химических элементов – ртутью, золотом, висмутом, то свинец занимает гораздо более высокое место. Основной источник сырья для его получения – это полиметаллические сульфидные руды.
Материал имеет характерный грязно-серый цвет. На срезе свинец блестит с синеватым отливом, однако вскоре тускнеет. Это происходит окисление при воздействии воздуха. На поверхности среза образуется тонкий слой оксида. Металл тяжелый, его плотность – 11,34 г/см³. Это в полтора раза больше, чем у железа, и вчетверо в сравнении с алюминием.
Кроме того, что температура плавления свинца невысока, он еще является одним из самых мягких металлов. Его можно поцарапать ногтем, порезать ножом. Он достаточно гибкий, плющится молотком. Материал хорошо подходит для плавления и литья даже в домашних условиях.
Технологические свойства: какая температура плавления свинца?
Он плавится при 327,46 °C (600,61 K). Сохраняет высокие технологические литьевые свойства в диапазоне от 400 до 450 °С. Температура кипения свинца равна 1751 °С (2022 K). Пленка оксида, необходимая для защиты от коррозии, плавится только при 850 °С. Такая высокая температура, существенно превышающая режим плавления, усложняет процесс сваривания свинца в сплавах с другими металлами. К тому же при 700 °C летучесть свинца заметно возрастает.
В холодном виде материал хорошо поддается обработке. Его можно прокатать в тонкую фольгу. При давлении от 2 т/см² дробленый свинец спрессовывается с образованием монолитной массы. Проволоку из него получают не методом литья, а при продавливании твердого материала через фильеру. Малая разрывная прочность не дает возможности использовать для этих целей обычное волочение.
При какой температуре плавится свинец в составе с другими металлами? Это будет зависеть от состава сплава и соотношения металлов в нем. С одним материалом температура может повыситься, в то же время с другими – быть значительно ниже. К примеру, припой, в основе которого олово (64 %) и свинец (36 %), плавится при 180-200 °С.
Плавление в домашних условиях: подготовка
Необходимо подобрать подходящую емкость, желательно, чтобы ее ручка была из жаростойкого материала. Хорошо для этих целей подойдет старый чайник, кофейник или другая вышедшая из употребления кухонная утварь с удобной рукоятью. Можно расплавить материал и в старой чугунной посуде, а для заливки использовать глубокую ложку с длинной ручкой.
В крайнем случае подойдет и жестяная консервная банка. Но тут не обойтись без плоскогубцев. Ими можно снять с огня разогретую посуду и залить расплавленный свинец в подготовленную форму. Но это следует делать очень осторожно. Для удобства на ободке жестянки лучше сделать желобок. Тогда расплавленный металл выльется тонкой струйкой без подтеков и точно в нужное место. Место для захвата плоскогубцами также следует заранее оборудовать, чтобы не производить лишних манипуляций с посудой и разогретым металлом.
Подготовленный и максимально очищенный от посторонних примесей свинец по возможности измельчают на мелкие кусочки. Так он быстрее будет плавиться. Емкость надежно устанавливается над горелкой и прогревается. Это делается для выгорания с ее поверхности влаги и нежелательных посторонних примесей.
Процесс плавления и заливка
Не стоит загружать в посуду сразу весь объем подготовленного материала. Контактировать с разогретой поверхностью будет только нижний слой свинцового лома, а все, что сверху, будет только забирать на себя тепло и этим замедлять прогрев. Лучше сначала расплавить несколько кусочков, чтобы образовалась лужа, а затем в нее постепенно добавлять новые порции металла. В таком случае увеличивается площадь разогревающей поверхности.
После расплавления всего объема материала металлической лопаткой или ложкой с длинной ручкой с поверхности расплава необходимо снять слой шлака, примесей и мусора. Заливку следует производить в разогретую форму. Сравнительно низкая температура плавления свинца предполагает его быстрое застывание. Особенно заметно это в холодной форме. Материал теряет текучесть, заметно густеет, расплав не заполняет форму, качество отливки ухудшается.
Техника безопасности
Температура кипения свинца очень высока (1751 °C), и достичь ее в домашних условиях нереально. Тем не менее летучесть его уже при 700 °C становится довольно высокой. При существенном превышении температуры плавления находящиеся поблизости люди могут подвергаться негативному воздействию его испарений. Если нет существенной технологической необходимости перегревать расплав, не следует его доводить до красноватого оттенка. Именно это свидетельствует о том, что температура плавления свинца была превышена.
Расплавленный свинец при попадании на кожу может вызвать серьезные ожоги. Его капли прожигают одежду, при попадании на быстровоспламеняющиеся материалы могут вызвать возгорание и, как следствие, пожар, поэтому работать следует осторожно. Недопустимо попадание воды в расплавленный свинец. Это вызывает фонтан серебристых брызг, которые при попадании в глаза могут вызвать крайне нежелательные последствия.
Работать следует в хорошо проветриваемом помещении или на улице. Не стоит пренебрегать средствами индивидуальной защиты. Респиратор или даже ватно-марлевая повязка защитят дыхательные пути от свинцовой пыли. Малые дозы свинца в организме, возможно, сразу и не вызовут последствий. Однако этот материал имеет склонность накапливаться на протяжении жизни и вызывать отравление при превышении допустимых доз.
- Как расплавить свинец
- Сплавы металлов из алюминия и свинца
- Как расплавить медь в домашних условиях
- Керамический тигель, либо стальная посуда с жаростойкой ручкой. Стальные щипцы или лопатка.
Несмотря на то, что свинец легко плавится, форму он заполняет хуже, чем другие легкоплавкие металлы.
В холодную форму разливать свинец нельзя, так как он может при соприкосновении с холодной поверхностью дать брызги.
- температура плавления свинца в 2018
Что для этого нужно?
Приготовьте также пачку бумажных салфеток, а для работы с кислотой – химическую посуду, перчатки и респиратор.
Домашние и промышленные способы
Есть в буквальном смысле домашний способ защитить свинцовую поверхность от коррозии. Подсолнечное масло в хозяйстве всегда найдется. Налейте его в миску и погрузите туда недавно выплавленную фигурку. Подержите минут пять, достаньте, положите на слой салфеток и дайте высохнуть.
На производстве для защиты свинцовых деталей от окисления применяется обычно словом, там, где продают промышленное масло. Можно заказать графитовую смазку и через интернет-магазин. Свинцовое изделие долго сохранит блеск.
Если изделие большое, его можно просто протереть ватным тампоном, смоченном в растительном масле.
Рыболовные лаки
Можно покрыть свинцовую статуэтку и лаком по металлу. В магазине, где продают товары для рыболовов, часто встречается специальный «рыболовный» лак, предназначенный именно для таких целей. Цвета встречаются самые разные, но если вы хотите сохранить металлический блеск, вам больше подойдет бесцветный. Промышленность выпускает и флуоресцентные «рыболовные» лаки.
Избавиться от оксида
Области применения свинца
Одним из наиболее распространенных вариантов применения свинца является изготовление пуль, дроби и других снарядов для огнестрельного оружия. А возможность для охотников мастерить самодельные пули создана благодаря дешевизне металла и низкой температуре его плавления.
Также из свинца изготавливают рыболовные грузила. Благодаря тому, что металл достаточно мягкий, его можно зафиксировать на леске без использования специальных приспособлений, простым обжатием.
Свинец обладает также антикоррозионным свойством, поэтому его применяют для нанесения защитного слоя на изделия из железа и изготовления защитных оболочек для кабелей. Также эта особенность свинца позволяет использовать его при производстве лакокрасочных изделий.
В качестве основного компонента корабельного, или железного, сурика, которым окрашивают подводную часть корабля, используется пигмент, в состав которого входит свинец.
Часто этот цветной металл применяется в виде сплавов. Листы с примесью свинца, например, способны защищать от рентгеновских лучей и радиоактивного излучения. При аварии на Чернобыльской атомной электростанции, сопровождавшейся интенсивным излучением, использовали мешки с болванками и дробью свинца, чтобы остановить опасные процессы в реакторе. Для защиты людей, которые находились на подающих этот груз вертолетах, применялись свинцовые листы. Уникальные особенности этого металла в таком случае оказались незаменимыми.
Температура плавления свинца
Температура плавления чистого свинца, в котором не имеется примесей, составляет 328оС. При плавлении улучшаются литейные качества и без того пластичного свинца. Это позволяет охотникам в домашних условиях отливать снаряды для оружия.
Свинец можно расплавить даже в домашних условиях или на костре.
Однако для заливки в формы необходимо довести металл до жидкотекучего состояния. До такой степени можно расплавить свинец при температуре примерно на 100-200оС выше температуры плавления. Температура кипения этого металла варьируется в пределах 1749оС.
В расплавленном виде он имеет заметную летучесть, которая повышается вместе с ростом температуры. Пары свинца, а также его пыль могут вызвать у человека острое отравление. Для тяжелой интоксикации достаточна концентрация в организме 0,3 г свинца или же его компонентов.
Свинец – серебристо-серое вещество с синим отливом. В периодической системе элементов Менделеева металл занимает 82 место. Обозначают свинец сокращённым знаком Pb (лат. Plumbum).
Исторические сведения
Химический элемент известен людям с древних времён. Одним из первых методов добычи металлов, освоенных человеком, была выплавка свинца. Первыми археологическими находками, подтверждающими это, были найденные свинцовые бусы времён Чатал-Хююк (современная территория Турции). Изделия датируются 6400 годом до нашей эры.
Самая древняя свинцовая фигурка девушки в длинной одежде была выкопана в Египте. Её относят к временам первой династии фараонов (3000 лет до н.э.).
Трубы из свинца составляли древнеримский водопровод. В Древнеримской империи ежегодно выплавляли до 80 тысяч тонн этого металла. На Руси с древних времён свинец использовали как кровельное покрытие соборов и церквей.
Невысокая температура плавления свинца с незапамятных времён сделала доступным получение металла и изготовление из него изделий любой формы.
Обратите внимание! Индустриальная революция с 1840 года в течение 20 лет подняла объём ежегодной выплавки свинца в мире со 100 до 250 тысяч тонн в год.
Происхождение названия
Латинское название металла Plumbum произошло от английского выражения plumber (водопроводчик), что показывает связь со свинцовым водопроводом Древнего Рима. Среди славянских народов бытуют такие названия, как оливо, олёво и волава. В Прибалтийских странах наименование металла более похоже на русское название – свинс и свинас.
Нахождение в природе
В чистом виде плюмбум обычно не обнаруживается. Его находят в более чем 100 разных минералах в виде интерметаллических агломератов. Свинец присутствует в урановых и ториевых жилах. Большие скопления свинцово-цинковых руд обнаружены и разрабатываются в Забайкалье, Приморском районе. В разных залежах свинец добывают на Урале, в Норильске.
Самое крупное месторождение с большим содержанием свинца находится в урановых рудах Кохистанской Ладахской дуги (северный Пакистан).
Получение
Сырьём для извлечения свинца служат породы, включающие геленит. Процесс выплавки тяжёлого металла состоит из нескольких фаз. Из первоначального сырья способом флотации выделяют концентрат с содержанием от 40 до 70 процентов плюмбума. Далее производители идут разными путями.
Одним из способов превращения продукта в веркблей (черновой свинец) является плавка методом регенерации. Другой способ заключается в том, что восстановление металла из оксида происходит плавкой сырья в ватержакетном калорифере.
Полученный веркблей с содержанием 90% свинца очищают от меди. Затем щелочным рафинированием убирают мышьяк и сурьму. Потом выделяют серебро и цинк. Воздействием магния и кальция исключают висмут. В итоге получают свинец чистотой 99,8%.
Производство мирового объёма свинца по итогам исследования международных организаций за 2005 год
| Страна производитель | Объём, килотонн |
|---|---|
| Страны Европы | 2220 |
| КНР | 1430 |
| Российская федерация | 1120 |
| Ю. Корея | 650 |
| Казахстан | 570 |
| Украина | 410 |
Технологические свойства и характеристики
Характеристики металла можно представить перечнем:
- Плотность свинца и его масса;
- Температура плавки свинца;
- Механические свойства;
- Сопротивление коррозии.
Плотность свинца и его масса
Плотность металла составляет 11342 кг/м3. Это значит, что метрический куб свинца весит 11,342 тн. Большой удельный вес позволяет его использовать в виде полезных грузов в различных устройствах.
Температура плавки свинца
Расплавленный металл в чистом виде имеет температуру около 400 градусов. В этом состоянии свинец обладает свойствами текучести жидкости. Литейные качества позволяют заливать свинец в жидком состоянии в формы сложной конфигурации.
Металл закипает при нагреве до 1750 градусов. Во время кипения возникают летучие испарения в виде свинцовой пыли, паров оксидов, которые могут нанести тяжёлое отравление человеческому организму.
Механические свойства
Химический элемент обладает мягкостью и пластичностью, что позволяет холодной прокаткой достичь состояния тонкой фольги. Холодная деформация не влияет на изменение механических свойств.
Сопротивление коррозии
Химическая инертность элемента приближена к показателю благородных металлов. В воздушной среде плюмбум практически не подвергается коррозии. Быстро образующаяся оксидная плёнка на поверхности свинца ставит непреодолимый барьер на пути коррозионных процессов.
Агрессивной средой для свинца являются сероводород, ангидрит угля и серная кислота. Под их воздействием металл активно разрушается.
Области применения свинцовых сплавов
Свинцовые соединения разделяют на высоколегированные и низколегированные сплавы. Первые формируются за счёт добавления большого количества химических элементов, обеспечивающих высокую прочность, стойкость к истиранию и низкую усадку при более низкой температуре плавления.
Низколегированные соединения свинца получаются в результате небольших включений из таких веществ, как олово, сурьма, медь и кадмий. Этим добиваются повышенной стойкости сплава к коррозионным процессам в условиях загрязнённой атмосферы, неорганической кислотной среды.
Сплавы применяют в кислотных и щелочных аккумуляторах, в качестве оболочек как мощных, так и кабелей низкого напряжения. Соединения сурьмы или меди со свинцом используют для производства трубопроводов, листовой облицовки различных устройств и защитных матов от радиационного поражения.
Домашние и промышленные способы
Без оловянно-свинцовых припоев (ПОС) невозможно существование такой отрасли, как радиотехника. Многие промышленные изделия имеют в своём составе покрытия из ПОС.
Оловянно-свинцовые припои
Промышленность поставляет на рынок припойный продукт:
- литые чушки;
- проволока;
- фольгированная лента;
- припойные трубочки с флюсом;
- порошок или паста.
Сплавы с содержанием 90% олова и 10% свинца применяют для пайки изделий, которые потом подвергаются гальваническому покрытию из золота или серебра. Температура плавления чистого олова – 2310 С. Поэтому припой расплавится при нагреве 2200 С.
Оловянно-свинцовый ПОС с преобладанием в своём составе олова (61%) имеет более низкую температуру плавления – 191%. ПОС 61 используют для покрытия контактных групп в различных приборах, также им обрабатывают тонкую проволоку для обмоток якорей электродвигателей и катушек трансформаторов.
Важно! Учитывая, при какой температуре плавится олово, регулируют % содержание свинца в сплаве. Этим добиваются комфортного температурного режима, при котором оловянно-свинцовый припой быстро переходит в жидкое состояние.
ПОС 30 плавится при 256 градусах. Соединения обладают меньшей прочностью, чем средства с более высоким содержанием олова.
10 процентный припой далёк от температурного порога, при котором происходит плавление олова. Поэтому ПОС 10 применяют как прочный материал для лужения больших металлических поверхностей.
Приготовление расплава и заливка
В промышленных условиях расплав готовят в специальных тиглях, которые помещают в электропечи (оборудование, оснащённое электронной измерительной аппаратурой, поддерживающее нужный режим плавки).
В радиотехническом производстве используют специальные нагревательные ванны, в которых готовят припой для печатных плат радиосхем.
В мастерских и дома припой плавят жалом паяльника. Для приготовления большого объёма расплавленного металла его помещают в медный сосуд на электроплите. Сплав в виде лома загружают в плавильную ванну постепенно, по мере расплавления очередного слоя металла.
Рыболовные лаки
Заядлые рыбаки дома отливают рыболовные грузила и блесны, вливая в глиняные формы расплавленное олово. Блесны затем покрывают водостойкими лаками.
Интересно. Рыболовный лак используют для защиты от появления оксидов на различных статуэтках и других изделиях.
Методы избавления от оксида
Во время нахождения на воздухе свинцовые изделия покрываются оксидной плёнкой. Это результат ионного взаимодействия атомов кислорода и свинца. Оксид становится не только защитой от агрессивной среды, но и барьером на пути электрического тока.
Важно! Механическая чистка не принесёт желаемого результата. Плёнка восстановится довольно быстро. Избавиться от оксидов могут помочь подсолнечное масло, графитовая смазка или лак.
В домашних условиях изделие помещают в сосуд с подсолнечным маслом минут на пять. После чего его извлекают из сосуда и дают просохнуть.
В промышленных условиях пользуются графитовой смазкой. Обработанная средством свинцовая поверхность долгое время сохраняет блестящий вид.
Техника безопасности
При работе с расплавленным металлом надо соблюдать особую осторожность. Помимо того, что жидкий свинец может нанести ожоги на кожу, он прожжёт также одежду и напольное покрытие, а также вызовет пожар.
Если вода попадёт в кипящий сплав, брызги металла разлетятся во все стороны. Поэтому работник должен быть экипирован защитной одеждой, маской, перчатками, специальными очками и головным убором. Обязательно рядом должны находиться аптечка и огнетушитель.
Видео
Свинец — Точка плавления — Точка кипения
Свинец — Точка плавления и точка кипения
Точка плавления свинца 327,5 ° C .
Точка кипения свинца 1740 ° C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Точка кипения — насыщение
В термодинамике термин насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданной температуре и давлении.Температура, при которой начинает происходить испарение (кипение) для данного давления, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) для данной температуры, называется давлением насыщения. Если рассматривать температуру обратного перехода от пара к жидкости, ее называют точкой конденсации.
Точка плавления — насыщение
В термодинамике точка плавления определяет состояние, при котором твердое вещество и жидкость могут находиться в равновесии.Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда рассматривается как температура обратного перехода от жидкости к твердому телу, она упоминается как точка замерзания или точка кристаллизации.
Свинец — Свойства
| Элемент | Свинец |
|---|---|
| Атомный номер | 82 |
| Символ | Pb |
| Категория элемента | Плохой металл |
| Твердое тело | |
| Атомная масса [а.е.м.] | 207.2 |
| Плотность при STP [г / см3] | 11,34 |
| Конфигурация электронов | [Hg] 6p2 |
| Возможные состояния окисления | +2,4 |
| Сродство к электрону [кДж / моль] | 35,1 |
| Электроотрицательность [шкала Полинга] | 2,33 |
| Энергия первой ионизации [эВ] | 7,4167 |
| Год открытия | неизвестно |
| Discoverer | неизвестно |
| Тепловые свойства | |
| Точка плавления [шкала Цельсия] | 327.5 |
| Точка кипения [шкала Цельсия] | 1740 |
| Теплопроводность [Вт / м · К] | 35 |
| Удельная теплоемкость [Дж / г · К] | 0,13 |
| Теплота Плавление [кДж / моль] | 4,799 |
| Теплота испарения [кДж / моль] | 177,7 |
—
—
—
Какова температура плавления нержавеющей стали?
Стальизвестна своей невероятной стойкостью к различным стрессовым факторам.Ударопрочность, прочность на разрыв и жаропрочность стали намного превосходят пластические полимеры. Сплавы нержавеющей стали представляют собой дальнейшее усовершенствование, которое обеспечивает повышенную стойкость к различным едким и коррозионным химическим веществам.
Однако насколько прочна нержавеющая сталь в сочетании с другими металлами? Как температура плавления нержавеющей стали сравнивается с температурами плавления других металлов? Это частый вопрос от компаний, которые хотят заказать корзину или лоток из нержавеющей стали для высокоинтенсивных работ.
В частности, многие компании, занимающиеся термообработкой, отжигом или стерилизацией, задаются вопросом: «Какова температура плавления нержавеющей стали?» потому что они должны использовать сталь для высокотемпературных процессов.
Сколько тепла
может выдержать нержавеющая сталь перед плавлением?Это правильный вопрос, но на него трудно ответить, не спросив сначала: «О каком сплаве нержавеющей стали мы говорим?»
Существует бесчисленное множество различных составов нержавеющей стали, от аустенитных нержавеющих сталей (таких как 304, 316 и 317) до ферритных нержавеющих сталей (таких как 430 и 434), а также мартенситных нержавеющих сталей (410 и 420).Кроме того, многие нержавеющие стали имеют варианты с низким содержанием углерода. Проблема с попыткой сделать общее заявление о температуре плавления нержавеющей стали состоит в том, что все эти сплавы имеют разные температурные допуски и точки плавления.
Вот список различных сплавов нержавеющей стали и температур, при которых они плавятся (данные основаны на цифрах из BSSA):
- Марка 304. 1400-1450 ° C (2552-2642 ° F)
- Марка 316. 1375-1400 ° C (2507-2552 ° F)
- Оценка 430.1425-1510 ° С (2597-2750 ° F)
- Класс 434. 1426-1510 ° C (2600-2750 ° F)
- Марка 420. 1450-1510 ° C (2642-2750 ° F)
- Марка 410. 1480-1530 ° C (2696-2786 ° F)
Вы могли заметить, что каждая из этих точек плавления выражается в виде диапазона, а не абсолютного числа
.Это связано с тем, что даже в конкретном сплаве нержавеющей стали все еще существует возможность небольших изменений в составе, которые могут повлиять на температуру плавления. Это лишь некоторые из наиболее распространенных сплавов нержавеющей стали на рынке.Существует еще много разновидностей нержавеющей стали, которые можно использовать в самых разных областях, — слишком много, чтобы охватить их все здесь.
Хотя это температуры плавления этих сплавов нержавеющей стали, рекомендуемые максимальные температуры использования этих сплавов, как правило, намного ниже.
Узнайте больше о характеристиках стали и других сплавов при высоких температурах здесь!
Температура плавления других металлов
Важно знать свойства других металлов и их сравнение со средней температурой плавления нержавеющей стали.Ниже приведена диаграмма, отображающая температуры плавления популярных промышленных сплавов и металлов.
Металл | Температура плавления по Цельсию (℃) | Температура плавления по Фаренгейту (℉) |
Адмиралтейство Латунь | 900–940 | 1650–1720 |
Алюминий | 660 | 1220 |
Алюминиевый сплав | 463–671 | 865–1240 |
Алюминиевая бронза | 600–655 | 1190–1215 |
Бэббит | 249 | 480 |
Бериллий | 1285 | 2345 |
Бериллиевая медь | 865–955 | 1587–1750 |
висмут | 271.4 | 520,5 |
Латунь, красный | 1000 | 1832 |
Латунь, желтый | 930 | 1710 |
Кадмий | 321 | 610 |
Хром | 1860 | 3380 |
Кобальт | 1495 | 2723 |
Медь | 1084 | 1983 |
Золото, 24k Pure | 1063 | 1945 |
Хастеллой C | 1320–1350 | 2410–2460 |
Инконель | 1390–1425 | 2540–2600 |
Инколой | 1390–1425 | 2540–2600 |
Кованое железо | 1482–1593 | 2700–2900 |
Чугун, серое литье | 1127–1204 | 2060–2200 |
Чугун, высокопрочный | 1149 | 2100 |
Свинец | 327.5 | 621 |
Магний | 650 | 1200 |
Магниевый сплав | 349–649 | 660–1200 |
Марганец | 1244 | 2271 |
Марганцевая бронза | 865–890 | 1590–1630 |
Меркурий | -38.86 | -37,95 |
молибден | 2620 | 4750 |
Монель | 1300–1350 | 2370–2460 |
Никель | 1453 | 2647 |
Ниобий (Колумбий) | 2470 | 4473 |
Палладий | 1555 | 2831 |
фосфор | 44 | 111 |
Платина | 1770 | 3220 |
Красная латунь | 990–1025 | 1810–1880 |
Рений | 3186 | 5767 |
Родий | 1965 | 3569 |
Селен | 217 | 423 |
Кремний | 1411 | 2572 |
Серебро, чистое | 961 | 1761 |
Серебро, Стерлинговое | 893 | 1640 |
Углеродистая сталь | 1425–1540 | 2600–2800 |
Нержавеющая сталь | 1510 | 2750 |
Тантал | 2980 | 5400 |
Торий | 1750 | 3180 |
Олово | 232 | 449.4 |
Титан | 1670 | 3040 |
вольфрам | 3400 | 6150 |
Желтая латунь | 905–932 | 1660–1710 |
цинк | 419,5 | 787 |
Почему точки плавления металлов не должны быть вашей единственной проблемой температуры
При чрезвычайно высоких температурах многие материалы начинают терять прочность на разрыв.Сталь не исключение. Даже до того, как будет достигнута точка плавления нержавеющей стали, сам металл становится менее жестким и более подверженным изгибу при нагревании.
Например, допустим, сплав нержавеющей стали сохраняет 100% своей структурной целостности при 870 ° C (1679 ° F), но при 1000 ° C (1832 ° F) он теряет 50% своей прочности на разрыв. Если бы максимальная нагрузка корзины, изготовленной из этого сплава, составляла 100 фунтов, тогда корзина могла бы выдержать только 50 фунтов веса после воздействия более высокой температуры.Еще больше веса, и корзина может потерять форму под нагрузкой.
Кроме того, воздействие высоких температур может иметь другие эффекты, кроме того, что нержавеющая сталь легче сгибается или ломается. Высокие температуры могут повлиять на защитный оксидный слой, который предохраняет нержавеющую сталь от ржавчины, делая ее более восприимчивой к коррозии в будущем.
В некоторых случаях экстремальные температуры могут вызвать образование накипи на поверхности металла. Это может повлиять на производительность корзины для обработки деталей или другой нестандартной формы проволоки.Или высокие температуры могут привести к тепловому расширению металла в проволочной корзине, изготовленной по индивидуальному заказу, что приведет к расшатыванию сварных соединений.
Таким образом, даже если в вашем конкретном процессе не достигается точная температура плавления нержавеющей стали, высокие температуры все равно могут нанести ущерб другим способом.
Также важно сравнить точки плавления стальных сплавов с температурами плавления других металлов, чтобы увидеть, что лучше всего соответствует вашим потребностям. Есть много факторов, которые влияют на создание качественной корзины, и решение, какой металл использовать, является важным вопросом, который зависит от задачи корзины и окружающей среды.
Вот почему команда инженеров Marlin Steel проводит анализ методом конечных элементов для каждой конструкции корзины. Проверяя влияние высоких температур на конструкцию, команда инженеров может выявить потенциальные проблемы, такие как масштабирование, и протестировать альтернативные материалы, которые могут предотвратить такие проблемы, которые сделают конструкцию недействительной.
Получите больше информации о свойствах нержавеющей стали, загрузив лист свойств нержавеющей стали сегодня!
Фазовые диаграммы жидкость-твердое тело: олово и свинец
На этой странице объясняется взаимосвязь между кривыми охлаждения жидких смесей олова и свинца и полученной фазовой диаграммой.Он также предлагает простое введение в идею эвтектической смеси.
Кривые охлаждения для чистых веществ
Предположим, у вас есть немного чистого расплавленного свинца, и вы даете ему остыть, пока он полностью не затвердеет, по ходу построения график зависимости температуры свинца от времени. Вы получите типичную кривую охлаждения для чистого вещества.
На протяжении всего эксперимента тепло теряется в окружающую среду, но температура не падает вообще, пока свинец замерзает.Это связано с тем, что в процессе замораживания выделяется тепло с той же скоростью, с какой оно теряется в окружающую среду. Энергия высвобождается при образовании новых связей — в данном случае сильных металлических связей в твердом свинце. Если вы повторите этот процесс для чистого жидкого олова, форма графика будет точно такой же, за исключением того, что точка замерзания теперь будет при 232 ° C (график для этого находится ниже на странице).
Кривые охлаждения оловянно-свинцовых смесей
Если добавить в свинец олово, форма кривой охлаждения изменится.На следующем графике показано, что произойдет, если вы охладите жидкую смесь, содержащую около 67% свинца и 33% олова по массе.
Есть на что посмотреть:
- Обратите внимание, что при нормальной температуре замерзания свинца ничего не происходит. Добавление в него олова снижает температуру замерзания.
- Замораживание этой смеси начинается при температуре около 250 ° C. Вы бы начали получать твердый свинец, но не олово. В этот момент скорость охлаждения замедляется — кривая становится менее крутой.
- Однако график еще не идет горизонтально. Хотя при превращении свинца в твердое тело выделяется энергия, с оловом ничего подобного не происходит. Это означает, что выделяется недостаточно энергии для поддержания постоянной температуры.
- Температура перестает падать при 183 ° C. Сейчас мерзнут и олово, и свинец. Как только все застынет, температура продолжает падать.
Изменение пропорций олова и свинца
Если в смеси было меньше олова, общая форма кривой остается почти такой же, но точка, в которой свинец сначала начинает замерзать, изменяется.Чем меньше олова, тем меньше падение температуры замерзания свинца. Для смеси, содержащей всего 20% олова, температура замерзания свинца составляет около 275 ° C. Вот где график внезапно стал бы менее крутым. НО . . . график будет горизонтальным (показывающий замерзание олова и свинца) при точно такой же температуре: 183 ° C.
По мере увеличения доли олова первые признаки твердого свинца появляются при все более низких температурах, но окончательное замерзание всей смеси все же происходит при 183 ° C.Это продолжается до тех пор, пока вы не добавите достаточно олова, чтобы смесь содержала 62% олова и 38% свинца. В этот момент график изменится.
Эта конкретная смесь свинца и олова имеет кривую охлаждения, которая больше похожа на кривую чистого вещества, чем на смесь. Есть только одна горизонтальная часть графика, где все замирает. Однако это все еще смесь (не раствор). Если вы посмотрите в микроскоп на твердое вещество, образовавшееся после замораживания, вы увидите отдельные кристаллы олова и свинца.
Эта конкретная смесь известна как эвтектическая смесь . Слово «эвтектика» происходит от греческого и означает «легко плавится». Эвтектическая смесь имеет самую низкую температуру плавления (которая, конечно, такая же, как температура замерзания) из всех смесей свинца и олова. Температура, при которой эвтектическая смесь замерзает или плавится, известна как температура эвтектики.
Что произойдет, если в смеси будет более 62% олова?
Вы можете проследить это точно таким же образом, представив, что вы начинаете с чистого олова, а затем добавляете к нему свинец.Кривая охлаждения чистого жидкого олова выглядит так:
Это похоже на кривую охлаждения чистого свинца, за исключением того, что температура замерзания олова ниже. Если вы добавите небольшое количество свинца в олово, так что у вас будет примерно 80% олова и 20% свинца, вы получите такую кривую:
Обратите внимание на пониженную температуру замерзания банки. Обратите внимание, что окончательное замораживание всей смеси снова происходит при 183 ° C. По мере увеличения количества свинца (или уменьшения количества олова — то же самое!) До 62% олова и 38% свинца вы снова получите эвтектическую смесь с кривой, которую мы уже рассмотрели.
Фазовая диаграмма
Построение фазовой диаграммы
Вы начинаете с данных, полученных из кривых охлаждения. Вы строите график температуры, при которой начинается первое замерзание, в зависимости от соотношения олова и свинца в смеси. Единственное, что необычно, это то, что вы рисуете шкалу температур на каждом конце диаграммы, а не только с левой стороны.
Обратите внимание, что в левой и правой частях кривых указаны точки замерзания (точки плавления) чистого свинца и олова.
Чтобы завершить фазовую диаграмму, все, что вам нужно сделать, это провести одну горизонтальную линию поперек при эвтектической температуре. Затем вы помечаете каждую область диаграммы тем, что вы найдете в различных условиях.
Использование фазовой диаграммы
Предположим, у вас есть смесь 67% свинца и 33% олова. Это смесь из первой кривой охлаждения, построенной выше. Предположим, он находится при температуре 300 ° C. Это соответствует набору условий в области фазовой диаграммы, обозначенной как расплавленное олово и свинец.
А теперь подумайте, что произойдет, если вы охладите эту смесь. В конце концов температура упадет до точки, где она пересекает линию в следующую область диаграммы. В этот момент смесь начнет выделять твердый свинец — другими словами, свинец (но не олово) начнет замерзать. Это происходит при температуре около 250 ° C.
Теперь нужно тщательно обдумать следующий фрагмент, потому что есть два разных способа взглянуть на него.Если вас научили делать это одним способом, придерживайтесь этого — иначе вы рискуете сильно запутаться!
Размышляя об изменении состава жидкости
При замерзании первого свинца состав оставшейся жидкости изменяется. Очевидно, он становится пропорционально богаче оловом. Это немного снижает точку замерзания свинца, и поэтому следующий кусок свинца замерзает при немного более низкой температуре, оставляя жидкость еще более богатой оловом.
Этот процесс продолжается.Жидкость становится все богаче и богаче оловом, а температура, необходимая для замораживания следующей партии свинца, продолжает падать. Набор условий температуры и состава жидкости по существу движется вниз по кривой — пока не достигнет точки эвтектики.
После достижения точки эвтектики, если температура продолжает падать, вы, очевидно, просто попадаете в область смеси твердого свинца и твердого олова — другими словами, вся оставшаяся жидкость замерзает.
Размышляя о составе системы в целом
Мы видели, что по мере того, как жидкость постепенно замерзает, ее состав меняется.Но если вы посмотрите на систему в целом, очевидно, что пропорции свинца и олова остаются неизменными — вы ничего не убираете и ничего не добавляете. Все, что происходит, — это то, что все меняется от жидкостей к твердым. Итак, предположим, что мы продолжаем охлаждение за пределами температуры, при которой появляется первый твердый свинец и температура падает до точки, показанной на следующей диаграмме — точки, четко расположенной в области «твердый свинец и расплавленная смесь».
Что бы вы увидели в смеси? Чтобы выяснить это, вы проводите горизонтальную соединительную линию через эту точку и затем смотрите на ее концы.
Слева — 100% преимущество. Это представляет собой твердый свинец, который замерз из смеси. В правом конце у вас есть состав жидкой смеси. Теперь он намного богаче оловом, чем вся система, потому что, очевидно, выделилось изрядное количество твердого свинца. По мере того, как температура продолжает падать, состав жидкой смеси (как показано на правом конце соединительной линии) будет приближаться к эвтектической смеси.
Он наконец достигнет эвтектического состава, когда температура упадет до температуры эвтектики — и тогда вся партия замерзнет. Очевидно, что при температуре ниже температуры эвтектики вы находитесь в области твердого свинца и твердого олова. Если вы охладите жидкую смесь в правой части фазовой диаграммы (справа от эвтектической смеси), все будет работать точно так же, за исключением того, что вместо твердого свинца образуется твердое олово. Если вы уже поняли, что произошло раньше, понять, что происходит, совсем не сложно.
Наконец. . . что произойдет, если вы охладите жидкую смесь, имеющую именно эвтектический состав? Он просто остается жидкой смесью, пока температура не упадет настолько, что все затвердеет. Вы никогда не попадете в неудобные участки фазовой диаграммы.
Смеси оловянно-свинцовые в качестве припоя
Традиционно в качестве припоя использовались смеси олова и свинца, но их использование постепенно прекращается из-за проблем со здоровьем, связанных со свинцом. Это особенно актуально, когда припой используется для соединения водопроводных труб, в которых вода используется для питья.Новые бессвинцовые припои были разработаны в качестве более безопасной замены.
Типичные старомодные припои включают:
- 60% олова и 40% свинца. Это близко к эвтектическому составу (62% олова и 38% свинца), что дает низкую температуру плавления. Он также будет плавиться и чисто замерзать в очень ограниченном диапазоне температур. Это полезно для электромонтажных работ.
- 50% олова и 50% свинца. Это будет плавиться и замерзать в более широком диапазоне температур. Когда он расплавится, он начнет замерзать при температуре около 220 ° C и, наконец, затвердеть при температуре эвтектики 183 ° C.Это означает, что он остается работоспособным в течение полезного количества времени. Это полезно, если он используется для сантехнических соединений.
Авторы и авторство
точек плавления и кипения
точек плавления и кипения Точки плавления и кипения элементов.Точки плавления и кипения даны в градусах Цельсия.
Чтобы преобразовать в Кельвин, добавьте 273.
Цифры в скобках являются оценочными.
Элемент | Точка плавления | Точка кипения |
Алюминий | 660 | 2450 |
Аргон | -189 | -186 |
Астатин | (300) | (400) |
Барий | 710 | 1640 |
Бериллий | 1280 | (2500) |
Бор | 2030 | 3930 |
Бром | -7 | 58 |
Кадмий | 321 | 765 |
Цезий | 29 | 685 |
Кальций | 850 | 1492 |
Углерод (графит) | 3730 (сублимированные) | |
Углерод (алмаз) | 3550 | (4830) |
Хлор | -101 | -34 |
Хром | 1905 | 2640 |
Кобальт | 1495 | 2880 |
Медь | 1085 | 2580 |
Фтор | -220 | -188 |
Франций | (30) | (700) |
Золото | 1065 | (2710) |
Гелий | -270 | -269 |
Водород | -259 | -253 |
Йод | 114 | 183 |
Утюг | 1540 | 2890 |
Криптон | -157 | -153 |
Свинец | 328 | 1750 |
Литий | 181 | 1330 |
Магний | 650 | 1120 |
Марганец | 1245 | 2040 |
Меркурий | -39 | 357 |
Молибден | (2620) | (4800) |
Неон | -248 | -246 |
Никель | 1455 | 2840 |
Азот | -210 | -196 |
Кислород | -218 | -183 |
Палладий | 1550 | (3100) |
Фосфор (красный) | 430 (сублимированные) | |
Фосфор (белый) | 44 | 281 |
Платина | 1770 | (3800) |
Калий | 63 | 766 |
Радий | 700 | (1500) |
Радон | (-70) | (-60) |
Рубидий | 39 | 701 |
Кремний | 1410 | (2370) |
Серебро | 961 | (2200) |
Натрий | 98 | 890 |
Стронций | 770 | 1365 |
Сера | 119 | 445 |
Олово (белое) | 232 | (2690) |
Олово (серая) | 19 (становится белым) | |
Титан | 1680 | 3300 |
Вольфрам | 3400 | (5500) |
Ванадий | 1920 | 3400 |
Ксенон | -112 | -108 |
Цинк | 420 | 980 |
Отслеживание точек плавления выше 4000 градусов Цельсия
Newswise. Инженер по материалам Калифорнийского университета в Сан-Диего возглавляет разработку новой исследовательской платформы для изучения высокоэффективных материалов, в частности новых материалов, температура плавления которых превышает 4000 градусов Цельсия (C).Профессор наноинженерии Калифорнийского университета в Сан-Диего Кеннет Веккио возглавляет проект, который финансируется новым грантом в размере 800 000 долларов США от Управления военно-морских исследований (ONR) в рамках Программы исследовательского оборудования оборонного университета (DURIP).
Исследовательская платформа будет построена специально для решения задач изучения новых материалов, плавящихся при температурах выше 4000 ° C, что составляет примерно 80 процентов от температуры поверхности Солнца.
Эта платформа станет национальным ресурсом для инженеров и других исследователей, которые раздвигают границы материаловедения.Есть много промышленных, энергетических, космических и оборонных приложений, которые выиграют от использования новых твердых материалов, которые надежно работают при рекордных сверхвысоких температурах. Применения включают защитные стенки для термоядерных реакторов, передние кромки воздушных транспортных средств, которые движутся в пять или более раз быстрее скорости звука, а также новые методы обработки промышленных материалов. (Наконечники режущих инструментов, например, могут выдерживать температуру выше 3000 ° C при высоких скоростях обработки. Новые материалы для режущих инструментов с гораздо более высокими температурами плавления позволят ускорить производство.)
Создание и определение характеристик материалов, которые не плавятся до воздействия сверхвысоких температур, представляет собой множество проблем. Помимо создания материалов-кандидатов, исследователи должны иметь возможность характеризовать эти материалы, чтобы продемонстрировать их эффективность. Одним из ключевых показателей является температура плавления материалов.
При работе при температуре около 4000С все не так просто. Например, как вы проверяете температуру плавления новых материалов, которые плавятся при температурах выше, чем любые емкости, в которых вы могли бы пытаться их удерживать? Как нагреть образец до температуры в диапазоне 4000 ° C, точно контролируя температуру? Или как точно определить, когда образец в таких экстремальных условиях действительно тает?
Это некоторые из проблем, которые Веккио и его команда планируют решить с помощью экспериментальной платформы, которую он спроектировал и построит благодаря новому финансированию в размере 800 тысяч долларов из гранта ONR DURIP.
Новые материалы, плавящиеся при температурах выше 4000 ° C
Как повысить температуру плавления материалов, которые уже плавятся при сверхвысоких температурах? В течение последних пяти лет Веккьо возглавлял проект Калифорнийского университета в Сан-Диего, финансируемый программой ONR Multidisciplinary University Research Initiatives (MURI), чтобы сосредоточиться на этом.
Команда по-новому подходит к этой сложной задаче. Чтобы понять их стратегию, вам сначала нужно знать, что есть два физических явления, которые в значительной степени определяют температуру, при которой твердый материал плавится в жидкость.
Первое явление — энтальпия. Энтальпия описывает энергию, связанную с сохранением материала в твердой форме. Чем выше энтальпия, тем сильнее будет связь между двумя атомами, и тем выше нужно нагреть материал, чтобы расплавить его, разорвав эти связи.
Второе явление — энтропия. Энтропия связана с беспорядком и описывает энергию, заставляющую атомы разделяться.
«Плавление твердого вещества происходит, когда энтропия становится достаточно высокой, чтобы превысить энтальпию», — сказал Веккьо.
Разработка материалов для сверхвысоких температур обычно сосредоточена на энтальпии. Но исследователи, похоже, достигли пределов энтальпийного подхода, по крайней мере, для материалов, которые не реагируют с кислородом. Препятствие связано с тем, что энтальпия связи между атомами в значительной степени фиксирована. Это означает, что как только вы найдете материалы с самой высокой энтальпией связывания, останется мало возможностей для увеличения температуры плавления этого материала за счет энтальпии.
В поисках материалов, плавящихся при еще более высоких температурах, Веккьо и его команда из инженерной школы Калифорнийского университета в Сан-Диего Джейкобс обратились к другому явлению, контролирующему температуру плавления: энтропии.
У большинства людей есть смутное ощущение, что энтропия имеет какое-то отношение к хаосу или беспорядку. Это понятие пригодится для понимания нового подхода к разработке материалов с рекордными температурами плавления.
«Жидкость имеет очень высокий уровень энтропии. Атомы движутся в жидкости повсюду, это энтропия. Если мы сможем сделать твердое тело похожим на жидкость с точки зрения его свободной энергии, тогда будет меньше движущей силы. для перехода из твердого состояния в жидкое », — сказал Веккьо.
Сделать твердое тело похожим на жидкость означает увеличить внутреннюю энтропию материала, когда оно твердое. Это то, что намеревался сделать Веккьо. Их стратегия состоит в том, чтобы увеличить беспорядок в новых высокотемпературных твердых материалах путем смешивания большого количества разных атомов вместе.
«Мы создаем беспорядок путем перемешивания атомов», — сказал Веккьо.
Применяя этот подход, исследователи заставляют свои твердые материалы структурно казаться более похожими на атомное состояние жидкой формы этого материала.Это снижает движущую силу, побуждающую твердое тело «хотеть» плавиться, что может привести к повышению температуры, при которой оно плавится.
Например, карбид кремния (SiC) — хорошо известный материал со сверхвысокой температурой плавления 2730 ° C. Но было бы полезно иметь сопутствующие материалы, плавящиеся даже при высоких температурах.
Следуя энтропийно-ориентированному подходу в предыдущем исследовании, Веккио и его сотрудники заменили атомы Si на равные количества пяти различных металлов, что привело к новым материалам с еще более высокими температурами плавления.Эти новые материалы, называемые высокоэнтропийными карбидами или, в более широком смысле, высокоэнтропийной керамикой, обсуждаются в исследовательской статье, опубликованной в журнале Acta Materialia в 2019 году.
Веккьо и его команда также ищут другое применение энтропии. Дополнительная энтропия может быть добавлена к системе твердого вещества путем добавления других вариаций молекулярных и атомных связей, которые сами по себе не увеличивают температуру плавления. Но когда вы добавляете их в систему в достаточном количестве, разнообразие молекулярных элементов и сценариев связывания еще больше увеличивает энтропию, что может повысить температуру, при которой твердое тело плавится в жидкость.
Исследователи должны быть в состоянии экспериментально подтвердить температуру плавления и другие свойства для такого рода подходов к разработке материалов, чтобы привести к новым полезным материалам. Вот где появляется новая платформа.
Платформа высокотемпературной дифракции рентгеновских лучей
Новая платформа высокотемпературной дифракции рентгеновских лучей, финансируемая грантом ONR DURIP для Калифорнийского университета в Сан-Диего, предназначена для нагрева образца до 4500 ° C, при этом очень точно измеряя его температуру и обнаруживая начало плавления.
Компоненты системы включают в себя: платформу, которая обеспечивает высокоскоростные измерения, называемую платформой для дифракции рентгеновских лучей высокой яркости; лазер высокой мощности для локального нагрева небольшой области образца материала; и высокотехнологичный термометр (пирометр), который регистрирует температуру до 4500 ° C, измеряя длину волны света, излучаемого источником тепла.
«Интеграция этих трех инструментов — увлекательная инженерная задача, — сказал Веккьо.
Чтобы преодолеть «проблему с контейнером», при которой контейнер плавится до того, как в нем находится экспериментальный образец, Vecchio планирует использовать образцы материалов в качестве собственных контейнеров.
«Мы будем нагревать только небольшую круглую область в середине образца с помощью лазера», — сказал он.
Оставшийся периметр образца, который не подвергается воздействию лазера, будет служить контейнером, в котором образец будет плавиться из твердого состояния в жидкость.
«Я с нетерпением жду возможности поделиться этой уникальной платформой с исследователями по всей стране», — сказал Веккьо. «Люди пытались разработать системы для измерения температуры плавления этих типов материалов, но их самая большая научная проблема заключается в том, что у них нет метода, позволяющего проверить, какую структуру имеет образец в момент предполагаемого начала плавления.Моя конструкция решит эту проблему », — пояснил Веккьо.« Построив нашу систему плавления внутри платформы для дифракции рентгеновских лучей, мы сможем точно знать структуру и тип материала, присутствующего прямо в точке плавления, и мы будем возможность полностью проверить плавление, поскольку он дает совершенно другой результат дифракции рентгеновских лучей по сравнению с твердым образцом ».
По его оценкам, установка будет запущена к концу 2022 года.
Финансируемое предложение ONR DURIP имеет право «Термодинамические измерения энтропийно-стабилизированных сверхвысокотемпературных материалов.”Профессор наноинжиниринга Калифорнийского университета в Сан-Диего Кеннет Веккио является главным исследователем (PI) гранта. (Номер награды ОНР: N00014-20-1-2872).
Дополнительные темы
Межмолекулярные силы
Молекула представляет собой наименьшую наблюдаемую группу атомов с уникальными связями, которые представляют состав, конфигурацию и характеристики чистого соединения. До этого момента наша основная задача заключалась в обнаружении и описании способов, которыми атомы связываются вместе, образуя молекулы.Поскольку все наблюдаемые образцы соединений и смесей содержат очень большое количество молекул ( около ! 0 20 ), мы также должны уделять внимание взаимодействиям между молекулами, а также их индивидуальным структурам. Действительно, многие физические характеристики соединений, которые используются для их идентификации (например, точки кипения, точки плавления и растворимость), обусловлены межмолекулярными взаимодействиями.
Все атомы и молекулы имеют слабое притяжение друг к другу, известное как притяжение ван-дер-Ваальса .Эта сила притяжения происходит из электростатического притяжения электронов одной молекулы или атома к ядрам другой. Если бы не было сил Ван-дер-Ваальса, вся материя существовала бы в газообразном состоянии, и жизнь в том виде, в каком мы ее знаем, была бы невозможна. Следует отметить, что между молекулами также действуют меньшие силы отталкивания, которые быстро увеличиваются при очень малых межмолекулярных расстояниях.
Точки кипения
Для общих целей полезно рассматривать температуру как меру кинетической энергии всех атомов и молекул в данной системе.С повышением температуры происходит соответствующее увеличение силы поступательных и вращательных движений всех молекул, а также колебаний атомов и групп атомов внутри молекул. Опыт показывает, что многие соединения обычно существуют в виде жидкостей и твердых тел; и что даже газы с низкой плотностью, такие как водород и гелий, можно сжижать при достаточно низкой температуре и высоком давлении. Из этого факта следует сделать четкий вывод о том, что силы межмолекулярного притяжения значительно различаются, и что точка кипения соединения является мерой силы этих сил.Таким образом, чтобы разрушить межмолекулярные притяжения, которые удерживают молекулы соединения в конденсированном жидком состоянии, необходимо увеличить их кинетическую энергию за счет повышения температуры образца до характерной точки кипения соединения.
В следующей таблице показаны некоторые факторы, влияющие на силу межмолекулярного притяжения. После формулы каждой записи в скобках указывается ее вес по формуле и температура кипения в градусах Цельсия.Во-первых, размер молекул. У больших молекул больше электронов и ядер, которые создают силы притяжения Ван-дер-Ваальса, поэтому их соединения обычно имеют более высокие температуры кипения, чем аналогичные соединения , состоящие из более мелких молекул. Очень важно применять это правило только к подобным соединениям. Примеры, приведенные в первых двух строках, похожи в том, что молекулы или атомы имеют сферическую форму и не имеют постоянных диполей. Форма молекулы также важна, как показывает вторая группа соединений.Верхний ряд состоит из молекул примерно сферической формы, тогда как изомеры в нижнем ряду имеют молекулы цилиндрической или линейной формы. Силы притяжения между последней группой обычно больше. Наконец, постоянные молекулярные диполи, генерируемые полярными ковалентными связями, приводят к еще большим силам притяжения между молекулами, при условии, что они обладают подвижностью, чтобы выстраиваться в соответствующие ориентации. Последние записи в таблице сравнивают неполярные углеводороды с соединениями равного размера, имеющими полярные связи с кислородом и азотом.Галогены также образуют полярные связи с углеродом, но они также увеличивают молекулярную массу, что затрудняет различение этих факторов.
Точки кипения (ºC) выбранных элементов и соединений | ||||
|---|---|---|---|---|
Увеличивающийся размер | ||||
| Атомный | Ar (40) -186 | Kr (83) -153 | Xe (131) -109 | |
| Молекулярный | CH 4 (16) -161 | (CH 3 ) 4 C (72) 9.5 | (CH 3 ) 4 Si (88) 27 | CCl 4 (154) 77 |
Молекулярная форма | ||||
Сферическая: 96| 3 ) 4 C (72) 9,5 | (CH 3 ) 2 CCl 2 (113) 69 | (CH 3 ) 3 CC (CH 3 ) 3 (114) 106 | | |
| Линейный: | CH 3 (CH 2 ) 3 CH 3 (72) 36 | Cl (CH 2 ) 3 Cl (113) 121 | CH 3 (CH 2 ) 6 CH 3 (114) 126 | |
Молекулярная полярность | ||||
| Неполярный: | H C = CH 2 (28) -104 | F 2 (38) -188 | CH 3 C≡CCH 3 (54) -32 | CF 4 (88) -130 |
| Полярный: | H 2 C = O (30) -21 | CH 3 CH = O (44) 20 | (CH 3 ) 3 N (59) 3.5 | (CH 3 ) 2 C = O (58) 56 |
| HC≡N (27) 26 | CH 3 C≡N (41) 82 | (CH 2 ) 3 O (58) 50 | CH 3 NO 2 (61) 101 | |
Точки плавления кристаллических твердых веществ нельзя классифицировать так же просто, как точки кипения. Расстояние между молекулами в кристаллической решетке невелико и регулярно, а межмолекулярные силы сдерживают движение молекул сильнее, чем в жидком состоянии.Размер молекулы важен, но форма также имеет решающее значение, поскольку отдельные молекулы должны согласовываться вместе, чтобы силы притяжения решетки были большими. Молекулы сферической формы обычно имеют относительно высокие температуры плавления, которые в некоторых случаях приближаются к температуре кипения. Это отражает тот факт, что сферы могут упаковываться вместе более плотно, чем другие формы. Эта чувствительность к структуре или форме является одной из причин того, что точки плавления широко используются для идентификации конкретных соединений.Данные в следующей таблице служат для иллюстрации этих моментов.
| Соединение | Формула | Точка кипения | Точка плавления | ||||
|---|---|---|---|---|---|---|---|
| пентан | CH 3 (CH 2 ) 3 CH 3 | 36ºC6 | –1 гексан | CH 3 (CH 2 ) 4 CH 3 | 69ºC | –95ºC | |
| гептан | CH 3 (CH 2 ) 1996 5 CH | 98ºC | –91ºC | ||||
| октановое число | CH 3 (CH 2 ) 6 CH 3 | 126ºC | –57ºC | ||||
нонан 1997| (CH 2 ) 7 CH 3 | 151ºC | –54ºC | | ||||
| декан | CH 3 (CH 2 ) 8 CH 3 | 900 56 174ºC–30ºC | |||||
| тетраметилбутан | (CH 3 ) 3 C-C (CH 3 ) 3 | 106ºC | + 100ºC |
Обратите внимание, что точки кипения неразветвленных алканов (от пентана до декана) увеличиваются довольно плавно с увеличением молекулярной массы, но точки плавления цепей с четным углеродом увеличиваются больше, чем температуры плавления цепей с нечетным углеродом.Четные цепи упаковываются вместе более компактно, чем нечетные. Последнее соединение, изомер октана, имеет почти сферическую форму и исключительно высокую температуру плавления (всего на 6º ниже точки кипения).
Водородная связь
Самая мощная межмолекулярная сила, влияющая на нейтральные (незаряженные) молекулы, — это водородная связь . Если мы сравним точки кипения метана (CH 4 ) -161ºC, аммиака (NH 3 ) -33ºC, воды (H 2 O) 100ºC и фтороводорода (HF) 19ºC, мы увидим большее изменение для эти молекулы аналогичного размера, чем ожидалось из данных, представленных выше для полярных соединений.Это показано графически на следующей диаграмме. Большинство простых гидридов элементов IV, V, VI и VII групп демонстрируют ожидаемое повышение температуры кипения с увеличением молекулярной массы, но гидриды наиболее электроотрицательных элементов (азота, кислорода и фтора) имеют аномально высокие температуры кипения для своей массы.
Исключительно сильное диполь-дипольное притяжение, вызывающее такое поведение, называется водородной связью . Водород образует полярные ковалентные связи с большим количеством электроотрицательных атомов, таких как кислород, и поскольку атом водорода довольно мал, положительный конец диполя связи (водород) может приближаться к соседним нуклеофильным или основным участкам ближе, чем другие полярные связи.Кулоновские силы обратно пропорциональны шестой степени расстояния между диполями, что делает эти взаимодействия относительно сильными, хотя они все еще слабые ( около от 4 до 5 ккал на моль) по сравнению с большинством ковалентных связей. Уникальные свойства воды во многом обусловлены сильной водородной связью, которая возникает между ее молекулами. На следующей диаграмме водородные связи изображены пурпурными пунктирными линиями.
Молекула, обеспечивающая полярный водород для водородной связи, называется донором .Молекула, которая обеспечивает богатый электронами участок, к которому притягивается водород, называется акцептором . Вода и спирты могут служить как донорами, так и акцепторами, тогда как простые эфиры, альдегиды, кетоны и сложные эфиры могут действовать только как акцепторы. Точно так же первичные и вторичные амины одновременно являются донорами и акцепторами, но третичные амины действуют только как акцепторы. Как только вы научитесь распознавать соединения, которые могут проявлять межмолекулярные водородные связи, их относительно высокая температура кипения становится понятной.Данные в следующей таблице служат иллюстрацией этого момента.
| Соединение | Формула | Мол. Вес. | Точка кипения | Точка плавления |
|---|---|---|---|---|
| диметиловый эфир | CH 3 OCH 3 | 46 | –24ºC | –138ºC |
| этанол | CH 3 CH 3 CH OH | 46 | 78ºC | –130ºC |
| пропанол | CH 3 (CH 2 ) 2 OH | 60 | 98ºC | –127ºC |
| диэтиловый эфир | (CH 3 CH 2 ) 2 O | 74 | 34ºC | –116ºC |
| пропиламин | CH 3 (CH 2 ) 2 NH 2 2 | 59 | 48ºC | –83ºC | |
| метиламиноэтан | CH 3 CH 2 NHCH 3 | 59 | 37ºC | |
| триметиламин | (CH 3 ) 3 N | 59 | 3ºC | –117ºC |
| этиленгликоль | HOCH 2 CH 2 OH | 62º57 | 62ºC | –13ºC |
| уксусная кислота | CH 3 CO 2 H | 60 | 118ºC | 17ºC |
| этилендиамин | H 2 NCH 2 CH 2 | 60 | 118ºC | 8.5ºC |
Спирты имеют значительно более высокую температуру кипения, чем простые эфиры сопоставимого размера (первые две записи), а изомерные 1º, 2º и 3º амины, соответственно, показывают снижение температуры кипения, причем два изомера с водородными связями имеют значительно более высокую температуру кипения, чем 3º-амин (записи 5 к 7). Кроме того, водородные связи O – H — O явно сильнее, чем водородные связи N – H — N, как мы видим, сравнивая пропанол с аминами. Как и ожидалось, наличие двух водородных связей в соединении еще больше повышает температуру кипения.Уксусная кислота (девятая запись) — интересный случай. Димерные частицы, показанные справа, удерживаемые двумя водородными связями, являются основным компонентом жидкого состояния. Если это точное представление о составе этого соединения, то мы ожидаем, что его точка кипения будет эквивалентна температуре кипения соединения C 4 H 8 O 4 (вес формулы = 120). Подходящее приближение такого соединения находится в тетраметоксиметане, (CH 3 O) 4 C, который на самом деле немного больше (вес формулы = 136) и имеет температуру кипения 114ºC.Таким образом, димерная водородно-связанная структура, по-видимому, хорошо представляет уксусную кислоту в конденсированном состоянии.
Здесь стоит отметить родственный принцип. Хотя водородная связь относительно слабая ( около от 4 до 5 ккал на моль), когда существует несколько таких связей, результирующая структура может быть довольно прочной. Водородные связи между целлюлозными волокнами придают большую прочность дереву и родственным материалам.
| Для получения дополнительной информации по этому вопросу щелкните здесь. |
|---|
Свойства кристаллических твердых тел |
|---|
Точки плавления
Большинство органических соединений имеют температуру плавления ниже 200 ºC. Некоторые из них разлагаются перед плавлением, некоторые — возвышаются, но большинство претерпевает повторное плавление и кристаллизацию без каких-либо изменений в молекулярной структуре. Когда чистое кристаллическое соединение нагревается или охлаждается жидкостью, изменение температуры образца со временем примерно равномерное.Однако, если твердое вещество плавится или жидкость замерзает, возникает разрыв, и температура образца остается постоянной до тех пор, пока фазовый переход не завершится. Это поведение показано на диаграмме справа, где зеленый сегмент представляет твердую фазу, голубой — жидкость, а красный — температурно-инвариантное равновесие жидкость / твердое тело. Для данного соединения эта температура представляет собой его точку плавления (или точку замерзания) и является воспроизводимой константой до тех пор, пока внешнее давление не изменяется.Длина горизонтальной части зависит от размера образца, поскольку количество тепла, пропорциональное теплоте плавления, должно быть добавлено (или удалено) до завершения фазового перехода. Хорошо известно, что точка замерзания растворителя понижается растворенным растворенным веществом, например рассол по сравнению с водой. Если два кристаллических соединения (A и B) тщательно смешиваются, температура плавления этой смеси обычно понижается и расширяется по сравнению с характерной острой точкой плавления каждого чистого компонента.Это обеспечивает полезные средства для установления идентичности или неидентичности двух или более соединений, поскольку точки плавления множества твердых органических соединений документируются и обычно используются в качестве теста на чистоту. | |
Интересная, но менее распространенная смешанная система включает молекулярные компоненты, которые образуют плотный комплекс или молекулярное соединение , способное существовать как отдельные частицы в равновесии с жидкостью того же состава. Такой вид обычно имеет четкую конгруэнтную точку плавления и дает фазовую диаграмму, имеющую вид двух соседних эвтектических диаграмм.Пример такой системы показан справа, молекулярное соединение представлено как A: B или C . Одна такая смесь состоит из -нафтола, т.пл. 94 ° C, и п-толуидин, т.пл. 43 ºC. Комплекс A: B имеет точку плавления 54 ºC, а на фазовой диаграмме показаны две эвтектические точки, первая при 50 ºC, вторая при 30 ºC. Молекулярные комплексы этого типа обычно имеют стехиометрию 50:50, как показано, но известны другие интегральные отношения. |
Полиморфизм
Полиморфы соединения — это различные кристаллические формы, в которых структура решетки молекул различается. Эти различные твердые вещества обычно имеют разные точки плавления, растворимость, плотность и оптические свойства. Многие полиморфные соединения имеют гибкие молекулы, которые могут принимать различные конформации, и рентгеновское исследование этих твердых тел показывает, что их кристаллические решетки накладывают определенные конформационные ограничения.В расплавленном состоянии или в растворе различные полиморфные кристаллы этого типа образуют одну и ту же быстро уравновешивающуюся смесь молекулярных частиц. Полиморфизм подобен гидратированным или сольватированным кристаллическим формам, но отличается от них. Было подсчитано, что более 50% известных органических соединений могут быть способны к полиморфизму.
Тетраацетат рибофуранозы, показанный вверху слева внизу, был источником ранней загадки, связанной с полиморфизмом. Соединение было впервые получено в Англии в 1946 году, и его температура плавления составляла 58 ºC.Спустя несколько лет тот же материал с такой же температурой плавления был независимо получен в Германии и США. Затем американские химики обнаружили, что точки плавления их ранних препаратов поднялись до 85 ºC. В конце концов стало очевидно, что ни одна лаборатория, в которую была введена форма с более высокой температурой плавления, больше не могла производить форму с более высокой температурой плавления. Микроскопические зародыши стабильного полиморфа в окружающей среде неизбежно направляют кристаллизацию с этой целью.Данные дифракции рентгеновских лучей показали, что полиморф с более низкой температурой плавления является моноклинным, пространственная группа P2. Форма с более высокой температурой плавления была орторомбической, пространственная группа P2 1 2 1 2 1 .
Полиморфизм оказался решающим фактором в фармацевтике, производстве твердых пигментов и полимеров. Некоторые примеры описаны ниже.
Ацетаминофен — распространенный анальгетик (например, тайленол). Обычно его получают в виде моноклинных призм (верхний рисунок) при кристаллизации из воды.Менее стабильный ромбический полиморф, имеющий лучшие физические свойства для прессования в таблетки, показан под первым. Хинакридон — важный пигмент, используемый в красках и чернилах. Он имеет жесткую плоскую молекулярную структуру, а в разбавленном растворе имеет светло-желтый цвет. Идентифицировано три полиморфа. Межмолекулярные водородные связи являются важной особенностью во всех этих случаях. Цвета кристаллов варьируются от ярко-красного до фиолетового. Противоязвенный препарат ранитидин (Зантак) был впервые запатентован компанией Glaxo-Wellcome в 1978 году.Семь лет спустя та же компания запатентовала второй полиморф ранитидина. Это расширило лицензионное покрытие до 2002 года, и усилия по продвижению на рынок генерической формы были сорваны, потому что было невозможно приготовить первый полиморф, не загрязненный вторым. Относительно простой арилтиофен, обозначенный как EL1, был получен и изучен химиками компании Eli Lilly. На нем были представлены шесть форм полиморфных кристаллов, изображения которых показаны слева.
| |||||||||||||||||||||||||||||||||
Типичный пример изменений полиморфизма показан шоколадом, который подвергался нагреванию и / или длительному хранению.Со временем или когда он сбрасывается после размягчения, на нем могут появиться белые пятна, он больше не тает во рту и не имеет такого приятного вкуса, как должен. Это потому, что у шоколада более шести полиморфов, и только один идеален в качестве кондитерского изделия. Он создается в тщательно контролируемых заводских условиях. Неправильные условия хранения или транспортировки вызывают превращение шоколада в другие полиморфы.
Шоколад представляет собой массу какао и частицы сахара, взвешенные в матрице какао-масла.Масло какао представляет собой смесь триглицеридов, в которой преобладают стеароильная, олеоильная и пальмитоильная группы. Именно полиморфы этой матрицы влияют на качество шоколада.
Полиморфы с низкой температурой плавления кажутся слишком липкими или густыми во рту. Форма V, полиморф какао-масла с лучшим вкусом, имеет температуру плавления от 34 до 36 ºC, что немного ниже, чем внутри человеческого тела, что является одной из причин, по которой оно тает во рту. К сожалению, форма VI с более высокой температурой плавления более стабильна и образуется с течением времени.
| Полиморф | Точка плавления | Комментарии |
|---|---|---|
| I | 17,4 ºC | Получается путем быстрого охлаждения расплава. |
| II | 23,4 ºC | Производится путем охлаждения расплава со скоростью 2 ºC / мин. |
| III | 26 ºC | Получен преобразованием формы II при 5-10 ºC. |
| IV | 27 ºC | Получается преобразованием формы III при хранении при 16-21 ºC. |
| V | 34 ºC | Производится темперированием (охлаждение с последующим небольшим повторным нагревом при перемешивании). |
| VI | 36-37 ºC | Произведено из V после 4 месяцев пребывания при комнатной температуре. |
Растворимость в воде
Воду называют «универсальным растворителем», и ее широкое распространение на этой планете и существенная роль в жизни делают ее эталоном для дискуссий о растворимости.Вода растворяет многие ионные соли благодаря своей высокой диэлектрической проницаемости и способности сольватировать ионы. Первый уменьшает притяжение между противоположно заряженными ионами, а второй стабилизирует ионы, связываясь с ними и делокализуя плотность заряда. Многие органические соединения, особенно алканы и другие углеводороды, почти не растворяются в воде. Органические соединения, растворимые в воде, такие как большинство из перечисленных в приведенной выше таблице, обычно имеют акцепторные и донорные группы водородных связей. Наименее растворимым из перечисленных соединений является диэтиловый эфир, который может служить только акцептором водородной связи и на 75% состоит из углеводородов.Даже в этом случае диэтиловый эфир примерно в двести раз более растворим в воде, чем пентан.
Основной характеристикой воды, которая влияет на эти растворимости, является обширная ассоциация ее молекул друг с другом с водородными связями. Эта сеть с водородными связями стабилизируется суммой всех энергий водородных связей, и если бы неполярные молекулы, такие как гексан, были вставлены в сеть, они разрушили бы локальную структуру, не внося никаких собственных водородных связей.Конечно, молекулы гексана испытывают значительное притяжение Ван-дер-Ваальса к соседним молекулам, но эти силы притяжения намного слабее, чем водородная связь. Следовательно, когда гексан или другие неполярные соединения смешиваются с водой, сильные силы ассоциации водной сетки исключают неполярные молекулы, которые должны тогда существовать в отдельной фазе. Это показано на следующем рисунке, и поскольку гексан менее плотен, чем вода, гексановая фаза плавает на водной фазе.
Важно помнить об этой тенденции воды исключать неполярные молекулы и группы, поскольку это фактор в структуре и поведении многих сложных молекулярных систем. Общая номенклатура, используемая для описания молекул и областей внутри молекул, — гидрофильный, для полярных, связывающих водород фрагментов и гидрофобный для неполярных частиц.
| Для получения дополнительной информации по этому вопросу щелкните здесь. |
|---|
Выберите проблему Точки кипения Водородная связь Растворимость воды
Эта страница является собственностью Уильяма Ройша.
Комментарии, вопросы и ошибки следует
направлять по адресу [email protected].
Эти страницы предоставляются IOCD для оказания помощи в наращивании потенциала в области химического образования. 05.05.2013
Конец этой дополнительной темы
Подробнее о межмолекулярных силах |
|---|
Межмолекулярные силы и физические свойства
Силы притяжения, существующие между молекулами, ответственны за многие объемные физические свойства, проявляемые веществами.Некоторые соединения представляют собой газы, некоторые — жидкости, а другие — твердые вещества. Точки плавления и кипения чистых веществ отражают эти межмолекулярные силы и обычно используются для идентификации. Из этих двух точка кипения считается наиболее представительной мерой общего межмолекулярного притяжения. Таким образом, точка плавления отражает тепловую энергию, необходимую для преобразования высокоупорядоченного массива молекул в кристаллической решетке в хаотичность жидкости. Расстояние между молекулами в кристаллической решетке невелико и регулярно, а межмолекулярные силы сдерживают движение молекул сильнее, чем в жидком состоянии.Размер молекулы важен, но форма также имеет решающее значение, поскольку отдельные молекулы должны согласовываться вместе, чтобы силы притяжения решетки были большими. Молекулы сферической формы обычно имеют относительно высокие температуры плавления, которые в некоторых случаях приближаются к точке кипения, что отражает тот факт, что сферы могут упаковываться вместе более плотно, чем другие формы. Эта чувствительность к структуре или форме является одной из причин того, что точки плавления широко используются для идентификации конкретных соединений.
Точки кипения, с другой стороны, по существу отражают кинетическую энергию, необходимую для высвобождения молекулы из кооперативного притяжения жидкого состояния, так что она становится свободной и относительно независимой разновидностью газообразного состояния.Все атомы и молекулы имеют слабое притяжение друг к другу, известное как притяжение Ван-дер-Ваальса . Эта сила притяжения происходит из электростатического притяжения электронов одной молекулы или атома к ядрам другой, и была названа лондонской дисперсионной силой .
Следующая анимация показывает, как близкое сближение двух неоновых атомов может нарушить их распределение электронов таким образом, чтобы вызвать дипольное притяжение. Индуцированные диполи являются кратковременными, но их достаточно для разжижения неона при низкой температуре и высоком давлении.
В общем, более крупные молекулы имеют более высокие температуры кипения, чем более мелкие молекулы того же типа, что указывает на то, что дисперсионные силы увеличиваются с массой, числом электронов, числом атомов или некоторой их комбинацией. В следующей таблице перечислены точки кипения ряда элементов и ковалентных соединений, состоящих из молекул, не имеющих постоянного диполя. Число электронов в каждой разновидности указано в первом столбце, а масса каждого дается в виде числа в верхнем индексе перед формулой.
| # Электроны | Молекулы и точки кипения ºC |
|---|---|
| 10 | 20 Ne –246; 16 CH 4 –162 |
| 18 | 40 Ar –186; 32 SiH 4 –112; 30 C 2 H 6 –89; 38 F 2 –187 |
| 34-44 | 84 Kr –152; 58 C 4 H 10 –0.5; 72 (CH 3 ) 4 C 10; 71 Cl 2 –35; 88 CF 4 -130 |
| 66-76 | 114 [(CH 3 ) 3 C] 2 106; 126 (CH 2 ) 9 174; 160 Br 2 59; 154 CCl 4 77; 138 C 2 F 6 –78 |
В первой строке показаны две десятиэлектронные молекулы.Неон тяжелее метана, но кипит на 84 градуса ниже. Метан состоит из пяти атомов, и дополнительные ядра могут предоставить больше возможностей для индуцированного образования диполей по мере приближения других молекул. Легкость, с которой электроны молекулы, атома или иона смещаются соседним зарядом, называется поляризуемостью , поэтому мы можем сделать вывод, что метан более поляризуем, чем неон.
Во второй строке перечислено четыре восемнадцать электронных молекул. Большинство их точек кипения выше, чем у десятиэлектронных соединений неона и метана, но фтор является исключением, он кипит на 25º ниже метана.Остальные примеры в таблице соответствуют корреляции точки кипения с полным числом электронов и числом ядер, но фторсодержащие молекулы остаются исключением.
Аномальное поведение фтора можно объяснить его очень высокой электроотрицательностью. Ядро фтора настолько сильно притягивает свои электроны, что они гораздо менее поляризуемы, чем электроны большинства других атомов.
Конечно, в отношениях точки кипения могут доминировать даже более сильные силы притяжения, такие как электростатическое притяжение между противоположно заряженными ионными частицами и между частичным разделением зарядов молекулярных диполей.Следовательно, молекулы, обладающие постоянным дипольным моментом, должны иметь более высокие температуры кипения, чем эквивалентные неполярные соединения, как показано данными в следующей таблице.
| # Электроны | Молекулы и точки кипения ºC |
|---|---|
| 14-18 | 30 C 2 H 6 –89; 28 H 2 C = CH 2 -104; 26 HC≡CH –84; 30 H 2 C = O –21; 27 HC≡N 26; 34 CH 3 -F –78 |
| 22-26 | 42 CH 3 CH = CH 2 –48; 40 CH 3 C≡CH –23; 44 CH 3 CH = O 21; 41 CH 3 C≡N 81; 46 (CH 3 ) 2 O –24; 50.5 CH 3 -Cl –24; 52 CH 2 F 2 –52 |
| 32-44 | 58 (CH 3 ) 3 CH –12; 56 (CH 3 ) 2 C = CH 2 –7; 58 (CH 3 ) 2 C = O 56; 59 (CH 3 ) 3 N 3; 95 CH 3 -Br 45; 85 CH 2 Cl 2 40; 70 шв. Франков 3 –84 |
В первом ряду соединений этан, этен и этин не имеют молекулярного диполя и служат полезными ссылками для производных с одинарными, двойными и тройными связями, которые имеют.Формальдегид и цианистый водород ясно показывают усиленное межмолекулярное притяжение, возникающее в результате постоянного диполя. Метилфторид аномален, как и большинство фторорганических соединений. Во втором и третьем рядах все соединения имеют постоянные диполи, но те, которые связаны с углеводородами (первые два соединения в каждом случае), очень малы. Большие молекулярные диполи происходят в основном от связей с высокоэлектроотрицательными атомами (по сравнению с углеродом и водородом), особенно если они являются двойными или тройными связями.Таким образом, альдегиды, кетоны и нитрилы обычно имеют более высокую температуру кипения, чем углеводороды и алкилгалогениды того же размера. Нетипичное поведение соединений фтора неожиданно ввиду большой разницы в электроотрицательности углерода и фтора.
Водородная связь
Большинство простых гидридов групп IV, V, VI и VII элементы отображают ожидаемое повышение температуры кипения с количеством электронов и молекулярной массы, но гидриды наиболее электроотрицательные элементы (азот, кислород и фтор) имеют аномально высокие температуры кипения, обозначенные ранее как график, также перечисленный справа.
| Группа | Молекулы и точки кипения ºC |
|---|---|
| VII | HF 19; HCl –85; HBr –67; HI –36 |
| VI | H 2 O 100; H 2 S –60; H 2 Se –41; H 2 Te –2 |
| V | NH 3 –33; PH 3 –88; AsH 3 –62; СбХ 3 –18 |
Органические соединения, содержащие связи O-H и N-H, также будут демонстрировать усиленное межмолекулярное притяжение за счет водородных связей. Некоторые примеры приведены ниже.
| Класс | Молекулы и точки кипения ºC | ||
|---|---|---|---|
| Кислород Соединения | C 2 H 5 OH 78; (CH 3 ) 2 O –24; (CH 2 ) 2 O 11 этанол диметиловый эфир этиленоксид | (CH 2 ) 3 CHOH 124 и (CH 2 ) 4 O 66 циклобутанол тетрагидрофуран | C 3 H 7 NH 2 50; C 2 H 5 NH (CH 3 ) 37; (CH 3 ) 3 N 3 пропиламин этилметиламин триметиламин | (CH 2 ) 4 CHNH 2 107 & (CH 2 ) 4 NCH 3 циклопентиламин N-метилпирролидин |
| Комплекс Функции | C 2 H 5 CO 2 H 141 и CH 3 CO 2 CH 3 57 метилацетат пропаноиновая кислота C 3 H 7 CONH 2 218 & CH 3 CON (CH 3 ) 2 165 бутирамид N, N-диметилацетамид | ||
Растворимость в воде
Вода — самая распространенная и важная жидкость на этой планете.При выделении и очистке соединений необходимо учитывать смешиваемость других жидкостей с водой и растворимость твердых веществ в воде. С этой целью в следующей таблице приведена смешиваемость с водой (или растворимость) ряда низкомолекулярных органических соединений. Сразу видно влияние важных атомов водорода, связывающих атомы водорода, кислорода и азота. В первой строке перечислены несколько углеводородных и хлорированных растворителей. Все они без исключения не смешиваются с водой, хотя интересно отметить, что π-электроны бензола и несвязывающие валентные электроны хлора действуют, слегка увеличивая их растворимость по сравнению с насыщенными углеводородами.По сравнению с углеводородами соединения кислорода и азота, перечисленные во втором, третьем и четвертом рядах, более чем в сто раз более растворимы в воде, и многие из них полностью смешиваются с водой.
| Тип соединения | Конкретные соединения | Грамм / 100 мл | Молей / литр | Конкретные соединения | Грамм / 100 мл | Моль / литр | |
|---|---|---|---|---|---|---|---|
| Углеводороды и Алкилгалогениды | бутан гексан циклогексан | 0.007 0,0009 0,006 | 0,0012 0,0001 0,0007 | бензол хлористый метилен хлороформ | 0,07 1,50 0,8 | 0,009 0,180 0,07 | |
| Соединения Имеющие Один кислород | 1-бутанол трет-фенол | -бутанолан 9,0 полный 3,6 8,7 | 1,2 полный 0,36 0.90 | этиловый эфир THF фуран анизол | 6,0 полный 1,0 1,0 | 0,80 полный 0,15 0,09 | |
| Соединения Имеющие Два кислорода Два кислорода | 1,3-пропандиол 90окси180 2-пропандиол-2-этанол кислота бензойная кислота | полный полный полный полный | полный полный полный полный | 1,2-диметоксиэтан 1,4-диоксан этилацетат γ-бутиролактон | полный полный 8.0 полный | полный полный 0,91 полный | |
| Азот Содержит Соединения | 1-аминобутан циклогексиламин анилин пирролидин пиррол | полный полный 3,4 полный 6.0 | полный полный 0,37 полный 0,9 | триэтиламин пиридин пропионитрил 1-нитропропан ДМФ | 5.5 полный 10,3 1,5 полный | 0,54 полный 2,0 0,17 полный |
Из приведенных выше данных стоит отметить некоторые общие тенденции. Во-первых, спирты (вторая строка слева) обычно более растворимы, чем простые эфиры того же размера (вторая строка справа). Это отражает тот факт, что гидроксильная группа может функционировать как донор, так и акцептор водородной связи; тогда как кислород простого эфира может служить только акцептором. Повышенная растворимость фенола по сравнению с циклогексанолом может быть связана с его большей кислотностью, а также с эффектом пи-электронов, отмеченным в первой строке.
Циклический эфир ТГФ (тетрагидрофуран) более растворим, чем его аналог с открытой цепью, возможно, потому, что атом кислорода более доступен для водородной связи с молекулами воды. Из-за пониженной основности кислорода в ароматическом соединении фуране он гораздо менее растворим. Атом кислорода в анизоле также дезактивируется при сопряжении с бензольным кольцом (обратите внимание, он активирует кольцо в реакциях электрофильного замещения).
Второй атом кислорода резко увеличивает растворимость в воде, о чем свидетельствуют соединения, перечисленные в третьей строке.Снова слева перечислены гидроксильные соединения.
Азот оказывает солюбилизирующее влияние, подобное кислороду, как показано соединениями в четвертом ряду. Первичные и вторичные амины, перечисленные в левом столбце, могут действовать как доноры, так и акцепторы водородных связей. Ароматичность снижает основность пиррола, но увеличивает его кислотность. Соединения в правом столбце могут играть только акцепторную роль. Удивительна низкая растворимость нитросоединения.
Эта страница является собственностью Уильяма Ройша.
Комментарии, вопросы и ошибки следует
направлять по адресу [email protected].
Эти страницы предоставляются IOCD для оказания помощи в наращивании потенциала в области химического образования. 05.05.2013
Конец этой дополнительной темы
точек плавления некоторых обычных веществ
«Человек должен знать свои ограничения», — однажды сказал великий человек. Это справедливо и для материалов.
Поскольку ядро планеты расплавлено, поверхность в основном вода, и даже органические существа почти исключительно жидкие по природе, жидкое состояние является обычным состоянием материи Земли.
Плавление — это процесс, посредством которого тепло переводит вещество из твердого состояния в жидкое. Некоторые вещества превращаются легче, чем другие, и говорят, что они имеют более низкую температуру плавления, чем те, которым требуется больше тепла, чтобы вызвать это изменение.
Эти теоретические точки плавления обычно предполагают давление воздуха, равное давлению на уровне моря. Точки плавления и кипения изменяются с повышением или понижением давления. По этой причине вода не так легко превращается в пар в скороварке или автоклаве.
Вода — наиболее распространенное жидкое вещество на поверхности планеты, но даже металлы можно легко найти в жидком виде. Ртуть используется в термометрах из-за ее способности оставаться жидкостью при низких температурах и из-за высокой точки кипения. Элемент Галлий можно превратить из твердого в жидкое, просто поместив его на ладонь.
Настоящие металлы — это химические элементы, которые обычно проявляют свойства высокой электропроводности, блеска и / или пластичности.Они определяются своим положением в Периодической таблице элементов и сгруппированы в такие семейства, как щелочные металлы, щелочноземельные металлы, переходные металлы и редкоземельные металлы.
Кроме того, можно создать многие сплавы, некоторые из которых сложнее других, путем объединения металлов с другими металлами и / или неметаллическими элементами. При таком сочетании результат считается легированным.
Эти сплавы обладают интересными характеристиками, уникальными для всех вместе взятых пропорций. Некоторые сплавы на самом деле плавятся при более низкой температуре плавления, чем любой из их компонентов по отдельности.Когда соотношение приводит к самой низкой возможной температуре плавления для объединенных веществ, эти сплавы называют «эвтектическими» или эвтектическими сплавами.
Например: свинец обычно плавится при 327 ° C, а олово — при 231 ° C. В сочетании при соотношении свинца 67% и олова 33%, свинцово-оловянный припой достигает своей самой низкой точки плавления 180 ° C. объявлены вне закона или их избегают из-за токсичных свойств свинца.
Для пайки соединений, как в сантехнике, используется твердый припой.Эти припои обычно представляют собой сплав медь / цинк или медь / серебро. Они плавятся при более высоких температурах, чем свинцово-оловянные, и медленнее возвращаются в твердое состояние.
Эвтектоидная сталь содержит 0,9% углерода (эвтектическая точка системы железо-углерод) и называется перлитом, который состоит из чередующихся слоев альфа-феррита и цементита. Это двухфазная микроструктура, встречающаяся в некоторых сталях и чугунах.
Имея это в виду, вот потенциально полезная таблица температур плавления для обычных веществ, часто используемых при пайке, пайке, сварке, ювелирных изделиях или ремесленных мастерских, как это применяется на Земле на уровне моря.
| Порядок точек плавления | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Обычно Используемое название | Химический Символ | Точка плавления ° F | Точка плавления ° C | Удельная Плотность | Troy Ozs / Cu In | |||||||||||
| Фосфор | P | 111 | 44 | 1,82 | 0,959 | |||||||||||
| Олово | Sn | 450 | 232 | 7.3 | 3,846 | |||||||||||
| Висмут | Bi | 520 | 271 | 9,8 | 5,163 | |||||||||||
| Кадмий | Cd | 610 | 321 | 8,65 57 | Pb | 621 | 327 | 11,34 | 5,973 | |||||||
| Цинк | Zn | 787 | 419 | 7,1 | 3,7758 | |||||||||||
| Сурьма | 934 934 | Сурьма 6.62 | 3,448 | |||||||||||||
| Магний | Mg | 1202 | 650 | 1,75 | 0,917 | |||||||||||
| Алюминий | Al | 1220 | 660 | 2,7 | 1,423 57 | Монета | — | 1615 | 879 | 10,31 | 5,43 | |||||
| Серебро, стерлинговое серебро | — | 1640 | 893 | 10.36 | 5,457 | |||||||||||
| Серебро, чистое | Ag | 1761 | 961 | 10,49 | 5,525 | |||||||||||
| Золото, чистое 24K | Au | 1945 | 1063 | 19,32,857 | ||||||||||||
| Медь | Cu | 1981 | 1083 | 8,96 | 4,719 | |||||||||||
| Марганец | Mn | 2273 | 1245 | 7.43 | 3,914 | |||||||||||
| Бериллий | Be | 2340 | 1280 | 1,82 | 0,959 | |||||||||||
| Кремний | Si | 2605 | 1430 | 2,33 | 1430 | 2,33 | Ni | 2651 | 1455 | 8,9 | 4,691 | |||||
| Кобальт | Co | 2723 | 1495 | 8,9 | 8.9 | |||||||||||
| Железо | Fe | 2802 | 1539 | 7,87 | 4,145 | |||||||||||
| Палладий | Pd | 2831 | 1555 | 12 | 6,322 | 6,322 | Pt3224 | 1773 | 21,45 | 11,301 | ||||||
| Хром | Cr | 3430 | 1890 | 7,19 | 3.788 | |||||||||||
| Родий | Rh | 3571 | 1966 | 12,44 | 6,553 | |||||||||||
| Иридий | Ir | 4449 | 2454 | 22,5 | 22,5 | 11,849 | 4500 | 2500 | 12,2 | 6,428 | ||||||
| Молибден | Mo | 4760 | 2625 | 10,2 | 5.347 | |||||||||||
| Осмий | Os | 4892 | 2700 | 22,5 | 11,854 | |||||||||||
| Олово | — | 464 | 240 | — | — | — | — | |||||||||
| — | — | |||||||||||||||
| — | — | 446 | 230 | — | — | |||||||||||
| Типы принтеров: олово-сурьма-свинец | — | 365 | 185 | — | — | |||||||||||
| Agar | — | 185 | 85 | — | — | |||||||||||
| Стеариновая кислота | — | 160.2 | 71,2 | — | — | |||||||||||
| Парафин | — | 150 | 65,6 | — | — | |||||||||||
| Пчелиный воск | — | 140 | — 64 | — | 140 | — 64 | 934||||||||||
| Пальмитиновая кислота | — | 145,4 | 63 | — | — | |||||||||||
| Лауриновая кислота | — | 111,2 | 44 | — | — | |||||||||||
| ) | — | 110 | 43.3 | — | — | |||||||||||
| Говяжий жир | — | 107,6 | 42 | — | — | |||||||||||
| Шоколадные конфеты | — | 60-97 | 15,6-36,1 | — | ||||||||||||
| Canola Oil | — | 14 | -10 | — | — | |||||||||||
| Углерод | C | — | — | 2,22 | 1. Разное | |||||||||||

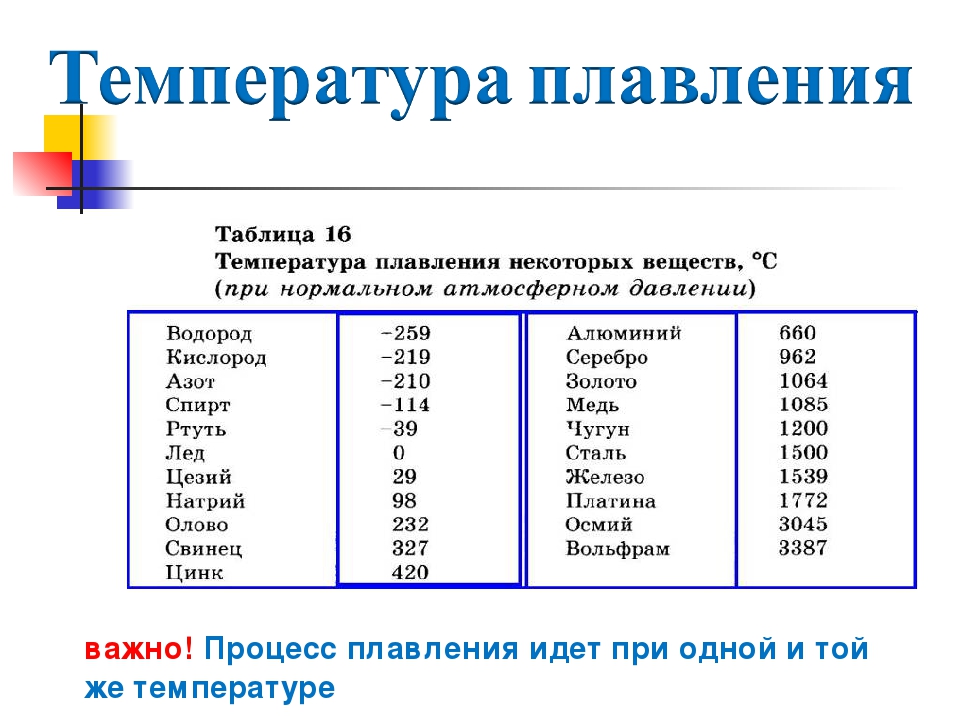 Формировать расплав несложно, но при этом необходимо соблюдать элементарную безопасность и внимательность.
Формировать расплав несложно, но при этом необходимо соблюдать элементарную безопасность и внимательность.