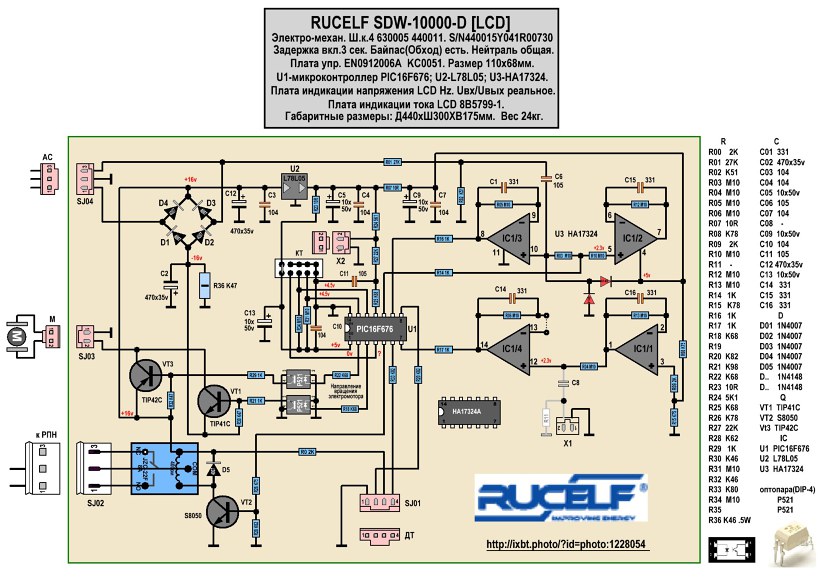
Ремонт стабилизаторов напряжения Ресанта — несложное дело при наличии оригинальных запчастей
Эта статья расскажет о таких вопросах:
- Основной принцип работы стабилизаторов «Ресанта».
- Особенности работы электромеханического прибора.
- Его основные неисправности.
- Ремонт сервопривода.
- Как работают релейные нормализаторы?
- Ремонт реле.
- Проведение диагностики отремонтированного стабилизатора.
- Другие неисправности релейных приборов.
В очень многих домах и квартирах используются те стабилизаторы напряжения, которые были сделаны в стенах компании «Ресанта». Благодаря использованию этих приборов владельцы обеспечивают стабильную работу и защищают «здоровье» всех своих домашних электроприборов.
В конечном итоге каждый домашний электроприбор работает в течение долгого времени и очень редко требует ремонта.
Хотим отметить, что стабилизатор также является домашним прибором, который требует надлежащего ухода и соблюдения необходимых условий эксплуатации.
Кроме этого он может выходить из строя после долгих лет эксплуатации. Другими словами он также обладает способностью ломаться.
Смотря на эту способность, мы решили посвятить статью слабым местам стабилизаторов марки «Ресанта» и рассмотреть, каким образом можно отремонтировать поврежденные элементы, а также восстановить полную работоспособность этого востребованного устройства.
Но, сначала расскажем об общем строении и принципе работы устройств этой марки.
Принцип работы
Как и все стабилизаторы напряжения, так и нормализаторы марки «Ресанта» состоят из:
- автоматического трансформатора.
- электронного блока.
- вольтметра.
- элемента, который осуществляет подключение/отключение определенных обмоток.
Учитывая то, что производитель осуществляет выпуск различных видов стабилизаторов, элементы для подключения обмоток являются разными. О них мы отметим несколько ниже, а именно тогда, когда будем рассматривать особенности работы и ремонта каждого вида нормализатора от латвийского производителя.
О них мы отметим несколько ниже, а именно тогда, когда будем рассматривать особенности работы и ремонта каждого вида нормализатора от латвийского производителя.
Электронный блок любого стабилизатора компании «Ресанта» осуществляет управление всей работой устройства. Он управляет работой вольтметра и получает данные об уровне входного напряжения. Дальше он сравнивает это напряжение с нормированным и определяет, сколько вольт нужно добавить или отнять.
После этого определяется то, какие обмотки стабилизатора нужно подключить или же отключить. Когда известна эта информация электронный блок подключает/отключает необходимые обмотки с помощью реле или сервопривода и наши электроприборы получают нормализованный ток.
Такой принцип стабилизации тока присущ каждому стабилизатору напряжения от компании «Ресанта». Однако процесс стабилизации в различных моделях компании имеет отличия. Они обусловлены тем, что по-разному происходит подключение/отключение обмоток трансформатора.
В стенах компании выпускается два типа стабилизаторов:
- Электромеханические.

- Релейные.
И, конечно, ремонт каждого из них имеет свои особенности.
Особенности работы электромеханического прибора
Сначала мы рассмотрим электромеханический нормализатор. Устройство этого стабилизатора напряжения от компании «Ресанта» предусматривает наличие такого элемента как сервопривод. Собственно благодаря ему осуществляется переключение различных обмоток автоматического трансформатора.
Переключение этих обмоток осуществляется плавно и в результате обеспечивается точная регулировка напряжения на выходе.
Каким же образом происходит это плавная регулировка? Сервопривод представляет собой двигатель и щетку (электрический контакт), которая прикреплена к якорю двигателя. Когда этот якорь крутится, то движется и щетка. Она постоянно контактирует с медными обмотками трансформатора.
По сути дела она скользит по ним. Она имеет такую ширину, которая позволяет соединять две обмотки одновременно. В результате на выходе не пропадает фаза.
Для того, чтобы щетка двигалась в определенном направлении и на определенную величину, в нормализаторе создается напряжение ошибки. Далее благодаря операционному усилителю и транзисторному выходному каскаду (он представляет собой усилитель мощности) это напряжение усиливается.
После этого оно подается на двигатель и заставляет крутиться якорь в определенном направлении.
В таком направлении движется и щетка, которая контактирует с обмотками. Напряжение ошибки является пропорциональным величине, которая является разницей между количеством вольт на входе и необходимым количеством вольт.
Сигнал ошибки может иметь одну из двух полярностей и в результате каждая полярность заставляет ось двигателя крутиться в определенном направлении. Такими являются особенности работы электромеханического нормализатора.
Отметим, что очень многие люди покупают 10-киловольт-амперный электромеханический стабилизатор. Поэтому возможные неисправности и поломки этого типа стабилизатора напряжения от компании «Ресанта» будут рассмотрены на этой модели.
Рис. 1. Электросхема стабилизатора АСН-10000/1-ЭМ.
Стоит обратить внимание на тот факт, что общее строение всех нормализаторов этого типа является похожим. Различия заключаются в отдельных элементах моделей с разными уровнями мощности.
Основные неисправности
Из вышеописанного принципа работы электромеханического стабилизатора становится понятно, что когда происходит изменение тока в электросети, происходит одновременное вращение якоря двигателя и движение графитовой щетки.
Постоянное движение сервопривода и является главной слабостью электромеханического устройства. Почему? Потому, что в результате трения щетки о витки катушки происходит чрезмерное нагревание как щетки, так и витков под ней.
Кроме этого, трение вызывает износ щетки и загрязнение медных проводов. Последняя причина обусловливает появление искр.
Учитывая тот факт, что в наших электролиниях ток меняется очень часто, то с такой же частотой происходит движение сервопривода. Такое частое вращение становится причиной выхода из строя самого двигателя.
Такое частое вращение становится причиной выхода из строя самого двигателя.
Примечательной особенностью является то, что поломка двигателя вызывает выход из строя других деталей. Так, появляется вероятность выхода из строя выходного каскада управления двигателем.
Специалисты компании «Ресанта» собирают этот каскад на основе пары транзисторов Q2 TIP41C и Q1 TIP42C. Когда происходит сгорание этих транзисторов, то сгорают и резисторы R45 и R46.
Они являются составляющими коллекторной цепи вышеуказанных транзисторов. R45 и R46 характеризуются сопротивлением в 10 Ом и мощностью в 2 ватта.
Когда есть такие неисправности, то надо провести проверку линейного стабилизатора. Его латвийские специалисты собирают на базе стабилитрона DM4 и транзистора Q3 TIP41C.
Если все эти составляющие электросхемы стабилизатора напряжения электромеханического типа, изготовленного компанией «Ресанта», сгорели, то их в любом случае нужно купить и заменить.
Ремонт двигателя сервопривода
Когда сгорел сам двигатель, то есть два варианта:
- Покупка нового и его установка.

- Попытка реставрации старого двигателя.
Второй вариант дает возможность реанимировать двигатель собственными силами, однако, на не долгое время. Для реанимации нужно произвести отключение двигателя от общей схемы. После этого его нужно подключить к мощному источнику питания.
Вашей задачей является подача на его выходы тока с постоянным напряжением в 5 вольт. Ток при этом должен иметь силу от 90 до 160 мА. При подаче такого тока на щетках двигателя сгорает каждая мелкая частица «мусора».
Полезный совет: поскольку двигатель относится к реверсивному типу, то при подаче напряжения нужно менять полярность. Эта процедура проводится два раза.
После таких действий двигатель сможет снова работать, и стабилизатор будет выполнять свою основную функцию. Далее по несложной схеме можно проводить процедуру подключения стабилизатора напряжения, выпущенного компанией «Ресанта».
Эта схема предусматривает подключение входного фазного и нейтрального кабелей к входной фазной и нейтральной клеммам соответственно. Аналогичным является подключение выходных проводов. Также обязательно подключают заземляющий провод.
Аналогичным является подключение выходных проводов. Также обязательно подключают заземляющий провод.
Как работают релейные стабилизаторы?
Что касается релейных стабилизаторов от латвийской компании, то во время их эксплуатации возникают другие неисправности. Соответственно, их ремонт представляет собой иную процедуру.
Перед тем, как рассмотреть особенности ремонта релейного нормализатора «Ресанта», обратим внимание на особенности его работы. Релейное устройство выравнивает ток скачкообразно.
Это происходит потому, что одно реле подключает/отключает определенное количество витков второй обмотки. Если сравнить электромеханический стабилизатор, то его щетка постепенно контактирует с большим количеством витков.
Иными словами она постепенно подключает промежуточные витки и останавливается на нужном витке. В релейных приборах от «Ресанта» все витки будто поделены на группы и от каждой из них отходит вывод. Собственно на этот вывод и подается ток при включении реле.
Электрическая схема каждого релейного стабилизатора напряжения от компании «Ресанта» предусматривает наличие четырех реле, а это означает, что количество выводов второй обмотки также равняется цифре четыре.
Исключение составляют модели серии СПН. Число реле равняется цифре пять.
Полезный совет: когда включается или отключается определенное реле, напряжение на выходе меняется на 15-20 вольт, то есть происходят минискачки напряжения. Эти минипрыжки хорошо заметны на лампах освещения.
Для большинства электроприборов они не являются страшными. Однако сложная электронная и измерительная техника требуют более плавной стабилизации тока. Это следует учитывать при использовании любого релейного стабилизатора.
Подытоживая выше сказанное, отметим, что весь процесс нормализации тока сопровождается постоянной работой реле. Собственно этот механический компонент и является самым слабым местом. При эксплуатации он может как сгореть, так и залипнуть.
Как ремонтировать реле?
В том случае, когда из строя выходят контакты реле, поломаться могут и транзисторные ключи. В зависимости от модели эти ключи могут собираться на разных транзисторах. Так, в модели СПН-9000 эти ключи собраны на основе транзисторов 2SD882.
В зависимости от модели эти ключи могут собираться на разных транзисторах. Так, в модели СПН-9000 эти ключи собраны на основе транзисторов 2SD882.
В основе транзисторных ключей модели АСН-5000/1-Ц (его схема приводится ниже) находятся транзисторы D882Р. Все эти транзисторы выпускает компания NEC.
Рис. 2. Схема стабилизатора АСН-5000/1-Ц.
В тех случаях, когда эти транзисторы и реле выходят из строя, их полностью заменяют. Такие запчасти для вышеупомянутых моделей стабилизаторов напряжения, выпускаемых компанией «Ресанта», можно найти во многих магазинах.
Также можно попробовать отреставрировать изношенные контакты реле. Данная процедура начинается со снимания крышки реле. Потом приступают к снятию подвижного контакта. Этот контакт нужно высвободить от пружины.
Далее берут наждачную бумагу «нулевку» и очищают этот контакт от всех нагоревших частиц. Такую же процедуру очистки нужно сделать и относительно верхнего и нижнего контактов.
В конце обрабатывают все контакты бензином «Галоша» и осуществляют сборку реле. Когда реле является собранным, следует проверить транзисторы 2SD882 или D882Р, или же другие (это зависит от модификации).
Когда реле является собранным, следует проверить транзисторы 2SD882 или D882Р, или же другие (это зависит от модификации).
Их выпаивают (нужно иметь паяльник) и осуществляют проверку целостности переходов. Если переходы не является целостными, нужно взять новые транзисторы.
Проведение диагностики
После окончания ремонтных работ необходимо провести диагностику работы стабилизационного прибора. Для этого используют ЛАТР, к которому подключают стабилизатор. Далее с помощью ЛАТРа изменяют напряжение и следят за работой стабилизационного устройства. В качестве нагрузки используется лампочка.
После проверки можно произвести подключение к общей сети. Если вы не знаете, как подключить релейный стабилизатор напряжения, сделанный в стенах компании «Ресанта», то стоит запомнить, что данная процедура является такой же, как и для электромеханического нормализатора. О ней мы уже писали.
Другие неисправности релейных приборов
JAKEC набор конденсаторов
Стоит отметить, что поломка реле может быть не единственной неисправностью, которая возникает в релейном нормализаторе от латвийской компании.
Внешним признаком этого дефекта являлось хаотическое отображение сегментов дисплея, которые включались. В это же время наблюдалась хаотическое включение реле.
Причина этого кроется в холодной пайке кварцевого резонатора ХТА1, который имеет рабочую частоту 8 мегагерц. Такая пайка вызывает неправильную работу микроконтроллера U2.
Для решения проблемы нужно выпаять этот резонатор, почистить его выводы с помощью нулевой наждачной бумаги, провести качественную подпайку и поставить обратно.
Специалисты также рекомендуют проверить электролитические конденсаторы, которые находятся на плате контроллера. Это необходимо сделать по той причине, что фирма использует конденсаторы от производителя JAKEC. Эти конденсаторы не характеризуются высоким качеством. Во время их проверки проводят измерение емкости и ESR.
Ресанта АСН 500 1ц — небольшая мощность — высокая надежность Мощный и надежный стабилизатор Ресанта СПН 14000 прослужит долго.
 Мощный и надежный стабилизатор Ресанта АСН 12000. Видео
Ресанта — надежные и безотказные стабилизаторы
Мощный и надежный стабилизатор Ресанта АСН 12000. Видео
Ресанта — надежные и безотказные стабилизаторыРемонт стабилизатора напряжения Ресанта своими руками
Причин этому может быть несколько — от неправильной эксплуатации до естественных причин поломки, т. е. продолжительного срока службы.
е. продолжительного срока службы.
Чтобы этого избежать, необходимо в точности следовать инструкции, которая прилагается в комплекте, позволяющая существенно продлить службу агрегата в правильном режиме работы. Если же все-таки поломка случилась, то нужно знать, какими методами нужно правильно осуществлять ремонт своими руками, чтобы еще больше не усугубить ситуацию. В данной статье мы рассмотрим основные неисправности, а также способы их своевременного устранения.
На данном видео показан стабилизатор Ресанта с неисправностью
Принцип работы
Конструктивное строение стабилизатора напряжения Ресанта выглядит следующим образом:
- трансформатор автоматического типа;
- электронный блок;
- вольтметр;
- орган управления, который ответственен за запуск и отключение некоторых обмоток.

Данным производителем выпускается множество различных типов стабилизаторов, поэтому и данные органы подключения обмоток будут разниться. О всех этих нюансах мы поговорим чуть позже, во время рассмотрения процедуры ремонта.
В данной конструкции определяющим является электронный блок, который осуществляет общее управление всей системой агрегата. Он ответственен за работу вольтметра, а также к нему поступают сведения о мощности входного напряжения. Затем, блок сравнивает полученные значения с оптимальными, определяя следующее действие, т.е. нужно ли добавить несколько вольт или, напротив, отнять некое количество.
Далее, по цепочке, идет определение необходимых обмоток — какие их них нужно запустить, а какие отключить. Затем, электронный блок осуществляет одно из этих действий, после чего все электрические приборы, находящиеся в квартире, получают стабильный ток.
Безусловно, сам процесс стабилизации может быть немного разным, в зависимости от типа выпускаемого устройства.
Данное различие распространяется на виды обмоток, а также методы их запуска и отключения. На сегодняшний день, компания Ресанта выпускает два вида данных стабилизаторов:
- Электромеханического типа.
- Релейные.
Соответственно, ремонт их будет несколько иным.
Особенности работы электромеханического стабилизатора
Начнем свое рассмотрение со стабилизаторов электромеханического типа. В его конструкции присутствует сервопривод, который и осуществляет запуск и отключение обмоток в устройстве.
Сам сервопривод состоит из двигателя, на котором располагается электрический контакт (щетка). При движении якоря данного мотора, соответственно, крутится и эта щетка, постоянно контактируя обмотками из меди. Ширина данной щетки позволяет осуществлять полный обхват всей обмотки, что позволяет фазе не пропадать.
Чтобы щетка двигалась в заданном направлении с нужными характеристиками, в устройстве возникает напряжение ошибки. Затем, данное значение напряжения растет. Далее оно передается к двигателю, что и заставляет якорь вращаться в оптимальном направлении. Соответственно, щетка также движется, как и якорь, в том же заданном направлении. При этом осуществляется непосредственный контакт с обмотками.
Далее оно передается к двигателю, что и заставляет якорь вращаться в оптимальном направлении. Соответственно, щетка также движется, как и якорь, в том же заданном направлении. При этом осуществляется непосредственный контакт с обмотками.
Значение напряжения ошибки будет пропорциональным тому значению, формируемое разницей между реальным вольтовым значением на входе и тем значением, которое должно там быть. Данный сигнал может обладать одной из двух полярностей, каждая из которых задает определенное направление движения. Ниже приведена схема подобного стабилизатора напряжения:
Вне зависимости от конкретной модели, строение данного стабилизатора напряжения будет практически одинаковым. Отличаются они между собой разными значениями мощности и отдельными элементами цепи.Особенности работы релейного стабилизатора
Все релейные стабилизаторы выравнивают значения тока путем скачков. Это объясняется тем, что реле осуществляет запуск или отключение витков, расположенных на второй обмотке. Электромеханический стабилизатор выполняет этот процесс более плавно, чем релейный.
Электромеханический стабилизатор выполняет этот процесс более плавно, чем релейный.
Релейные агрегаты от Ресанта осуществляют подключение витков до тех пор, пока не найдут нужный. Все эти витки условно разделены на подгруппы, при чем от каждого витка есть вывод, на который и поступает ток при запуске устройства.
Схема всех релейных стабилизаторов данной марки показывает, что в её конструкции присутствует порядка четырех элементов реле. В отдельных случаях, это количество может ровняться пяти (модели СПН).
В случае релейных стабилизаторов, именно реле является наиболее уязвимым местом всего устройства. Это обуславливается тем, что оно находится в постоянном рабочем режиме, что существенно увеличивает риски выхода из строя.
Основные неисправности
Рассмотрев принципы работы обоих типов стабилизаторов напряжения, можно сделать вывод о том, что именно их основные составляющие части и являются наиболее часто ломающимися компонентами системы. Речь идет о сервоприводе в электромеханических приборах, а также о реле в релейных.
Речь идет о сервоприводе в электромеханических приборах, а также о реле в релейных.
В первом случае, постоянное движение сервопривода приводит к периодическому трению витков катушки и щетки, что приводит к появлению излишнего перегрева данных комплектующих. Это также приводит к сильному износу и появлению искр от проводов меди.
Нужно также иметь в виду тот факт, что в сети периодически меняется значение тока, что провоцирует аналогичное изменение движения сервопривода. Подобная нестабильная работа может приводить к выходу из строя данного устройства.
Ремонт одной из неисправностей продемонстрирован на видео
Ремонт
Ремонт стабилизатора Ресанта можно условно разделить по типу поломок.
Сервопривод
Сначала рассмотрим ситуацию, когда вышел из строя двигатель сервопривода Ресанта. Выходов из данной проблемы два:
Выходов из данной проблемы два:
- Купить новый двигатель, затем установить его в устройство.
- Попытаться произвести ремонт поврежденного.
Если с первым случаем все понятно, то второй требует детального рассмотрения. Важно понимать, что в случае успешного проведения ремонтных работ, отреставрированный двигатель не сможет работать долгое время, т.е. это является временной мерой.
Все наши действия будут сводиться к следующему:
- Отключаем двигатель с сервоприводом от общей конструкции. Затем подключаем его к источнику питания, обладающему достаточной мощностью.
- Нужно осуществить подачу на выходы двигателя тока мощностью в 5 В. Показатель силы тока должен быть не менее 90 мА.
- Осуществление данных манипуляций позволит нормализовать работу стабилизатора. Далее нужно подключить двигатель обратно к схеме.
Схема довольно проста: входной кабель подключается к входной клемме, нейтральный кабель подключается к нейтральной клемме. Те же самые манипуляции выполняются и для выходных кабелей. Кроме того, нужно не забыть о подключении заземляющего провода.
Реле
Выход из строя реле зачастую приводит и к поломке транзисторов. К примеру, в модели АСН-5000, располагаются транзисторы вида D882P. Схема приведена ниже:
Если эти транзисторы выходят из строя, то нужно приобретать на их место новые. Приобрести их можно довольно свободно, ведь во многих специализированных магазинах продается техника и комплектующие марки Ресанта.
Можно также попытаться произвести ремонт поврежденных частей:
- Сначала нужно снять крышку реле. Далее снимаем подвижной контакт, освобождая его от пружины.
- При помощи наждачной бумаги счищаем с контакта весь нагар. Осуществляем данную манипуляции для обоих контактов — верхнего и нижнего.
- Затем смазываем контакты бензином, после чего собираем конструкцию реле.
Другие неисправности
Еще одной вероятной проблемой является неупорядоченное включение дисплея, а также включения самого реле. Причиной этому может быть резонатор XTA1, у которого может быть совершена некорректная пайка.
Ремонт заключается в следующем:
- Выпаиваем с помощью паяльника данный резонатор.
- C помощью наждачной бумаги счищаем выводы.
- Запаиваем резонатор обратно.
Рассказ специалиста про ремонт Ресанта
Диагностика
Для совершения диагностики, нам понадобится прибор ЛАТР, т.е. лабораторный автотрансформатор регулируемого типа. Осуществляем подключение стабилизатора к данному устройству, при помощи которого нужно менять значения напряжения. Параллельно следим за работой стабилизатора Ресанта.
Вывод
Осуществление ремонтных работ, в данном случае, может производиться в домашних условиях. При этом, предполагается, что человек, осуществляющий данные манипуляции, будет хорошо знаком с подобной техникой, обладать навыками правильной пайки и некоторых знаний в электронике. Если человек этим не обладает, то целесообразнее будет обратиться к специалистам.
Подобных сервисных центров довольно много по Москве и Санкт-Петербургу. В частности, «Демал-Сервис», находящийся по адресу: г.Москва, ул. 1-я Владимирская, дом 41.
В Санкт-Петербурге находится сервисный центр самой компании, находящийся по адресу: ул. Черняковского, дом 15.
Ремонт стабилизаторов напряжения Ресанта — особенности ремонта
Стабилизаторы напряжения «Ресанта» используются во многих домах для обеспечения стабильной работы и защиты «здоровья» электрических приборов. В результате домашняя техника работает в течение длительного времени и почти не подвергается ремонту.
Надо сказать, что самому стабилизатору напряжения тоже необходимо соблюдение условий эксплуатации и периодический уход. Иначе аппарат может выйти из строя и ему потребуется ремонт. Помимо этого, отслужив достаточно большой срок, прибор может поломаться просто по причине износа деталей.
Эта статья посвящена тонким местам стабилизаторов бренда «Ресанта». Рассмотрим, как ремонтируются вышедшие из строя детали, а также восстанавливается полная работоспособность прибора.
Степень сложности ремонта стабилизаторов напряжения
Все приборы стабилизации оснащены защитными функциями, с помощью которых контролируются технические показатели на соответствие заявленным данным и условиям эксплуатации. У каждой модели защитная система своя, но существуют общие понимания выхода за пределы допустимого, что не позволяет аппарату дальше работать.
Прежде всего, требуется:
- проверка на наличие КЗ, входного и выходного напряжения, температурного режима компонентов;
- изучение высвеченного на дисплее кода ошибки.
Наиболее трудно определить неисправность симисторных ключей прибора, так как их управление связано со знанием электроники. При ремонте не обойтись без принципиальной схемы, измерительных средств, в том числе осциллографа. По контрольным точкам снятых осциллограмм определяются повреждения в структурном модуле устройства. Затем предстоит проверка каждой радиодетали и узла на предмет дефекта.
В стабилизаторах релейного типа нередко причиной неполадок становится реле, предназначенное для переключения обмоток трансформатора. Частые переключения контактов реле приводят к их выгоранию, заклиниванию, или перегоранию самой катушки. Если пропадает напряжение либо выходит сообщение об ошибке – стоит проверить все реле.
Наиболее прост ремонт электромеханического стабилизатора, у которого работа и реакция на изменение параметров сети становятся очевидными сразу после снятия корпуса. Недаром простая конструкция и высокая точность стабилизации делают эти модели весьма распространенными.
Виды неисправностей стабилизаторов напряжения
Ремонт электромеханического типа
Распространенной проблемой таких приборов является перегрев. Поэтому раз в 2 месяца следует предавать устройство техническому обслуживанию. Важной частью ремонта считается именно чистка элементов.
Примером могут служить характерные поломки распространённого стабилизатора АСН-10000/1-ЭМ. Устройство состоит из трёх одинаковых частей — из трёх 1-фазных стабилизаторов, предназначенных для стабилизации только своей фазы. Сердцем аппарата является повышающий автотрансформатор. Он же вместе с контактором и вводным автоматом относится к силовой части.
Принципиальная схема АСН-10000/1-ЭМ приведена на рисунке ниже.
В основе принципа действия электромеханических выравнивателей лежит плавное регулирование выходных параметров. Напряжение изменяется благодаря скольжению электрического контакта по обмотке автотрансформатора посредством электрического привода. На оси электродвигателя крепится ползунок, который перемещаясь, нормализует выходные параметры.
Заслуживает особого внимания следующая характерная неисправность, возникающая в процессе эксплуатации электромеханических стабилизаторов и методы ее устранения – отсутствие стабилизации выходного напряжения.
Первый признак такой неполадки – может ощущаться запах тлеющих деталей. Реверсивный двигатель недаром зовут «ахиллесовой пятой» электромеханических приборов. Контроллером стабилизатора напряжения постоянно отслеживается значение выходных параметров. Ротор постоянно вращается и это постепенно изнашивает сам двигатель.
Одна неисправность может повлечь за собой другие, например, выход из строя целого каскада управления электродвигателем, собранного на паре транзисторов. Помимо этих элементов от перегрева плавятся резисторы, стоящие в их коллекторной цепи.
Конечно, изношенный электродвигатель лучше заменить, но бывает умелая попытка привести его в действие, венчается успехом. Это и есть самый простой способ реанимации двигателя:
- отключение двигателя от схемы;
- подача на его выводы 5 В от мощного источника питания, к примеру, от компьютерного БП ATX.
При этом получается отжиг мелкого «мусора» на щётках двигателя. Нормальный ток электропотребления движка должен не выходить за пределы 90–160 мА. Поскольку двигатель реверсивного типа, то напряжение необходимо подавать не менее двух раз со сменой полярности. После этих воздействий работоспособность агрегата временно восстанавливается.
Другой вариант решения проблемы – небольшая замена схемы с сужением диапазона регулировки. Просто щетка будет ездить по-другому, в обход выгоревших участков дорожки трансформатора.
Ремонт релейных стабилизаторов
В качестве примеров рассмотрим ремонт:
Ресанта АСН-500/1-ц.
Наиболее частыми ошибками являются сообщения «L» и «H», что означает начальные буквы английских слов «низкий» и «высокий». То есть показатели выходят за пределы допустимых параметров. На прежних релейных стабилизаторах Ресанта со стрелочными индикаторами можно было видеть изменение выходного напряжения в пределах 204–235 В при переключении ступеней. На нынешней аппаратуре по записи видно 220 В, а по факту те же +- 6%, согласно паспортным данным.
Случается проблема реле медленно переключается, что влияет на защитное отключение компрессора кондиционера. Дело в том, что производителем используются дешёвые конденсаторы весьма низкого качества. Если заменить электролиты – проблема будет решена.
Главное, не стоит забывать о мощности. То, что написано на шильдике корпуса, справедливо для входного напряжения 200 В, в реальности для заниженного (170–180 В) мощность должна быть в 2 раза меньше.
Ресанта СПН-9000.
В основе принципа действия этого релейного стабилизатора лежит ступенчатое регулирование выходного напряжения. Стабилизация обеспечивается посредством микропроцессора. Коммутация отводов автотрансформатора выполняется пятью мощными реле, которые управляются транзисторными ключами. Стабильность выходного напряжения зависит от дискретности переключения (5–20 В).
Основная болезнь СПН-9000 – обгоревшие либо залипшие контакты в реле. Эти неполадки довольно часто возникают в процессе эксплуатации релейного стабилизатора. А также при несоответствии входного напряжения диапазону пороговых значений стабилизация не станет работать. Бывает, сразу при включении прибора выбивает предохранители, так срабатывает защита от КЗ.
По причине неисправности реле «летят» транзисторные ключи. Реле подлежат замене или реставрации. Для этого необходимо убрать крышки с реле, после снять подвижный контакт, освободить его от пружины и наждачной бумагой аккуратно очистить все контакты реле. В завершение очистить все контакты специальным бензином и собрать реле в обратном порядке. Затем впаять все транзисторы, и проверить на целостность переходов. Если понадобится, заменить транзисторы на новые.
Заключение
Если вам нужно подключить к стабильнику предположим электрическую печь (9 кВт), то лучшего прибора, чем стабилизатор напряжения Ресанта для этого не найти. А если при этом возникнут мелкие недочеты, то сервисные мастерские быстро и профессионально устранят их на основании гарантийных обязательств. Своевременно сделанный ремонт – залог долговечности и надёжности прибора и после гарантийного срока.
Поломки бывают различные, и иногда сложно понять, то ли просто не соблюдены условия эксплуатации по инструкции, то ли аппарат неисправен. Однако, неполадки могут существовать, и в итоге в самый неподходящий момент может возникнуть проблема. Правильно установить «диагноз» и эффективно устранить их всегда поможет ремонтная компания.
На видео: простой ремонт стабилизатора РЕСАНТА 15 квт 3 фазы.
Асн 10000 1 ц схема электрическая
Ресанта 10000 1 ц схема
Ремонт стабилизаторов Ресанта — тонкости и рекомендации
Эта статья расскажет о таких вопросах:
- Основной принцип работы стабилизаторов «Ресанта».
- Особенности работы электромеханического прибора.
- Его основные неисправности.
- Ремонт сервопривода.
- Как работают релейные нормализаторы?
- Ремонт реле.
- Проведение диагностики отремонтированного стабилизатора.
- Другие неисправности релейных приборов.
В очень многих домах и квартирах используются те стабилизаторы напряжения, которые были сделаны в стенах компании «Ресанта». Благодаря использованию этих приборов владельцы обеспечивают стабильную работу и защищают «здоровье» всех своих домашних электроприборов.
В конечном итоге каждый домашний электроприбор работает в течение долгого времени и очень редко требует ремонта.
Хотим отметить, что стабилизатор также является домашним прибором, который требует надлежащего ухода и соблюдения необходимых условий эксплуатации. В противном случае стабилизатор напряжения, который выпустила компания «Ресанта», может выйти из строя и будет нуждаться в ремонте.
Кроме этого он может выходить из строя после долгих лет эксплуатации. Другими словами он также обладает способностью ломаться.
Смотря на эту способность, мы решили посвятить статью слабым местам стабилизаторов марки «Ресанта» и рассмотреть, каким образом можно отремонтировать поврежденные элементы, а также восстановить полную работоспособность этого востребованного устройства.
Но, сначала расскажем об общем строении и принципе работы устройств этой марки.
Принцип работы
Как и все стабилизаторы напряжения, так и нормализаторы марки «Ресанта» состоят из:
- автоматического трансформатора.
- электронного блока.
- вольтметра.
- элемента, который осуществляет подключение/отключение определенных обмоток.
Учитывая то, что производитель осуществляет выпуск различных видов стабилизаторов, элементы для подключения обмоток являются разными. О них мы отметим несколько ниже, а именно тогда, когда будем рассматривать особенности работы и ремонта каждого вида нормализатора от латвийского производителя.
Электронный блок любого стабилизатора компании «Ресанта» осуществляет управление всей работой устройства. Он управляет работой вольтметра и получает данные об уровне входного напряжения. Дальше он сравнивает это напряжение с нормированным и определяет, сколько вольт нужно добавить или отнять.
После этого определяется то, какие обмотки стабилизатора нужно подключить или же отключить. Когда известна эта информация электронный блок подключает/отключает необходимые обмотки с помощью реле или сервопривода и наши электроприборы получают нормализованный ток.
Такой принцип стабилизации тока присущ каждому стабилизатору напряжения от компании «Ресанта». Однако процесс стабилизации в различных моделях компании имеет отличия. Они обусловлены тем, что по-разному происходит подключение/отключение обмоток трансформатора.
В стенах компании выпускается два типа стабилизаторов:
- Электромеханические.
- Релейные.
И, конечно, ремонт каждого из них имеет свои особенности.
Особенности работы электромеханического прибора
Сначала мы рассмотрим электромеханический нормализатор. Устройство этого стабилизатора напряжения от компании «Ресанта» предусматривает наличие такого элемента как сервопривод. Собственно благодаря ему осуществляется переключение различных обмоток автоматического трансформатора.
Переключение этих обмоток осуществляется плавно и в результате обеспечивается точная регулировка напряжения на выходе.
Каким же образом происходит это плавная регулировка? Сервопривод представляет собой двигатель и щетку (электрический контакт), которая прикреплена к якорю двигателя. Когда этот якорь крутится, то движется и щетка. Она постоянно контактирует с медными обмотками трансформатора.
По сути дела она скользит по ним. Она имеет такую ширину, которая позволяет соединять две обмотки одновременно. В результате на выходе не пропадает фаза.
Для того, чтобы щетка двигалась в определенном направлении и на определенную величину, в нормализаторе создается напряжение ошибки. Далее благодаря операционному усилителю и транзисторному выходному каскаду (он представляет собой усилитель мощности) это напряжение усиливается.
После этого оно подается на двигатель и заставляет крутиться якорь в определенном направлении.
В таком направлении движется и щетка, которая контактирует с обмотками. Напряжение ошибки является пропорциональным величине, которая является разницей между количеством вольт на входе и необходимым количеством вольт.
Сигнал ошибки может иметь одну из двух полярностей и в результате каждая полярность заставляет ось двигателя крутиться в определенном направлении. Такими являются особенности работы электромеханического нормализатора.
Отметим, что очень многие люди покупают 10-киловольт-амперный электромеханический стабилизатор. Поэтому возможные неисправности и поломки этого типа стабилизатора напряжения от компании «Ресанта» будут рассмотрены на этой модели. Ниже приводится его электросхема.
Рис. 1. Электросхема стабилизатора АСН-10000/1-ЭМ.
Стоит обратить внимание на тот факт, что общее строение всех нормализаторов этого типа является похожим. Различия заключаются в отдельных элементах моделей с разными уровнями мощности.
Основные неисправности
Из вышеописанного принципа работы электромеханического стабилизатора становится понятно, что когда происходит изменение тока в электросети, происходит одновременное вращение якоря двигателя и движение графитовой щетки.
Постоянное движение сервопривода и является главной слабостью электромеханического устройства. Почему? Потому, что в результате трения щетки о витки катушки происходит чрезмерное нагревание как щетки, так и витков под ней.
Кроме этого, трение вызывает износ щетки и загрязнение медных проводов. Последняя причина обусловливает появление искр.
Учитывая тот факт, что в наших электролиниях ток меняется очень часто, то с такой же частотой происходит движение сервопривода. Такое частое вращение становится причиной выхода из строя самого двигателя.
Примечательной особенностью является то, что поломка двигателя вызывает выход из строя других деталей. Так, появляется вероятность выхода из строя выходного каскада управления двигателем.
Специалисты компании «Ресанта» собирают этот каскад на основе пары транзисторов Q2 TIP41C и Q1 TIP42C. Когда происходит сгорание этих транзисторов, то сгорают и резисторы R45 и R46.
Они являются составляющими коллекторной цепи вышеуказанных транзисторов. R45 и R46 характеризуются сопротивлением в 10 Ом и мощностью в 2 ватта.
Когда есть такие неисправности, то надо провести проверку линейного стабилизатора. Его латвийские специалисты собирают на базе стабилитрона DM4 и транзистора Q3 TIP41C.
Если все эти составляющие электросхемы стабилизатора напряжения электромеханического типа, изготовленного компанией «Ресанта», сгорели, то их в любом случае нужно купить и заменить.
Ремонт двигателя сервопривода
Когда сгорел сам двигатель, то есть два варианта:
- Покупка нового и его установка.
- Попытка реставрации старого двигателя.
Второй вариант дает возможность реанимировать двигатель собственными силами, однако, на не долгое время. Для реанимации нужно произвести отключение двигателя от общей схемы. После этого его нужно подключить к мощному источнику питания.
Вашей задачей является подача на его выходы тока с постоянным напряжением в 5 вольт. Ток при этом должен иметь силу от 90 до 160 мА. При подаче такого тока на щетках двигателя сгорает каждая мелкая частица «мусора».
Полезный совет: поскольку двигатель относится к реверсивному типу, то при подаче напряжения нужно менять полярность. Эта процедура проводится два раза.
После таких действий двигатель сможет снова работать, и стабилизатор будет выполнять свою основную функцию. Далее по несложной схеме можно проводить процедуру подключения стабилизатора напряжения, выпущенного компанией «Ресанта».
Эта схема предусматривает подключение входного фазного и нейтрального кабелей к входной фазной и нейтральной клеммам соответственно. Аналогичным является подключение выходных проводов. Также обязательно подключают заземляющий провод.
Как работают релейные стабилизаторы?
Что касается релейных стабилизаторов от латвийской компании, то во время их эксплуатации возникают другие неисправности. Соответственно, их ремонт представляет собой иную процедуру.
Перед тем, как рассмотреть особенности ремонта релейного нормализатора «Ресанта», обратим внимание на особенности его работы. Релейное устройство выравнивает ток скачкообразно.
Это происходит потому, что одно реле подключает/отключает определенное количество витков второй обмотки. Если сравнить электромеханический стабилизатор, то его щетка постепенно контактирует с большим количеством витков.
Иными словами она постепенно подключает промежуточные витки и останавливается на нужном витке. В релейных приборах от «Ресанта» все витки будто поделены на группы и от каждой из них отходит вывод. Собственно на этот вывод и подается ток при включении реле.
Электрическая схема каждого релейного стабилизатора напряжения от компании «Ресанта» предусматривает наличие четырех реле, а это означает, что количество выводов второй обмотки также равняется цифре четыре.
Исключение составляют модели серии СПН. Число реле равняется цифре пять.
Полезный совет: когда включается или отключается определенное реле, напряжение на выходе меняется на 15-20 вольт, то есть происходят минискачки напряжения. Эти минипрыжки хорошо заметны на лампах освещения.
Для большинства электроприборов они не являются страшными. Однако сложная электронная и измерительная техника требуют более плавной стабилизации тока. Это следует учитывать при использовании любого релейного стабилизатора.
Подытоживая выше сказанное, отметим, что весь процесс нормализации тока сопровождается постоянной работой реле. Собственно этот механический компонент и является самым слабым местом. При эксплуатации он может как сгореть, так и залипнуть.
Как ремонтировать реле?
В том случае, когда из строя выходят контакты реле, поломаться могут и транзисторные ключи. В зависимости от модели эти ключи могут собираться на разных транзисторах. Так, в модели СПН-9000 эти ключи собраны на основе транзисторов 2SD882.
В основе транзисторных ключей модели АСН-5000/1-Ц (его схема приводится ниже) находятся транзисторы D882Р. Все эти транзисторы выпускает компания NEC.
Рис. 2. Схема стабилизатора АСН-5000/1-Ц.
В тех случаях, когда эти транзисторы и реле выходят из строя, их полностью заменяют. Такие запчасти для вышеупомянутых моделей стабилизаторов напряжения, выпускаемых компанией «Ресанта», можно найти во многих магазинах.
Также можно попробовать отреставрировать изношенные контакты реле. Данная процедура начинается со снимания крышки реле. Потом приступают к снятию подвижного контакта. Этот контакт нужно высвободить от пружины.
Далее берут наждачную бумагу «нулевку» и очищают этот контакт от всех нагоревших частиц. Такую же процедуру очистки нужно сделать и относительно верхнего и нижнего контактов.
В конце обрабатывают все контакты бензином «Галоша» и осуществляют сборку реле. Когда реле является собранным, следует проверить транзисторы 2SD882 или D882Р, или же другие (это зависит от модификации).
Их выпаивают (нужно иметь паяльник) и осуществляют проверку целостности переходов. Если переходы не является целостными, нужно взять новые транзисторы.
Проведение диагностики
После окончания ремонтных работ необходимо провести диагностику работы стабилизационного прибора. Для этого используют ЛАТР, к которому подключают стабилизатор. Далее с помощью ЛАТРа изменяют напряжение и следят за работой стабилизационного устройства. В качестве нагрузки используется лампочка.
После проверки можно произвести подключение к общей сети. Если вы не знаете, как подключить релейный стабилизатор напряжения, сделанный в стенах компании «Ресанта», то стоит запомнить, что данная процедура является такой же, как и для электромеханического нормализатора. О ней мы уже писали.
Другие неисправности релейных приборов
JAKEC набор конденсаторов
Стоит отметить, что поломка реле может быть не единственной неисправностью, которая возникает в релейном нормализаторе от латвийской компании. В некоторых случаях в стабилизаторе СПН-9000 наблюдался периодический дефект.
Внешним признаком этого дефекта являлось хаотическое отображение сегментов дисплея, которые включались. В это же время наблюдалась хаотическое включение реле.
Причина этого кроется в холодной пайке кварцевого резонатора ХТА1, который имеет рабочую частоту 8 мегагерц. Такая пайка вызывает неправильную работу микроконтроллера U2.
Для решения проблемы нужно выпаять этот резонатор, почистить его выводы с помощью нулевой наждачной бумаги, провести качественную подпайку и поставить обратно.
Специалисты также рекомендуют проверить электролитические конденсаторы, которые находятся на плате контроллера. Это необходимо сделать по той причине, что фирма использует конденсаторы от производителя JAKEC. Эти конденсаторы не характеризуются высоким качеством. Во время их проверки проводят измерение емкости и ESR.
Похожие записи Ресанта АСН 500 1ц — небольшая мощность — высокая надежность Стабилизаторы Ресанта, мощностью 3000 Вт Мощный и надежный стабилизатор Ресанта АСН 12000. Видео Ресанта 5000 вт, характеристики, внешний вид, применение. Видео
Источник: http://electricadom.com/remont-stabilizatorov-resanta-tonkosti-i-rekomendacii.html
Принципиальная Схема Ресанта Асн 10000
Я бы не стал ремонтировать реле вообще. Зная характерные неисправности стабилизатора напряжения Ресанта , можно с легкостью восстановить работоспособность выпрямителя, сократив расходы на ремонт оборудования.
В дальнейшем этот негативный эффект будет лавинообразно увеличиваться, и если не принять меры, достигнет необратимых пределов, когда чистка уже не поможет. Пускатель контрольной цепи Этот пускатель необходим для защиты отключения стабилизатора и нагрузки в случае неготовности, неисправности или перегрева.
Итак, как я уже говорил в предыдущей статье про трехфазные стабилизаторы, трехфазный стабилизатор — это три однофазных. Все наши действия будут сводиться к следующему: Отключаем двигатель с сервоприводом от общей конструкции.
ПЛАТА СТАБИЛИЗАТОРА НАПРЯЖЕНИЯ ЭЛИМ-УКРАИНА (универсальная)
Потом мотать либо изолентой, либо размыкать обмотку и одевать термоусадку.
Также причиной поломки электрических выпрямителей может стать эксплуатация в условиях повышенной влажности. Вашей задачей является подача на его выходы тока с постоянным напряжением в 5 вольт.
Коммутация отводов автотрансформатора производится скачкообразно с помощью мощных электрических реле, управляемых транзисторными ключами.
Но, сначала расскажем об общем строении и принципе работы устройств этой марки.
После вскрытия корпуса, можно было услышать, что трансформатор жужжит. То, что написано на шильдике корпуса, справедливо для входного напряжения В, в реальности для заниженного — В мощность должна быть в 2 раза меньше.
Стабилизатор напряжения Ресанта АСН 10000
Сайт Мастеров
Сильное загрязнение контактирующих витков автотрансформатора Таким образом, ускорение загрязнения набирает лавинообразный характер, что приводит к быстрому износу контактов автотрансформатора и выгоранию контактной щетки, после чего стабилизатор перестанет выдавать напряжение. Стало быть, проблема не в силовой части, а в цепях управления.
Но по неисправностям и ремонту — в конце статьи. И, конечно, ремонт каждого из них имеет свои особенности.
На прежних релейных стабилизаторах Ресанта со стрелочными индикаторами можно было видеть изменение выходного напряжения в пределах — В при переключении ступеней. Рассмотрим устройство стабилизатора на следующей фотографии: Устройство стабилизатора с пояснениями Первое, что надо усвоить — автотрансформатор состоит из двух равноценных частей, соединенных параллельно для увеличения мощности.
Схема электрическая стабилизатора напряжения Ресанта-АСНэм Для удобства восприятия я отметил на схеме основные структурные части.
Конструкция выпрямителей Ресанта включает следующие элементы: Электронный блок.
Понятно, что из-за этого не будет нормально работать U2 маркировка заклеена этикеткой.
Обмотки трансформатора намотаны все тем же алюминиевым проводом. И это — после промывки спиртом.
Самый важный совет при покупке стабилизатора напряжения
Читайте дополнительно: Петля фаза ноль что это
Принцип работы
Постоянное движение сервопривода и является главной слабостью электромеханического устройства.
Ну это не суть.
На конце хода щёток, соответствующему наименьшему напряжению В установлены концевые выключатели, останавливающие двигатель. В это же время наблюдалась хаотическое включение реле. Разница в цене с Самсунговскими — копеечная, а вот из-за одной такой детали ломаются и телевизоры, и стиралки и утюги.
Привод включает маломощный двигатель, на котором располагается щётка контакта. Схема электрическая стабилизатора напряжения Ресанта-АСНэм Для удобства восприятия я отметил на схеме основные структурные части. Соответственно, ремонт их будет несколько иным. Если понадобится, заменить транзисторы на новые.
О них мы отметим несколько ниже, а именно тогда, когда будем рассматривать особенности работы и ремонта каждого вида нормализатора от латвийского производителя. Ремонт электромеханических стабилизаторов напряжения Самая главная проблема таких стабилизаторов — перегрев. Поскольку щётка — это контакт, причём довольно плохой, то она греется.
Об этой проблеме я также пишу к дому через АВР. Также на плате был обнаружен операционный усилитель HA от Hitachi Semiconductor.
Оба стабилизатора отличаются принципом работы, имеют свои сильные и слабые стороны. Чистить надо по ходу щётки, потом промыть тщательно спиртом и вытереть насухо чистой тряпкой. Если напряжение понижается и дальше, то автотрансформатор уже не справляется, и весь стабилизатор отключается. Подобная нестабильная работа может приводить к выходу из строя данного устройства.
В завершение очистить все контакты специальным бензином и собрать реле в обратном порядке. При нормальной работе при включении стабилизатора можно услышать, как собирается КЦ — примерно через 10 секунд щелчок на одной из электронных плат , потом ещё один, и третий щелчок запускает контактор и весь стабилизатор. Стоит обратить внимание на тот факт, что общее строение всех нормализаторов этого типа является похожим.
Стабилизатор напряжения для дома и tokzamer.ru АСН-5000/1Ц
Добро пожаловать в блог сисадмина-паяльщика
Из этой толщины вычтем изоляцию 0,1 мм, и у нас остается 1,1 мм.
Итак, как я уже говорил в предыдущей статье про трехфазные стабилизаторы, трехфазный стабилизатор — это три однофазных.
В конечном итоге каждый домашний электроприбор работает в течение долгого времени и очень редко требует ремонта. Электронная плата Что же заставляет двигаться двигатель автотрансформатора? Даташит документацию на транзисторы можно скачать в конце статьи.
Эти конденсаторы не характеризуются высоким качеством. Сам сервопривод состоит из двигателя, на котором располагается электрический контакт щетка.
Ремонт электромеханического стабилизатора АСН-10000/1-ЭМ
Сильное загрязнение контактирующих витков автотрансформатора Таким образом, ускорение загрязнения набирает лавинообразный характер, что приводит к быстрому износу контактов автотрансформатора и выгоранию контактной щетки, после чего стабилизатор перестанет выдавать напряжение. Сердцем аппарата является повышающий автотрансформатор.
Так, появляется вероятность выхода из строя выходного каскада управления двигателем. В его конструкции присутствует сервопривод, который и осуществляет запуск и отключение обмоток в устройстве. С чего вдруг ему снесло голову…….
Рекомендую статьи по теме:
Ремонт стабилизаторов Ресанта может выполняться как в домашних условиях, так и в специализированной мастерской. Попытаться произвести ремонт поврежденного. Кроме этих транзисторов от перегрева выгорают резисторы R45 и R46, включенные в их коллекторную цепь. В электросетях, где отмечаются частые скачки напряжения, электродвигатель может сломаться уже через год после начала использования оборудования. Что такое контрольная цепь, её отличие от аварийной и тепловой цепей, и почему ремонт любой серьезной автоматики надо начинать с проверки контрольной цепи — подробно расписано , очень рекомендую, если дочитали до этого места Второе — отсутствие вентилятора охлаждения, в данном случае охлаждение естественное.
Осуществляем данную манипуляции для обоих контактов — верхнего и нижнего. Нужно осуществить подачу на выходы двигателя тока мощностью в 5 В. Это происходит за счет размыкания контактов реле KL см.
Стабилизатор напряжения. Ресанта, отзыв пользователя.
Стабилизатор напряжения однофазный Ресанта АСН-3000/1-Ц
Стабилизатор напряжения однофазный Ресанта АСН-3000/1-Ц.
Устройство, принцип работы, индикация, установка и подключение однофазных стабилизаторов напряжения Ресанта.
| Стабилизатор конструктивно выполнен в металлическом корпусе. | Внутри корпуса находится мощный трансформатор и силовые реле с блоком управления. | Принцип дейсвия — релейный. При помощи мощных реле коммутируются обмотки трансформатора в заданной блоком управления последовательности. | По цифровым вольтметрам можно контролировать напряжение на входе и на выходе одновременно. |
|
Области применения стабилизаторов Ресанта АСН-3000/1-Ц релейного типа. |
|
| Рекомендуется для питания | НЕ рекомендуется для питания |
| Насосы, холодильное оборудование, электродвигатели, электронагреватели, стиральные машины, освещение лампами накаливания, микроволновые печи, электроплиты и чайники. | Компьютеры, ЖК телевизоры и аудио-видео техника, точные электронные приборы, медицинская техника. Для питания этих приборов используйте стабилизаторы с погрешностью 1,5-2% и высокой скоростью реакции. |
| Преимущества | Недостатки |
|
|
Технические характеристики стабилизаторов напряжения Ресанта АСН-12000/1-Ц .
| Допустимая мощность нагрузки по фазе не должна превышать (при входном напряжении более 190 Вольт) | 3000 Вт | |
| ПРИ ВХОДНОМ НАПРЯЖЕНИИ МЕНЕЕ 190 ВОЛЬТ РАСЧИТЫВАЙТЕ МАКСИМАЛЬНУЮ НАГРУЗКУ НА СТАБИЛИЗАТОР, ИСХОДЯ ИЗ ПРИВЕДЕННОГО НИЖЕ ГРАФИКА! | <3000Вт |
| параметр | значение |
| Рабочий диапазон входного напряжения | 140-260 В |
| Нижний порог срабатывания защитного отключения нагрузки | 131 В |
| Верхний порог срабатывания защитного отключения нагрузки | 265 В |
| Режим работы | непрерывный |
| Условия эксплуатации по температуре | +5-+40 С |
| Условия эксплуатации по влажности | не более 80% |
| При транспортировке стабилизатора напряжения избегайте жесткой тряски и резких ударов . |
Управление,контроль и монтаж стабилизатора напряжения Ресанта АСН-3000/1-Ц.
| Индикация |
На передней панели стабилизатора трехразрядные индикаторы. позволяющие контролировать в режиме реального времени напряжение входа и выхода. Три светодиодных индикатора показывают состояние стабилизатора:
|
|
|---|---|---|
| Управление |
На передней панели стабилизатора расположен блок автоматических выключателей и выключатель режима «БАЙПАС». Кнопка переключения контроля входного и выходного напряжения. |
|
| Подключение |
Подключение стабилизатора производится с помощью клеммной колодки, расположенной внизу устройства. |
|
| Техническое обслуживание | Для надежной и долговечной работы релейного стабилизатора напряжения необходимо обеспечить щедящий режим работы и не перегружать особенно в периоды сильно пониженного напряжения. Со временем контакты реле износятся и их надо заменить. Производится в официальном сервис-центре РЕСАНТА. |
сервисный центр стабилизаторов РЕСАНТА Адрес: Москва, Внутренний пр-д. д 8. |
Краткие рекомендации к выбору стабилизатора по мощности.
Для покупки стабилизатора напряжения оптимальной мощности необходимо замерить входное напряжение Вашей электросети. (найти его МИНИМАЛЬНОЕ значение в течении суток).Это значение можно получить с помощью тестера напряжения или токосъемных клещей. Далее по графику, приведенному ниже определяем коэфициент понижения номинальной мощности стабилизации.
Пример: входное напряжение достигает 170 В. коэфициент — 0.7
Вы не ошибетесь, выбрав стабилизатор с «запасом» по мощности на случай появления у Вас новых электроприборов и обеспечения «щедящего» режима работы стабилизатора. Который ответит Вам своей надежной и долгой службой!
Подробнее о правильном выборе стабилизатора напряжения можно прочитать в статьях
| Может ли работать стабилизатор при температуре ниже минус 5 градусов. | Да может! НО ровно столько времени, за которое обмотка трансформатора нагреется, на ней образуется конденсат и произойдет межвитковое замыкание. Как правило это минут 5-10 от момента включения. |
| Что делать в выше указанном случае? | Перевести стабилизатор в режим «БАЙПАС», нагреть помещение, где находится аппарат и затем переключится в штатный режим. |
<
Заказывайте Стабилизатор напряжения Ресанта АСН 3000/1 Ц по доступным ценам, 49615310
Стабилизатор напряжения перманентного тока Ресанта АСН 3000/1 Ц
Стабилизатор напряжения Ресанта АСН 3000/1 Ц применяется для стабильного обеспечения электропитания разнообразных бытовых приборов в условиях нестабильного напряжения электросети. В изделии предусмотрена защита от перегрева, короткого замыкания, помех, резких скачков напряжения.
Важная информация о товаре
Почему стоит сделать выбор в нашу пользу?
1 | Мы предлагаем своим клиентам демократичные цены на товар. |
2 | Все наше оборудование отвечает установленным стандартам качества. |
3 | При необходимости квалифицированные менеджеры подберут оборудование, которое оптимально подходит под вашу задачу и полностью соответствует вашему запросу. |
4 | Гарантируем бесплатную доставку по РК. |
Приобрести стабилизатор напряжения Ресанта АСН 3000/1 Ц по максимально выгодной стоимости вы с легкостью можете в нашем интернет-магазине. При отгрузке и отправке каждое наше оборудование проверяется на отсутствие дефектов, наличие полной комплектации.
Схема заказа Стабилизатора напряжения Ресанта АСН 3000/1 Ц
Оформить заказ на сайте или по телефону
Консультация менеджера и согласование всех нюансов
Оплата удобным способом
Доставка выбранным способом
| Дополнительные характеристики | |
|---|---|
| Товар сертифицирован | Да |
| Гарантия | 1 год |
| Вес в упаковке | 9.7 кг |
| Вес без упаковки | 8.7 кг |
| Страна производства | Китай |
| Габариты, см | 34 х 23 х 22 |
| Страна бренда | Латвия |
| Комплектация | Стабилизатор напряжения РЕСАНТА Инструкция Упаковка |
| Технические характеристики | |
|---|---|
| Тип | Релейный |
| Мощность | 3000 Вт |
| Напряжение сети | 220 В |
| Тип входного напряжения | Однофазный (220 В) |
| Размещение | Напольное |
| Охлаждение | Естественное |
| Класс защиты | IP20 |
| Питание | От электросети |
| Выходное напряжение | 202 — 238 В |
| Габариты, см | 34 х 23 х 22 |
| Высоковольтная защита | 240 — 250 В |
| Вес без упаковки | 8.7 кг |
| Страна бренда | Латвия |
| Точность стабилизации | 8 % |
| Скорость стабилизации | 35 В/с |
| Частота | 50 Гц |
| Рабочая температура | 0 — 45 °C |
| Возможности | цифровая индикация (вольтметр отображает входное и выходное напряжения) |
| КПД | 97 % |
| Страна производства | Китай |
| Влажность воздуха | 80 % |
| Штрихкод EAN-13 | 4607076037679 |
| Входное напряжение | 140 — 260 В |
| Максимальный потребляемый ток | 15.8 А |
| Серия | АСН |
| Комплектация | Стабилизатор напряжения РЕСАНТА Инструкция Упаковка |
| Штрихкод GTIN | 04607076037679 |
| Время отклика | 7 мс |
| Защита | от короткого замыкания, от перегрева, от повышенного напряжения, от помех |
| Вес в упаковке | 9.7 кг |
Купить
% PDF-1.3 % 305 0 объект > эндобдж xref 305 2360 0000000016 00000 н. 0000047475 00000 п. 0000047594 00000 п. 0000051388 00000 п. 0000051772 00000 п. 0000051855 00000 п. 0000052031 00000 п. 0000052180 00000 п. 0000052267 00000 п. 0000052333 00000 п. 0000052419 00000 п. 0000052474 00000 п. 0000052577 00000 п. 0000052625 00000 п. 0000052680 00000 п. 0000052789 00000 п. 0000052844 00000 п. 0000052954 00000 п. 0000053009 00000 п. 0000053112 00000 п. 0000053167 00000 п. 0000053358 00000 п. 0000053522 00000 п. 0000053577 00000 п. 0000053760 00000 п. 0000053849 00000 п. 0000053904 00000 п. 0000054049 00000 п. 0000054226 00000 п. 0000054274 00000 п. 0000054446 00000 п. 0000054592 00000 п. 0000054647 00000 п. 0000054757 00000 п. 0000054882 00000 п. 0000054930 00000 п. 0000055104 00000 п. 0000055237 00000 п. 0000055285 00000 п. 0000055479 00000 п. 0000055617 00000 п. 0000055720 00000 п. 0000055768 00000 п. 0000055944 00000 п. 0000056049 00000 п. 0000056182 00000 п. 0000056230 00000 п. 0000056361 00000 п. 0000056416 00000 п. 0000056535 00000 п. 0000056583 00000 п. 0000056735 00000 п. 0000056871 00000 п. 0000056919 00000 п. 0000057043 00000 п. 0000057140 00000 п. 0000057188 00000 п. 0000057367 00000 п. 0000057479 00000 п. 0000057612 00000 п. 0000057660 00000 п. 0000057866 00000 п. 0000057986 00000 п. 0000058079 00000 п. 0000058127 00000 п. 0000058237 00000 п. 0000058285 00000 п. 0000058373 00000 п. 0000058421 00000 п. 0000058593 00000 п. 0000058741 00000 п. 0000058789 00000 п. 0000058886 00000 п. 0000058934 00000 п. 0000059092 00000 п. 0000059190 00000 п. 0000059238 00000 п. 0000059286 00000 п. 0000059440 00000 п. 0000059488 00000 п. 0000059623 00000 п. 0000059671 00000 п. 0000059845 00000 п. 0000059893 00000 п. 0000059941 00000 н. 0000060077 00000 п. 0000060125 00000 п. 0000060300 00000 п. 0000060466 00000 п. 0000060514 00000 п. 0000060611 00000 п. 0000060659 00000 п. 0000060781 00000 п. 0000060893 00000 п. 0000061026 00000 п. 0000061074 00000 п. 0000061268 00000 п. 0000061363 00000 п. 0000061411 00000 п. 0000061459 00000 п. 0000061626 00000 п. 0000061674 00000 п. 0000061722 00000 п. 0000061840 00000 п. 0000061928 00000 п. 0000061976 00000 п. 0000062195 00000 п. 0000062367 00000 п. 0000062459 00000 п. 0000062507 00000 п. 0000062674 00000 п. 0000062722 00000 н. 0000062815 00000 п. 0000062863 00000 п. 0000063012 00000 п. 0000063107 00000 п. 0000063155 00000 п. 0000063267 00000 п. 0000063315 00000 п. 0000063479 00000 п. 0000063587 00000 п. 0000063635 00000 п. 0000063683 00000 п. 0000063799 00000 п. 0000063894 00000 п. 0000063942 00000 н. 0000064057 00000 п. 0000064159 00000 п. 0000064252 00000 п. 0000064300 00000 п. 0000064457 00000 п. 0000064617 00000 п. 0000064712 00000 п. 0000064760 00000 п. 0000064886 00000 п. 0000064934 00000 п. 0000064982 00000 п. 0000065142 00000 п. 0000065190 00000 п. 0000065287 00000 п. 0000065335 00000 п. 0000065510 00000 п. 0000065628 00000 п. 0000065761 00000 п. 0000065809 00000 п. 0000065973 00000 п. 0000066085 00000 п. 0000066133 00000 п. 0000066228 00000 п. 0000066276 00000 п. 0000066431 00000 н. 0000066539 00000 п. 0000066587 00000 п. 0000066757 00000 п. 0000066805 00000 п. 0000066959 00000 п. 0000067049 00000 п. 0000067097 00000 п. 0000067312 00000 п. 0000067509 00000 п. 0000067615 00000 п. 0000067663 00000 п. 0000067765 00000 п. 0000067813 00000 п. 0000067921 00000 п. 0000067969 00000 п. 0000068070 00000 п. 0000068118 00000 п. 0000068211 00000 п. 0000068259 00000 п. 0000068406 00000 п. 0000068454 00000 п. 0000068502 00000 п. 0000068622 00000 п. 0000068745 00000 п. 0000068793 00000 п. 0000068970 00000 п. 0000069096 00000 н. 0000069144 00000 п. 0000069192 00000 п. 0000069307 00000 п. 0000069355 00000 п. 0000069403 00000 п. 0000069544 00000 п. 0000069592 00000 п. 0000069640 00000 п. 0000069802 00000 п. 0000069895 00000 п. 0000069943 00000 н. 0000070114 00000 п. 0000070220 00000 п. 0000070315 00000 п. 0000070363 00000 п. 0000070467 00000 п. 0000070515 00000 п. 0000070625 00000 п. 0000070673 00000 п. 0000070766 00000 п. 0000070814 00000 п. 0000070980 00000 п. 0000071130 00000 п. 0000071178 00000 п. 0000071305 00000 п. 0000071398 00000 п. 0000071446 00000 п. 0000071621 00000 п. 0000071731 00000 п. 0000071779 00000 п. 0000071876 00000 п. 0000071924 00000 п. 0000072083 00000 п. 0000072191 00000 п. 0000072324 00000 п. 0000072372 00000 п. 0000072554 00000 п. 0000072728 00000 п. 0000072776 00000 п. 0000072824 00000 п. 0000072970 00000 п. 0000073078 00000 п. 0000073126 00000 п. 0000073282 00000 п. 0000073384 00000 п. 0000073432 00000 п. 0000073524 00000 п. 0000073572 00000 п. 0000073759 00000 п. 0000073950 00000 п. 0000074065 00000 п. 0000074113 00000 п. 0000074291 00000 п. 0000074453 00000 п. 0000074501 00000 п. 0000074681 00000 п. 0000074769 00000 п. 0000074817 00000 п. 0000075009 00000 п. 0000075138 00000 п. 0000075230 00000 п. 0000075278 00000 п. 0000075412 00000 п. 0000075460 00000 п. 0000075508 00000 п. 0000075556 00000 п. 0000075676 00000 п. 0000075724 00000 п. 0000075772 00000 п. 0000075899 00000 п. 0000075997 00000 п. 0000076045 00000 п. 0000076141 00000 п. 0000076189 00000 п. 0000076299 00000 п. 0000076347 00000 п. 0000076469 00000 п. 0000076562 00000 п. 0000076610 00000 п. 0000076801 00000 п. 0000076930 00000 п. 0000076978 00000 п. 0000077026 00000 п. 0000077074 00000 п. 0000077211 00000 п. 0000077259 00000 п. 0000077415 00000 п. 0000077566 00000 п. 0000077614 00000 п. 0000077762 00000 п. 0000077897 00000 п. 0000077945 00000 п. 0000078135 00000 п. 0000078285 00000 п. 0000078333 00000 п. 0000078381 00000 п. 0000078512 00000 п. 0000078560 00000 п. 0000078608 00000 п. 0000078718 00000 п. 0000078766 00000 п. 0000078859 00000 п. 0000078907 00000 п. 0000079062 00000 н. 0000079202 00000 п. 0000079309 00000 п. 0000079357 00000 п. 0000079462 00000 п. 0000079510 00000 п. 0000079630 00000 н. 0000079678 00000 п. 0000079846 00000 п. 0000079939 00000 п. 0000079987 00000 н. 0000080142 00000 п. 0000080245 00000 п. 0000080293 00000 п. 0000080341 00000 п. 0000080468 00000 п. 0000080573 00000 п. 0000080621 00000 п. 0000080783 00000 п. 0000080895 00000 п. 0000080943 00000 п. 0000081040 00000 п. 0000081088 00000 п. 0000081276 00000 п. 0000081388 00000 п. 0000081521 00000 п. 0000081569 00000 п. 0000081738 00000 п. 0000081829 00000 п. 0000081877 00000 п. 0000082055 00000 п. 0000082103 00000 п. 0000082234 00000 п. 0000082282 00000 п. 0000082396 00000 п. 0000082491 00000 п. 0000082539 00000 п. 0000082706 00000 п. 0000082813 00000 п. 0000082861 00000 п. 0000082909 00000 п. 0000083005 00000 п. 0000083053 00000 п. 0000083177 00000 п. 0000083271 00000 п. 0000083319 00000 п. 0000083459 00000 п. 0000083507 00000 п. 0000083669 00000 п. 0000083749 00000 п. 0000083797 00000 п. 0000083960 00000 п. 0000084054 00000 п. 0000084102 00000 п. 0000084210 00000 п. 0000084313 00000 п. 0000084361 00000 п. 0000084539 00000 п. 0000084646 00000 п. 0000084694 00000 п. 0000084836 00000 п. 0000084994 00000 п. 0000085042 00000 п. 0000085237 00000 п. 0000085357 00000 п. 0000085449 00000 п. 0000085497 00000 п. 0000085599 00000 п. 0000085647 00000 п. 0000085792 00000 п. 0000085840 00000 п. 0000085973 00000 п. 0000086021 00000 п. 0000086069 00000 п. 0000086185 00000 п. 0000086233 00000 п. 0000086348 00000 п. 0000086396 00000 п. 0000086444 00000 п. 0000086575 00000 п. 0000086623 00000 п. 0000086799 00000 н. 0000086847 00000 п. 0000086970 00000 п. 0000087077 00000 п. 0000087125 00000 п. 0000087263 00000 п. 0000087364 00000 п. 0000087412 00000 п. 0000087529 00000 п. 0000087577 00000 п. 0000087689 00000 п. 0000087784 00000 п. 0000087832 00000 п. 0000088004 00000 п. 0000088107 00000 п. 0000088204 00000 п. 0000088252 00000 п. 0000088356 00000 п. 0000088404 00000 п. 0000088521 00000 п. 0000088624 00000 п. 0000088672 00000 п. 0000088845 00000 п. 0000088981 00000 п. 0000089074 00000 н. 0000089122 00000 п. 0000089293 00000 п. 0000089460 00000 п. 0000089555 00000 п. 0000089603 00000 п. 0000089767 00000 п. 0000089815 00000 п. 0000089932 00000 н. 0000089980 00000 п. 00000 00000 н. 00000 00000 п. 00000
00000 п. 00000
00000 п. 00000
00000 п. 00000 00000 п. 00000 00000 п. 00000 00000 п. 00000 00000 н. 00000 00000 п. 00000 00000 п. 00000 00000 п. 00000 00000 п. 0000000000 п. 00000
00000 п. 00000
00000 п. 00000
00000 п. 00000 00000 п. 0000000000 п. 00000
00000 п. 0000000000 п. 00000 00000 п. 00000 00000 п. 00000
00000 н. 00001
00000 н. 00001
00000 н. 0000100000 н. 00001
00000 н. 00001
00000 н. 0000100000 н. 00001
00000 н. 00001 00000 н. 0000100000 н. 00001
00000 н. 0000100000 н. 00001
00000 н. 0000100000 н. 00001
00000 н. 00001
00000 н. 0000100000 н. 00001
00000 н. 0000100000 н. 00001
00000 н. 0000100000 н. 00001 00000 н. 00001 00000 н. 00001 00000 н. 0000194603 00000 н. 0000194652 00000 н. 0000194701 00000 н. 0000194750 00000 н. 0000194849 00000 н. 0000194898 00000 н. 0000195061 00000 н. 0000195196 00000 н. 0000195245 00000 н. 0000195377 00000 н. 0000195426 00000 н. 0000195539 00000 н. 0000195693 00000 н. 0000195742 00000 н. 0000195791 00000 н. 0000195932 00000 н. 0000195981 00000 п. 0000196137 00000 н. 0000196241 00000 н. 0000196290 00000 н. 0000196396 00000 н. 0000196445 00000 н. 0000196570 00000 н. 0000196619 00000 н. 0000196775 00000 н. 0000196824 00000 н. 0000196873 00000 н. 0000196922 00000 н. 0000196971 00000 н. 0000197111 00000 н. 0000197160 00000 н. 0000197300 00000 н. 0000197349 00000 н. 0000197479 00000 н. 0000197528 00000 н. 0000197651 00000 н. 0000197700 00000 н. 0000197838 00000 н. 0000197887 00000 н. 0000198002 00000 н. 0000198051 00000 н. 0000198100 00000 н. 0000198217 00000 н. 0000198266 00000 н. 0000198452 00000 н. 0000198501 00000 н. 0000198550 00000 н. 0000198690 00000 н. 0000198739 00000 н. 0000198788 00000 н. 0000198914 00000 н. 0000199013 00000 н. 0000199062 00000 н. 0000199203 00000 н. 0000199313 00000 н. 0000199362 00000 н. 0000199411 00000 н. 0000199547 00000 н. 0000199596 00000 н. 0000199645 00000 н. 0000199808 00000 н. 0000199857 00000 н. 0000200020 00000 н. 0000200126 00000 н. 0000200175 00000 н. 0000200294 00000 н. 0000200395 00000 н. 0000200444 00000 н. 0000200493 00000 п. 0000200612 00000 н. 0000200661 00000 п. 0000200786 00000 н. 0000200835 00000 н. 0000200960 00000 н. 0000201058 00000 н. 0000201107 00000 н. 0000201261 00000 н. 0000201392 00000 н. 0000201441 00000 н. 0000201561 00000 н. 0000201610 00000 н. 0000201751 00000 н. 0000201800 00000 н. 0000201849 00000 н. 0000201969 00000 н. 0000202018 00000 н. 0000202175 00000 н. 0000202224 00000 н. 0000202368 00000 н. 0000202417 00000 н. 0000202466 00000 н. 0000202631 00000 н. 0000202680 00000 н. 0000202729 00000 н. 0000202778 00000 н. 0000202827 00000 н. 0000202876 00000 н. 0000203001 00000 н. 0000203050 00000 н. 0000203228 00000 н. 0000203277 00000 н. 0000203326 00000 н. 0000203449 00000 н. 0000203498 00000 н. 0000203547 00000 н. 0000203668 00000 н. 0000203767 00000 н. 0000203816 00000 н. 0000203975 00000 н. 0000204081 00000 н. 0000204130 00000 н. 0000204179 00000 н. 0000204228 00000 н. 0000204363 00000 н. 0000204464 00000 н. 0000204513 00000 н. 0000204611 00000 н. 0000204660 00000 н. 0000204804 00000 н. 0000204853 00000 н. 0000204987 00000 н. 0000205036 00000 н. 0000205085 00000 н. 0000205134 00000 н. 0000205268 00000 н. 0000205371 00000 н. 0000205420 00000 н. 0000205526 00000 н. 0000205575 00000 н. 0000205724 00000 н. 0000205773 00000 н. 0000205822 00000 н. 0000205871 00000 н. 0000205980 00000 н. 0000206029 00000 н. 0000206152 00000 н. 0000206201 00000 н. 0000206250 00000 н. 0000206377 00000 н. 0000206477 00000 н. 0000206526 00000 н. 0000206669 00000 н. 0000206798 00000 н. 0000206847 00000 н. 0000206972 00000 н. 0000207021 00000 н. 0000207070 00000 н. 0000207215 00000 н. 0000207264 00000 н. 0000207389 00000 н. 0000207438 00000 н. 0000207487 00000 н. 0000207617 00000 н. 0000207666 00000 н. 0000207842 00000 н. 0000207971 00000 н. 0000208095 00000 н. 0000208144 00000 н. 0000208305 00000 н. 0000208410 00000 н. 0000208459 00000 н. 0000208583 00000 н. 0000208632 00000 н. 0000208774 00000 н. 0000208823 00000 н. 0000208872 00000 н. 0000208988 00000 н. 0000209037 00000 н. 0000209179 00000 н. 0000209228 00000 н. 0000209354 00000 н. 0000209403 00000 н. 0000209536 00000 н. 0000209721 00000 н. 0000209770 00000 н. 0000209930 00000 н. 0000210099 00000 н. 0000210148 00000 н. 0000210197 00000 н. 0000210246 00000 п. 0000210295 00000 н. 0000210344 00000 п. 0000210393 00000 п. 0000210529 00000 н. 0000210578 00000 н. 0000210707 00000 н. 0000210756 00000 п. 0000210860 00000 н. 0000210909 00000 н. 0000211044 00000 н. 0000211149 00000 н. 0000211198 00000 н. 0000211247 00000 н. 0000211395 00000 н. 0000211444 00000 н. 0000211546 00000 н. 0000211595 00000 н. 0000211718 00000 н. 0000211767 00000 н. 0000211816 00000 н. 0000211865 00000 н. 0000211914 00000 н. 0000211963 00000 н. 0000212012 00000 н 0000212146 00000 н. 0000212195 00000 н. 0000212341 00000 п. 0000212390 00000 н. 0000212439 00000 н. 0000212488 00000 н. 0000212612 00000 н. 0000212661 00000 н. 0000212838 00000 н. 0000212887 00000 н. 0000213025 00000 н. 0000213074 00000 н. 0000213197 00000 н. 0000213246 00000 н. 0000213395 00000 н. 0000213444 00000 н. 0000213599 00000 н. 0000213648 00000 н. 0000213697 00000 н. 0000213825 00000 н. 0000213874 00000 н. 0000214034 00000 н. 0000214083 00000 н. 0000214256 00000 н. 0000214305 00000 н. 0000214451 00000 п. 0000214551 00000 п. 0000214600 00000 н. 0000214744 00000 н. 0000214793 00000 п. 0000214842 00000 н. 0000214942 00000 н. 0000214991 00000 н. 0000215133 00000 н. 0000215241 00000 н. 0000215290 00000 н. 0000215339 00000 н. 0000215388 00000 н. 0000215437 00000 н. 0000215568 00000 н. 0000215617 00000 н. 0000215666 00000 н. 0000215794 00000 н. 0000215843 00000 н. 0000215957 00000 н. 0000216067 00000 н. 0000216116 00000 н. 0000216250 00000 н. 0000216384 00000 н. 0000216482 00000 н. 0000216531 00000 н. 0000216689 00000 н. 0000216800 00000 н. 0000216900 00000 н. 0000216949 00000 н. 0000217076 00000 н. 0000217125 00000 н. 0000217259 00000 н. 0000217308 00000 n 0000217438 00000 n 0000217487 00000 n 0000217536 00000 n 0000217674 00000 n 0000217723 00000 n 0000217772 00000 n 0000217893 00000 n 0000217942 00000 n 0000218078 00000 n 0000218127 00000 n 0000218176 00000 n 0000218308 00000 n 0000218357 00000 n 0000218406 00000 n 0000218502 00000 n 0000218551 00000 n 0000218693 00000 n 0000218800 00000 n 0000218849 00000 n 0000218969 00000 n 0000219018 00000 n 0000219142 00000 n 0000219191 00000 n 0000219351 00000 n 0000219400 00000 n 0000219449 00000 н. 0000219571 00000 n 0000219620 00000 n 0000219771 00000 n 0000219820 00000 n 0000220027 00000 n 0000220146 00000 n 0000220195 00000 n 0000220244 00000 n 0000220370 00000 n 0000220419 00000 n 0000220468 00000 n 0000220517 00000 n 0000220693 00000 n 0000220742 00000 n 0000220791 00000 n 0000220912 00000 n 0000220961 00000 н. 0000221010 00000 n 0000221170 00000 n 0000221219 00000 n 0000221346 00000 n 0000221395 00000 n 0000221444 00000 n 0000221493 00000 n 0000221661 00000 n 0000221759 00000 n 0000221808 00000 n 0000222005 00000 n 0000222175 00000 n 0000222224 00000 n 0000222273 00000 n 0000222405 00000 n 0000222454 00000 n 0000222503 00000 n 0000222552 00000 n 0000222601 00000 n 0000222650 00000 n 0000222699 00000 n 0000222748 00000 n 0000222935 00000 n 0000222984 00000 n 0000223156 00000 n 0000223205 00000 н. 0000223342 00000 n 0000223391 00000 n 0000223440 00000 n 0000223489 00000 n 0000223602 00000 n 0000223651 00000 n 0000223788 00000 n 0000223837 00000 n 0000224006 00000 n 0000224109 00000 n 0000224158 00000 n 0000224295 00000 n 0000224400 00000 n 0000224499 00000 n 0000224548 00000 n 0000224755 00000 n 0000224883 00000 n 0000224932 00000 n 0000224981 00000 n 0000225136 00000 n 0000225236 00000 n 0000225285 00000 n 0000225468 00000 n 0000225587 00000 n 0000225636 00000 н. 0000225776 00000 n 0000225876 00000 n 0000225925 00000 n 0000226098 00000 n 0000226237 00000 n 0000226286 00000 n 0000226428 00000 n 0000226528 00000 n 0000226577 00000 n 0000226758 00000 n 0000226873 00000 n 0000226922 00000 n 0000227093 00000 n 0000227191 00000 n 0000227240 00000 n 0000227389 00000 n 0000227489 00000 n 0000227538 00000 n 0000227694 00000 n 0000227743 00000 n 0000227848 00000 n 0000227897 00000 n 0000228069 00000 n 0000228175 00000 n 0000228273 00000 n 0000228322 00000 n 0000228422 00000 n 0000228471 00000 n 0000228629 00000 n 0000228678 00000 n 0000228789 00000 n 0000228838 00000 n 0000228954 00000 n 0000229003 00000 n 0000229130 00000 n 0000229241 00000 n 0000229290 00000 n 0000229339 00000 n 0000229494 00000 n 0000229543 00000 n 0000229592 00000 n 0000229734 00000 n 0000229833 00000 n 0000229882 00000 н. 0000230076 00000 n 0000230196 00000 n 0000230245 00000 n 0000230294 00000 n 0000230425 00000 n 0000230474 00000 n 0000230602 00000 n 0000230651 00000 n 0000230700 00000 n 0000230749 00000 n 0000230881 00000 n 0000230930 00000 n 0000231055 00000 n 0000231104 00000 n 0000231219 00000 n 0000231330 00000 н. 0000231379 00000 n 0000231428 00000 n 0000231477 00000 n 0000231592 00000 n 0000231641 00000 n 0000231764 00000 n 0000231875 00000 n 0000231924 00000 n 0000232024 00000 n 0000232073 00000 н. 0000232212 00000 n 0000232261 00000 n 0000232310 00000 n 0000232359 00000 n 0000232527 00000 n 0000232576 00000 н. 0000232625 00000 n 0000232724 00000 n 0000232773 00000 n 0000232898 00000 n 0000233024 00000 n 0000233073 00000 n 0000233122 00000 n 0000233238 00000 n 0000233287 00000 n 0000233383 00000 n 0000233432 00000 n 0000233592 00000 n 0000233740 00000 n 0000233789 00000 n 0000233910 00000 n 0000233959 00000 n 0000234008 00000 n 0000234057 00000 n 0000234106 00000 n 0000234256 00000 n 0000234305 00000 n 0000234452 00000 n 0000234501 00000 n 0000234620 00000 n 0000234720 00000 n 0000234769 00000 n 0000234901 00000 n 0000234950 00000 n 0000234999 00000 n 0000235144 00000 n 0000235193 00000 n 0000235310 00000 n 0000235359 00000 n 0000235408 00000 n 0000235457 00000 n 0000235582 00000 n 0000235631 00000 n 0000235680 00000 n 0000235729 00000 n 0000235778 00000 н. 0000235827 00000 n 0000235987 00000 n 0000236036 00000 n 0000236085 00000 n 0000236134 00000 n 0000236183 00000 n 0000236348 00000 n 0000236397 00000 n 0000236446 00000 n 0000236562 00000 n 0000236611 00000 n 0000236729 00000 n 0000236826 00000 n 0000236875 00000 n 0000237031 00000 n 0000237126 00000 n 0000237224 00000 n 0000237273 00000 n 0000237408 00000 n 0000237457 00000 n 0000237573 00000 n 0000237622 00000 n 0000237755 00000 n 0000237804 00000 n 0000237853 00000 n 0000237902 00000 n 0000238059 00000 n 0000238108 00000 n 0000238157 00000 n 0000238206 00000 n 0000238255 00000 n 0000238304 00000 n 0000238404 00000 n 0000238453 00000 n 0000238568 00000 n 0000238617 00000 n 0000238737 00000 n 0000238786 00000 n 0000238916 00000 n 0000238965 00000 n 0000239062 00000 n 0000239111 00000 n 0000239265 00000 n 0000239425 00000 n 0000239474 00000 n 0000239523 00000 n 0000239645 00000 n 0000239694 00000 n 0000239743 00000 n 0000239864 00000 n 0000239913 00000 n 0000239962 00000 n 0000240011 00000 n 0000240137 00000 n 0000240186 00000 n 0000240235 00000 п. 0000240381 00000 n 0000240430 00000 n 0000240576 00000 n 0000240625 00000 n 0000240747 00000 n 0000240844 00000 n 0000240893 00000 n 0000241011 00000 n 0000241110 00000 n 0000241209 00000 n 0000241258 00000 n 0000241408 00000 n 0000241457 00000 n 0000241506 00000 n 0000241660 00000 n 0000241709 00000 n 0000241758 00000 n 0000241807 00000 n 0000241856 00000 n 0000241982 00000 n 0000242031 00000 n 0000242149 00000 n 0000242198 00000 n 0000242247 00000 n 0000242296 00000 n 0000242436 00000 н. 0000242485 00000 n 0000242534 00000 n 0000242663 00000 n 0000242712 00000 n 0000242886 00000 n 0000242935 00000 n 0000243059 00000 n 0000243108 00000 n 0000243157 00000 n 0000243278 00000 n 0000243377 00000 н. 0000243426 00000 n 0000243601 00000 n 0000243705 00000 n 0000243754 00000 n 0000243803 00000 n 0000243927 00000 n 0000243976 00000 n 0000244103 00000 n 0000244202 00000 n 0000244251 00000 n 0000244386 00000 n 0000244528 00000 n 0000244577 00000 n 0000244626 00000 n 0000244739 00000 n 0000244788 00000 n 0000244907 00000 n 0000244956 00000 n 0000245083 00000 n 0000245132 00000 n 0000245181 00000 n 0000245230 00000 n 0000245351 00000 n 0000245400 00000 n 0000245449 00000 н. 0000245568 00000 n 0000245617 00000 n 0000245740 00000 n 0000245789 00000 n 0000245910 00000 n 0000245959 00000 n 0000246083 00000 n 0000246132 00000 n 0000246181 00000 n 0000246306 00000 n 0000246355 00000 n 0000246477 00000 n 0000246526 00000 n 0000246641 00000 n 0000246690 00000 n 0000246811 00000 n 0000246860 00000 n 0000246981 00000 n 0000247030 00000 n 0000247151 00000 n 0000247200 00000 n 0000247323 00000 n 0000247372 00000 н. 0000247492 00000 n 0000247541 00000 н. 0000247661 00000 n 0000247710 00000 n 0000247833 00000 n 0000247882 00000 н. 0000248010 00000 n 0000248059 00000 n 0000248179 00000 n 0000248228 00000 n 0000248352 00000 n 0000248401 00000 n 0000248511 00000 n 0000248560 00000 n 0000248673 00000 n 0000248722 00000 n 0000248845 00000 n 0000248894 00000 n 0000249026 00000 n 0000249075 00000 n 0000249201 00000 n 0000249250 00000 n 0000249379 00000 n 0000249428 00000 н. 0000249567 00000 н. 0000249616 00000 n 0000249755 00000 n 0000249804 00000 n 0000249933 00000 n 0000249982 00000 n 0000250097 00000 n 0000250146 00000 n 0000250273 00000 n 0000250322 00000 n 0000250451 00000 n 0000250500 00000 n 0000250632 00000 n 0000250681 00000 n 0000250808 00000 n 0000250857 00000 n 0000250989 00000 n 0000251038 00000 н. 0000251148 00000 n 0000251197 00000 n 0000251323 00000 n 0000251372 00000 n 0000251487 00000 n 0000251536 00000 n 0000251659 00000 n 0000251708 00000 n 0000251860 00000 n 0000251909 00000 n 0000252047 00000 n 0000252096 00000 n 0000252211 00000 n 0000252260 00000 n 0000252396 00000 n 0000252445 00000 n 0000252574 00000 n 0000252623 00000 n 0000252768 00000 n 0000252817 00000 n 0000252964 00000 n 0000253013 00000 n 0000253127 00000 n 0000253176 00000 n 0000253293 00000 n 0000253342 00000 n 0000253459 00000 n 0000253508 00000 n 0000253618 00000 n 0000253667 00000 n 0000253792 00000 n 0000253841 00000 n 0000253966 00000 n 0000254015 00000 n 0000254135 00000 n 0000254184 00000 n 0000254305 00000 n 0000254354 00000 n 0000254496 00000 n 0000254545 00000 n 0000254668 00000 n 0000254717 00000 n 0000254840 00000 n 0000254889 00000 n 0000255024 00000 n 0000255073 00000 n 0000255210 00000 n 0000255259 00000 n 0000255381 00000 n 0000255430 00000 n 0000255550 00000 n 0000255599 00000 n 0000255742 00000 n 0000255791 00000 n 0000255922 00000 n 0000255971 00000 n 0000256099 00000 n 0000256148 00000 n 0000256267 00000 n 0000256316 00000 n 0000256438 00000 n 0000256487 00000 n 0000256610 00000 n 0000256659 00000 n 0000256773 00000 n 0000256822 00000 n 0000256938 00000 n 0000256987 00000 n 0000257104 00000 н. 0000257153 00000 n 0000257276 00000 n 0000257325 00000 n 0000257441 00000 n 0000257490 00000 n 0000257609 00000 n 0000257658 00000 n 0000257777 00000 n 0000257826 00000 n 0000257944 00000 n 0000257993 00000 n 0000258114 00000 n 0000258163 00000 n 0000258276 00000 n 0000258325 00000 n 0000258447 00000 n 0000258496 00000 n 0000258619 00000 n 0000258668 00000 n 0000258792 00000 n 0000258841 00000 n 0000258967 00000 n 0000259016 00000 n 0000259072 00000 n 0000259130 00000 n 0000260696 00000 n 0000262165 00000 n 0000263308 00000 n 0000264756 00000 n 0000266259 00000 n 0000268066 00000 n 0000269573 00000 n 0000270645 00000 n 0000270703 00000 n 0000270905 00000 n 0000271291 00000 n 0000272084 00000 n 0000272707 00000 n 0000466472 00000 n 0000466647 00000 n 0000466823 00000 n 0000467000 00000 n 0000467043 00000 n 0000467104 00000 n 0000467158 00000 n 0000467213 00000 n 0000467275 00000 n 0000467825 00000 n 0000467931 00000 n 0000468057 00000 n 0000468182 00000 n 0000468297 00000 n 0000468412 00000 n 0000468527 00000 n 0000852896 00000 n 0000853518 00000 n 0000853692 00000 n 0000854140 00000 n 0000854611 00000 n 0000854947 00000 n 0000855351 00000 n 0000855558 00000 n 0000855922 00000 n 0000856163 00000 n 0000856528 00000 n 0000047713 00000 n трейлер > startxref 0 %% EOF 306 0 объект > эндобдж 307 0 объект > >> /DA (/Helv 0 Tf 0 g) >> эндобдж 2664 0 obj > транслировать xm\uν;ޝFkس
It’s nearly here, the long-awaited release of the 2018 Wiring Rules.Сделка готова? Это большой вопрос, и готовы ли вы, что ближе к делу?
Австралийский стандарт будет применяться в соответствии с законодательством штата Виктория в соответствии с Правилами электробезопасности (установки) 2009 г., а затем в версии 2019 г., которая в настоящее время переписывается Energy Safe Victoria.
Новый стандарт заменяет AS / NZS 3000: 2007 с даты публикации. Однако в некоторых случаях это невозможно, и переходный период, например 6 месяцев будет разрешено Energy Safe Victoria.
Если работы по установке были начаты до публикации новой редакции, необходимо проконсультироваться с Energy Safe Victoria относительно исключения для завершения установки в соответствии с AS / NZS 3000: 2007.
Ниже приводится обзор некоторых из предстоящих изменений. Имейте в виду, что это всего лишь обзор, и если он вас раздражает, посетите базу технических знаний NECA (TKB), посетив www.neca.asn.au/vic/ база технических знаний. Члены NECA также могут получить бесплатную копию буклета NECA ESV Wiring Rules, которая знакомит читателей с наиболее важными изменениями, которые произойдут в 2018 году.Просто позвоните по телефону 1300 300 031, чтобы запросить копию.Предисловие к AS / NZS 3000: 2018 содержит ценную информацию о том, как интерпретировать и использовать этот стандарт.
В новой версии Правил подключения сохранятся две части. Часть 1 содержит единообразные основные элементы, которые составляют минимальные нормативные требования для безопасной электрической установки.
Часть 1 отвечает следующим целям:
- Как правило, должно быть само по себе, чтобы избежать перекрестных ссылок на Часть 2.
- Для обеспечения результатов / условий высокого уровня безопасности без предписывающих методов работы, которые демонстрируют средства соответствия (которые находятся в Части 2).
- Установить принудительную связь с Частью 2. Несоблюдение метода работы из Части 2 приведет к нарушению требований Части 1, если не будет использован альтернативный метод.
- Для установления статуса «считается соответствующим» Части 2, подтверждающего, что установки, соответствующие Части 2, соответствуют требованиям Части 1.
- Для обеспечения соответствия требованиям стандарта IEC 60364 «Низковольтные электрические установки (серийные)», разработки на уровне существенной безопасности.
- Обеспечить механизм для принятия альтернативных методов проектирования и установки, которые не рассматриваются или несовместимы с теми, которые указаны в Части 2 «считается соответствующим». Этот механизм предназначен для применения там, где есть отклонения от методов, описанных в Части 2. важные, а не второстепенные аспекты, которые остаются в пределах гибкости Части 2.
- Для подробного описания требований к проектировщикам или установщикам, стремящимся применить альтернативный метод к методам «признано соответствующим», содержащимся в Части 2. В Части 2 представлены методы установки, которые считаются соответствующими требованиям Части 1.
Часть 2 удовлетворяет следующим целям:
- Включить и развить все требования Части 1 с дополнительными требованиями и рекомендациями для уточнения и поддержки соответствия.
- Для восстановления определенных требований, рекомендаций и примеров типичных эффективных совместимых решений из предыдущих выпусков.
- Делать упор на общие, практичные и рентабельные методы, обеспечивающие соблюдение требований безопасности, соответствие назначению и уровень надлежащей практики, а не на чрезмерно консервативные или непонятные меры.
- Для более широкого использования цифр и примеров для содействия пониманию общих или сложных аспектов, например электрические схемы, альтернативные варианты расположения устройств максимального тока, степень защиты от проникновения (IP) и доступ к распределительному щиту.
Информационный бюллетень NECA ESV 2017
Раздел 1:
Новые и пересмотренные определения указаны в разделе 1.4 звездочкой (*) в коде
левое поле.
Раздел 2:
- Добавлены рабочие характеристики КРУ, ЩИТ.
- Добавлены требования к происхождению вспомогательных и конечных подсетей.
- Добавлены требования к работе главного выключателя.
- Уточнены положения устройств защиты от перегрузки.
- Обновлены требования к альтернативным положениям устройств защиты от короткого замыкания.
- Расширена дискриминация / селективность защитных устройств.
- Повышены требования к защите от внутренних дуговых замыканий в распределительном щите.
- Добавлены требования к цепям, защищенным УЗО в бытовых, небытовых, нежилых и медицинских установках, а также уточнены требования к УЗО при переделках и ремонтах.
- Обновлены иллюстрации основных зазоров для доступа к распределительному щиту.
- Добавлен новый раздел об устройствах обнаружения дугового замыкания и требованиях к их установке.
- Требования к установкам распределительных щитов на 800 А или выше были усилены, включая доступ и выход, размеры дверей распределительных щитов и минимальные зазоры вокруг распределительных щитов в распределительных.
- Были предоставлены дополнительные разъяснения относительно растущих ответвлений сети.
Раздел 3:
- Повышенные требования к безопасности при прокладке кабелей, проходящих через объемную теплоизоляцию.
- Уточнена цветовая маркировка активного, нейтрального и заземляющего проводов.
- Уточнены требования к системам электропроводки, устанавливаемым в местах, где они могут быть нарушены.
- Уточнены требования к кабелям различных электроустановок в общих корпусах и к разделению кабелей.
- Уточнены требования к разделению кабелей разного уровня напряжения.
Раздел 4:
- На пересмотренных цифрах указано, где должно быть установлено оборудование с классом защиты IP.
- Пересмотрены требования к монтажной проводке, подключаемой через монтажный соединитель.
- Требования к розеткам для электромобилей теперь включены.
- Пересмотрены требования к осветительному оборудованию и аксессуарам.
- Повышены требования к безопасной установке встраиваемых светильников и добавлен обновленный список классификаций светильников.
- Для повышения безопасности уточнены требования к коммутационным устройствам для кухонных приборов.
- Уточнены требования к изоляции газовых приборов и оборудования.
- В настоящее время включены требования к электрическому оборудованию, которое может производить горячие частицы или горячие поверхности.
- Дальнейшее разъяснение требований к изоляторам для систем кондиционирования воздуха и тепловых насосов.
- Добавлен новый пункт и цифры, касающиеся электрического оборудования, установленного в местах, требующих защиты от погодных условий.
- Добавлены требования к установке и расположению розеток для зарядных станций электромобилей.
- Добавлены требования к разрешению для розеток и выключателей от открытых газовых или электрических кухонных приборов.
- Добавлены требования к изолирующим выключателям, устанавливаемым рядом со всеми стационарными проводными водонагревателями.
- Добавлены требования к опасным зонам, предъявляемым к газоотводным терминалам.
- Добавлены требования к кондиционерам и тепловым насосам, в которых внутренний блок (или блоки) питается от распределительного щита или цепи отдельно от компрессора, и были добавлены новые исключения.
- Добавлены требования к лифтам, установленным для общего пользования и не являющимся аварийными лифтами (службы безопасности).
Раздел 5:
- Система MEN дополнительно определена для ясности.
- MEN добавлены требования к подключению в отношении расположения в доступном месте.
- Обновлены допустимые типы заземляющих электродов.
- Обновлены требования к заземлению для систем SELV и PELV.
- Уточнены и усилены требования к заземлению флигеля.
- Требования к эквипотенциальному соединению были расширены и уточнены за счет повышенных требований для душевых, ванных комнат, бассейнов и спа.
- Заземление токопроводящих строительных материалов в совмещенных постройках.
- Требования к заземлению индивидуальных и совмещенных хозяйственных построек.
- Требования к заземлению токопроводящих корпусов распределительных щитов, связанных с незащищенными электросетями потребителей.
- Заземление токопроводящей арматуры в совмещенных хозяйственных постройках с душевыми или ваннами.
- Электропроводящие конструкции бассейна и точка подключения к электросети должны быть установлены и присоединены к системе заземления установки независимо от других указанных требований.
- Добавлен рисунок, показывающий схемы крепления для бассейнов и спа.
- Добавлены требования к токопроводящей арматуре и арматуре, установленной в пределах досягаемости руки от края бассейна, и которые прямо или косвенно контактируют с общей массой земли.
Раздел 6:
- Дополнительное содержание, относящееся к контейнерам для воды, в которые люди обычно не помещают часть или все свое тело.
- Уточнены требования к установке дренчерных душей.
- Душевые зоны Зона 1 были уточнены для различных конфигураций душевых лейок.
- Размер фиксированного резервуара для воды уменьшен с 45 до 40 л.
- Распределительные щиты больше не разрешается размещать в классифицированных зонах с повышенной влажностью.
- Зоны для душевых с распашной дверцей классифицированы.
- Указанная вместимость спа-бассейнов или ванн увеличена с 500 литров до 680 литров.
- Системы производства электроэнергии, включая инверторы, исключены из установки в классифицированных зонах.
- Бассейны и СПА исключены из зон, содержащих электрическое оборудование, принадлежащее распределителю электроэнергии, что приводит к включению такого оборудования в любую классифицированную зону.
- Добавлена таблица для определения классифицированных зон для фонтанов и водных объектов.
Раздел 7:
Пункт 7.2, Служба безопасности, была реорганизована.
- Требования к установке систем производства электроэнергии были рассмотрены и уточнены в соответствии с применимыми стандартами.
Раздел 8:
Ряд разделов разделен на подразделы, чтобы различать общие, применение, визуальный осмотр, требования к испытаниям и принятые значения.
Приложения:
- Приложение A — Теперь единый список стандартов, на которые есть ссылки.
- Приложение B — Таблица из FAQ 34 (сравнение падения напряжения и значений EFLI) добавлена для дальнейшего руководства.
- Приложение C — Расширено, а информация, предоставляемая по максимальному запросу, была уточнена и обновлена.
- Приложение D — Изменено, чтобы предоставить более полную информацию о строительстве частных воздушных линий.
- Приложение K — Сводка по распределительному оборудованию была добавлена, чтобы предоставить контрольный список требований к распределительным щитам.
- Приложение L — Приложение удалено.Раньше оказывал первую помощь в Австралии.
- Приложение M — Официально о первой помощи в Новой Зеландии. Этот контент был удален, и было добавлено новое Приложение о снижении воздействия перебоев в электроснабжении, чтобы дать указания по непрерывности поставок и планам резервного копирования.
- Приложение N — Новое приложение, содержащее руководство по типам и вариантам кабелепроводов, доступных для электрических установок.
- Приложение O — Новое приложение, содержащее руководство по установке этих устройств.
- Приложение P — Новое приложение, содержащее руководство по цепям, предназначенным для подачи энергии на электромобили.
- Приложение Q — Новое приложение, содержащее руководство по выбору устройств защиты цепи и коммутации при работе от постоянного тока. поставки, которые будут считаться соответствующими критериям настоящего Стандарта по проектированию, выбору оборудования и установке.
Теперь, когда вы осмыслили масштабы изменений, где вы найдете «дьявола», вспомнив, что дьявол кроется в деталях.
Ответ прост: NECA снова проведет 18 выездных презентаций по Виктории, в которых будут подробно описаны наиболее важные изменения. Убедитесь, что вы получили билеты заранее, посетив www.neca.asn.au/roadshow. Эти вечера на вес золота, каждый электрик должен посетить роуд-шоу NECA, чтобы быть в курсе и быть в курсе.Он также будет доступен в базе технических знаний NECA (TKB), доступной вам как участнику бесплатно с мобильного телефона, iPad или ноутбука. Если вам нужен доступ, позвоните в офис сейчас по телефону 1300 300 031.
Присоединяйтесь к нам через ваше приложение facebook, чтобы задать любые вопросы, которые могут у вас возникнуть
| NECA Страница | Группа NECA |
AS / NZS 3000: 2018 :: Стандарты Новой Зеландии
AS / NZS 3000: 2018 ЭЛЕКТРИЧЕСКИЕ УСТАНОВКИ (ИЗВЕСТНЫЕ ПРАВИЛАМИ АВСТРАЛИИ / НОВОЙ ЗЕЛАНДИИ)
ПРЕДИСЛОВИЕ
СОДЕРЖАНИЕ
СПИСОК
СПИСОКПРЕДИСЛОВИЕ
РАЗДЕЛ 1 ОБЛАСТЬ ПРИМЕНЕНИЯ И ОСНОВНЫЕ ПРИНЦИПЫ
1.1 ОБЛАСТЬ ПРИМЕНЕНИЯ
1.2 ПРИМЕНЕНИЕ
1.3 ССЫЛКА ДОКУМЕНТОВ
1.4 ОПРЕДЕЛЕНИЯ
1.4.1 Применение определений
1.4.2 Доступно
1.4.3 Доступно, легко
1.4.4 Аксессуар
1.4.4 или активный проводник)
1.4.6 Соседний
1.4.7 Воздушный провод
1.4.8 Изменение
1.4.9 Устройство
1.4.10 Устройство, стационарное
1.4.11 Устройство, переносное
1 .4.12 Переносной прибор
1.4.13 Стационарный прибор
1.4.14 Устройство обнаружения дугового замыкания (AFDD)
1.4.15 Зона, опасная
1.4.16 Дальность действия Arm ™
1.4.17 Полномочия, нормативные требования
1.4.18 Уполномоченное лицо
1.4.19 В наличии
1.4.20 Барьер
1.4.21 Кабель
1.4.22 Кабель армированный
1.4.23 Жила кабеля
1.4.24 Кабель гибкий
1.4.25 Кабель с металлической оболочкой с минеральной изоляцией (MIMS)
1.4.26 Кабель с экраном нейтрали
1.4.27 Кабель в оболочке
1.4.28 Потолочный подвесной
1.4.29 Цепь
1.4.30 Автоматический выключатель
1.4.31 Оборудование класса I
1.4.32 Класс Оборудование II
1.4.33 Оборудование класса III
1.4.34 Компетентное лицо
1.4.35 Проводник
1.4.36 Провод, неизолированный
1.4.37 Потребительская сеть
1.4.38 Контакт, прямой
1.4. 39 Контакт, непрямой
1.4.40 Шнур гибкий
1.4.41 Ток, неисправность
1.4.42 Ток, перегрузка
1.4.43 Ток, короткое замыкание
1.4.44 Ситуация с влажностью
1.4.45 Обесточен
1.4.46 Распределительный щит
1.4.47 Заземленный
1.4.48 Заземленный
1.4.49 Полное сопротивление цепи замыкания на землю
1.4.50 Электрооборудование
1.4.51 Электрическое повреждение
1.4.52 Электрический монтаж
1.4.53 Электромонтаж, бытовой
1.4.54 Электромонтаж, многократный
1.4.55 Электромонтаж, жилой
1.4.56 Электромобиль (EV)
1.4.57 Электрораспределитель
1.4.58 Корпус
1.4. 59 Под напряжением
1.4.60 Эквипотенциальное соединение
1.4.61 Взрывоопасная атмосфера
1.4.62 Открытая проводящая часть
1.4.63 Внешняя проводящая часть
1.4.64 Ограничитель тока повреждения
1.4.65 Пожарный режим
1.4.66 Функциональное заземление (FE)
1.4.67 Функциональный блок
1.4.68 Предохранитель
1.4.69 Информационный
1.4.70 Класс защиты от проникновения (IP)
1.4.71 Монтажный соединитель
1.4.72 Изолированная
1.4.73 Система изоляции
1.4.74 Изолированная
1.4.75 Изоляция (функция изоляции)
1.4.76 Лампа
1.4.77 Лифт
1.4.78 Под напряжением
1 .4.79 Токоведущая часть
1.4.80 Светильник (осветительная арматура)
1.4.81 Главный заземляющий провод
1.4.82 Главный выключатель
1.4.83 Система с множественной заземленной нейтралью (MEN)
1.4.84 Нейтраль (нейтральный провод или средний провод)
1.4.85 Нейтральная заземленная система
1.4.86 Нормативная
1.4.87 Препятствие
1.4.88 Отдельная постройка
1.4.89 Комбинированная постройка
1.4.90 Перегрузка по току
1.4.91 Штекер
1.4.92 Точка (в проводке)
1.4.93 Точка крепления
1.4.94 Точка входа
1.4.95 Точка питания
1.4.96 Защищенное сверхнизкое напряжение (PELV)
1.4.97 Защита, базовая
1.4.98 Защита, неисправность
1.4.99 Защитная нейтраль заземления (PEN)
1.4.100 Провод защитного заземления
1.4.101 Ремонт
1.4.102 Устройство защитного отключения (УЗО) )
1.4.103 Без пульсаций d.c.
1.4.104 Служба безопасности
1.4.105 Отдельное сверхнизкое напряжение (SELV)
1.4.106 Сервисное защитное устройство
1.4.107 Должно
1.4.108 Если
1.4.109 Розетка, удлинитель шнура
1.4.110 Розетка-розетка
1.4.111 Розетка-розетка-Многократная комбинация
1.4.112 Розетка устройства защитного отключения (SRCD)
1.4.113 Мягкая проводка
1.4.114 Источник питания
1.4. 115 Подсхема, заключительная
1.4.116 Подстанция
1.4.117 Подстанция
1.4.118 Электропитание, альтернативное
1.4.119 Электропитание, обычное
1.4.120 Электропитание, дополнительное
1.4.121 Коммутатор
1.4.122 Коммутатор, основной
1.4. 123 Распределительное устройство
1.4.124 Ток прикосновения
1.4.125 Напряжение прикосновения
1.4.126 Система рельсов
1.4.127 Магистраль, кабель
1.4.128 Напряжение
1.4.129 Электропроводка, контактная
1.4.130 Электропроводка
1.4.131 Электропроводка, оборудование
1.4.132 Электропроводка, установка
1.4.133 Электропроводка
1.4.134 Электропроводка под землей
1.5 ОСНОВНЫЕ ПРИНЦИПЫ
1.5.1 Защита от опасностей и повреждений
1.5.2 Управление и изоляция
1.5.3 Защита от поражения электрическим током
1.5.4 Базовая защита
1.5.5 Защита от повреждений
1.5.6 Дополнительная защита с помощью УЗО
1.5.7 Базовая защита и защита от короткого замыкания за счет использования сверхнизкого напряжения
1.5.8 Защита от тепловых воздействий при нормальной эксплуатации
1.5.9 Защита от сверхтока
1.5.10 Защита от токов замыкания на землю
1.5.11 Защита от аномальных напряжения
1.5.12 Защита от распространения огня
1.5.13 Защита от травм от механического движения
1.5.14 Защита от внешних воздействий
1.6 ПРОЕКТИРОВАНИЕ ЭЛЕКТРИЧЕСКОЙ УСТАНОВКИ
1.6.1 Общие положения
1.6.2 Характеристики питания
1.6.3 Максимальное потребление
1.6.4 Напряжение питания
1.6.5 Расположение электрических цепей
1.7 ВЫБОР И УСТАНОВКА ЭЛЕКТРИЧЕСКОГО ОБОРУДОВАНИЯ ОБОРУДОВАНИЕ
1.7.1 Общие положения
1.7.2 Порядок выполнения монтажных работ
1.7.3 Выбор оборудования
1.7.4 Влажные ситуации
1.8 ПРОВЕРКА (ОСМОТР И ИСПЫТАНИЯ)
1.9 СРЕДСТВА СООТВЕТСТВИЯ
1.9.1 Соответствие Части 2 настоящего Стандарта
1.9.2 Соответствие требованиям других стандартов
1.9.3 Изменения и ремонт
1.9.4 Соответствие определенному проекту и установке
РАЗДЕЛ 2 ОБЩИЕ ПОЛОЖЕНИЯ, КОНТРОЛЬ И ЗАЩИТА
2.1 ОБЩИЕ ПОЛОЖЕНИЯ
2.1.1 Приложение
2.1.2 Выбор и установка
2.2 УСТАНОВКА ЭЛЕКТРОМОНТАЖА
2.2.1 Цепи
2.2.2 Максимальное потребление
2.2.3 Выбор и установка проводов
2.2.4 Рабочие характеристики оборудования
2.3 УПРАВЛЕНИЕ ЭЛЕКТРИЧЕСКИМ УСТАНОВКОЙ
2.3.1 Общие
2.3.2 Общие требования к контролю
2.3.3 Главные выключатели
2.3.4 Дополнительные разъединители
2.3.5 Аварийное выключение, включая аварийный останов
2.3.6 Отключение для механического обслуживания
2.3.7 Функциональное (управляющее) переключение
2.4 ЗАЩИТА ОТ НЕИСПРАВНОСТЕЙ
2.4.1 Общие
2.4.2 Защита путем автоматического отключения питания
2.4.3 Типы устройств
2.4.4 Устройства автоматического повторного включения
2.5 ЗАЩИТА ОТ ПЕРЕГРУЗОЧНЫЙ ТОК
2.5.1 Общие положения
2.5.2 Устройства для защиты от токов перегрузки и короткого замыкания
2.5.3 Защита от тока перегрузки
2.5.4 Защита от тока короткого замыкания
2.5.5 Защита распределительного щита от токов внутреннего дугового замыкания
2.5.6 Согласование устройств защиты от перегрузки и короткого замыкания
2.5.7 Надежность питания
2.6 ДОПОЛНИТЕЛЬНАЯ ЗАЩИТА УСТРОЙСТВАМИ ОСТАТОЧНОГО ТОКА
2.6.1 Общие положения
2.6.2 Выбор и расположение устройств
2.6.3 Дополнительная защита устройствами защитного отключения
2.7 ЗАЩИТА ОТ ПЕРЕНАПРЯЖЕНИЯ
2.7.1 Общие положения
2.7.2 Защита с помощью изоляции или разделения
2.7.3 Защита с помощью защитных устройств
2.8 ЗАЩИТА ОТ ПОНИЖЕННОГО НАПРЯЖЕНИЯ
2.8.1 Общие положения
2.8.2 Выбор защитного устройства
2.9 ЗАЩИТА ОТ ОПАСНОСТИ ПОЖАРА ИЗ-ЗА ДУГОВЫХ НАПРЯЖЕНИЙ 2.
.1 Общие
2.9.2 Тип
2.9.3 Рейтинг
2.9.4 Расположение
2.9.5 Изменения
2.9.6 Конечные подсхемы в Австралии
2.9.7 Конечные подсхемы в Новой Зеландии
2.10 КОММУТАТОРЫ
2.10.1 Общие
2.10.2 Расположение распределительных щитов
2.10.3 Конструкция
2.10.4 Перемычки
2.10.5 Идентификация оборудования
2.10.6 Электропроводка
2.10.7 Противопожарные меры
РАЗДЕЛ 3 ВЫБОР И МОНТАЖ ЭЛЕКТРИЧЕСКИХ СИСТЕМ
3.1 ОБЩИЕ ПОЛОЖЕНИЯ
3.1.1 Применение
3.1.2 Выбор и установка
3.2 ВИДА СИСТЕМ ЭЛЕКТРОПРОВОДКИ
3.3 ВНЕШНИЕ ВЛИЯНИЯ
3.3.1 Общие
3.3.2 Особые воздействия
3.4 ТОК-МОЩНОСТЬ
3.4.1 Общие
3.4.2 Пределы рабочей температуры
3.4.3 Пределы рабочих температур
3.4.3 параллельно
3.4.4 Координация между проводниками и защитными устройствами
3.5 РАЗМЕР ПРОВОДНИКА
3.5.1 Общие
3.5.2 Нейтральный провод
3.5.3 Заземляющий провод
3.6 ПАДЕНИЕ НАПРЯЖЕНИЯ
3.6.1 Общие
3.6.2 Значение
3.6.3 Параллельные проводники
3.7 ЭЛЕКТРИЧЕСКИЕ СОЕДИНЕНИЯ
3.7.1 Общие
3.7.2 Способы подключения
3.7.3 Соединения в кабелях
3.7.4 Монтажные муфты
3.8 ИДЕНТИФИКАЦИЯ
3.8.1 Общие
3.8.2 Цветовая идентификация
3.8.3 Исключения и специальные приложения
3.9 ТРЕБОВАНИЯ К УСТАНОВКЕ
3.9.1 Общие
3.9.2 Способы установки
3.9.3 Опора и крепление
3.9.4 Защита от механических повреждений
3.9.5 Электропроводка, установленная вертикально
3.9.6 Изменение направления
3.9.7 Особое требования к установке
3.9.8 Предотвращение взаимного вреда между службами
3.9.9 Выбор и установка для минимизации распространения огня
3.9.10 Ограничение циркулирующих и вихревых токов
3.9.11 Минимизация электромагнитных помех
3.10 КОЖУХ КАБЕЛЕЙ
3.10.1 Общие положения
3.10.2 Электромонтажные шкафы
3.10.3 Монтаж электропроводки
3.11 ПОДЗЕМНЫЕ ЭЛЕКТРОПРОВОДНЫЕ СИСТЕМЫ
3.11.1 Пригодность и защита .2 Классификация систем электропроводки
3.11.3 Расположение
3.11.4 Требования к установке
3.11.5 Расстояние от других подземных коммуникаций
3.12 СИСТЕМЫ АЭРОПРОВОДОВ
3.12.1 Типы проводов
3.12.2 Расположение
3.12.3 Зазоры
3.12.4 Расстояние между опорами (пролетами)
3.12.5 Опоры для воздушных проводов
3.12.6 Полюса и столбы (включая опоры, стойки и удлинители к конструкциям)
3.12.7 Соединения и соединения
3.13 КАБЕЛИ, ПОДДЕРЖИВАЕМЫЕ КАТЕНАРИЕЙ
3.13.1 Типы кабелей
3.13.2 Опоры контактной сети
3.13.3 Зазоры
3.14 СЛУЖБЫ БЕЗОПАСНОСТИ
3.15 АВТОМОБИЛЬНЫЕ ПУТИ, ВКЛЮЧАЯ СИСТЕМЫ НАПРАВЛЯЮЩЕЙСЯ СЕТИ
3.16 СИСТЕМА ВОЗВРАТА ЗАЗЕМЛЕНИЯ (ESR)
РАЗДЕЛ 4 ВЫБОР И УСТАНОВКА
. 2 Выбор и установка
4.1.3 Внешние воздействия
4.1.4 Неблагоприятные воздействия и помехи
4.1.5 Системы вытяжки
4.2 ЗАЩИТА ОТ ТЕПЛОВЫХ ВОЗДЕЙСТВИЙ
4.2.1 Общие
4.2.2 Предотвращение пожара
4.2.3 Защита от ожогов
4.3 ПОДКЛЮЧЕНИЕ ЭЛЕКТРИЧЕСКОГО ОБОРУДОВАНИЯ
4.3.1 Общее
4.3.2 Прямое подключение
4.3.3 Монтажная проводка, подключаемая установкой соединитель (и)
4.3.4 Розетки в монтажной проводке
4.3.5 Другие соединительные устройства
4.3.6 Электропроводка оборудования
4.4 РОЗЕТКИ
4.4.1 Типы
4.4.2 Расположение
4.4.3 Заземляющие контакты
4.4.4 Коммутационное устройство
4.4.5 Поляризация и последовательность фаз
4.5 ОСВЕЩЕНИЕ И ПРИНАДЛЕЖНОСТИ
4.5.1 Патроны, включая патроны, встроенные в светильник
4.5.2 Лампы и светильники
4.6 ДЫМОВАЯ СИГНАЛИЗАЦИЯ
4.7 ПРИБОРЫ ДЛЯ ПРИГОТОВЛЕНИЯ
4.7.1 Переключающее устройство
4.7.2 Подключение только для Новой Зеландии
4.7.3 Расстояние до открытых варочных поверхностей
4.8 ПРИБОРЫ ДЛЯ ГОРЯЧЕЙ ВОДЫ ИЛИ ПАРА
4.8.1 Общие
4.8.2 Водонагреватели
4.9 КОМНАТНЫЕ НАГРЕВАТЕЛИ
4.9.1 Общие
4.9.2 Изолирующие выключатели
4.9.3 Функциональные выключатели
4.10 ЭЛЕКТРИЧЕСКИЙ НАГРЕВ КАБЕЛИ ДЛЯ ПОЛОВ И ПОТОЛКОВ И ПРИЛОЖЕНИЯ ДЛЯ ОБОГРЕВА
4.10.1 Общие положения
4.10.2 Нагревательные кабели
4.10.3 Изолирующие выключатели
4.10.4 Функциональные выключатели
4.10.5 Дополнительная защита
4.10.6 Знаки
4.11 НАГРЕВАТЕЛИ ЭЛЕКТРОКАНАЛОВ
4.12 ПРЕОБРАЗОВАТЕЛИ ЭЛЕКТРОПРИВОДА
4.12.1 Общие
4.12.2 Выбор и установка
4.12.3 Контроль
4.12.4
4.12.4 Изоляция 9000. 5 Защита от перегрузки по току
4.12.6 Заземление
4.12.7 Непрерывность нейтрали
4.12.8 Электрооборудование, подключенное к выходу
4.13 ДВИГАТЕЛИ
4.13.1 Защита от травм от механического движения
4.13.2 Защита от перегрузки
4.13.3 Защита от перегрева
4.14 ТРАНСФОРМАТОРЫ
4.14.1 Общие
4.14.2 Вторичный контур
4.14.3 Низковольтный трансформатор питания
4.14.4 Автотрансформаторы
4.14.5 Шаг повышающие трансформаторы
4.15 КОНДЕНСАТОРЫ
4.15.1 Общие положения
4.15.2 Электрооборудование
4.15.3 Обеспечение разряда и контроля
4.16 ЭЛЕКТРИЧЕСКОЕ ОБОРУДОВАНИЕ, СОДЕРЖАЩИЕ ЖИДКОЕ ДИЭЛЕКТРИЧЕСКОЕ ОБОРУДОВАНИЕ
4.16.1 Общие положения
4.16.2 Жидкие диэлектрики с температурой вспышки не выше 250 ° C
4.17 АККУМУЛЯТОРЫ
4.18 ГАЗОВЫЕ ПРИБОРЫ И ОБОРУДОВАНИЕ
4.18.1 Газовые приборы
4.18.2 Газовые баллоны, содержащие газы тяжелее воздуха — На открытом воздухе
4.18.3 Газовые баллоны — внутри помещений — только для Новой Зеландии
4.18.4 Терминал сброса газа — Природный газ, сжиженный газ или биогаз
4.18.5 Сетчатая газовая система легче воздуха, система измерения и регуляторы- Только в Новой Зеландии
4.19 СИСТЕМЫ КОНДИЦИОНИРОВАНИЯ И ТЕПЛОВЫХ НАСОСОВ
4.20 ЛИФТЫ
4.20.1 Общие положения
4.20.2 Устройство подачи лифта
4.20.3 Маркировка
4.20.4 Лифты без моторного отсека (MRLs)
ЗЕМЛЯ СЕКЦИЯ 5 И ПРОВОДНИКИ ЗАЗЕМЛЕНИЯ
5.1 ОБЩИЕ ПОЛОЖЕНИЯ
5.1.1 Применение
5.1.2 Выбор и установка
5.1.3 Система заземления MEN
5.1.4 Другие системы заземления
5.2 ФУНКЦИИ ЗАЗЕМЛЕНИЯ
5.2.1 Защитное заземление
5.2.2 Функциональное заземление (FE)
5.2.3 Заземление для комбинированных защитных и функциональных целей
5.3 ЧАСТИ СИСТЕМЫ ЗАЗЕМЛЕНИЯ
5.3.1 Общие положения
5.3.2 Материал и тип заземляющего проводника
5.3 .3 Сечение заземляющего проводника (площадь поперечного сечения)
5.3.4 Клемма заземления / соединение или шина
5.3.5 Соединение MEN
5.3.6 Заземляющие электроды
5.3.7 Функциональные заземляющие провода
5.4 ЗАЗЕМЛЕНИЕ ОБОРУДОВАНИЯ
5.4.1 Общие положения
5.4.2 Розетки
5.4.3 Точки освещения
5.4.4 Светильники
5.4.5 Токопроводящие опоры для воздушных проводников
5.4.6 Металлоконструкции, включая токопроводящие строительные материалы
5.4.7 Погружные насосы
5.4.8 Устройства переменной частоты
5.5 УСТРОЙСТВА ЗАЗЕМЛЕНИЯ
5.5.1 Главный заземляющий провод
5.5.2 Провода защитного заземления
5.5.3 Особые методы заземления
5.5.4 Непрерывность
5.5.5 Установка
5.5.6 Подключения
5.6 ЭКВИПОТЕНЦИАЛЬНОЕ СОЕДИНЕНИЕ
5.6.1 Общие
5.6.2 Расположение
5.6.3 Соединение проводов
5.7 СОПРОТИВЛЕНИЕ КОНТУРА ЗАЗЕМЛЕНИЯ
5.7.1 Общие положения
5.7.2 Время отключения
5.7.3 Контур замыкания на землю
5.7.4 Импеданс
5.7.5 Дополнительное уравнивание потенциалов
5.8 ДРУГИЕ УСТРОЙСТВА ЗАЗЕМЛЕНИЯ
РАЗДЕЛ 6 ВЛАЖНОСТЬ
6.1 ОБЩИЕ ПОЛОЖЕНИЯ
6.1.1 Применение
6.1.2 Выбор и установка
6.2 ВАННЫ, ДУШИ И ДРУГИЕ СТАЦИОНАРНЫЕ КОНТЕЙНЕРЫ ДЛЯ ВОДЫ
6.2.1 Область применения 6.2
Классификация зон
6.2.3 Защита от поражения электрическим током — Запрещенные меры
6.2.4 Выбор и установка электрооборудования
6.3 БАССЕЙНЫ, ДОРОЖНЫЕ БАССЕЙНЫ И СПА БАССЕЙНЫ ИЛИ ВАННЫ
6.3.1 Область применения
6.3.2 Классификация зон
6.3.3 Защита от поражения электрическим током
6.3.4 Выбор и установка электрического оборудования
6.4 ФОНТАНЫ И ВОДНЫЕ ХАРАКТЕРИСТИКИ
6.4.1 Область действия
6.4.2 Классификация зоны
6.4.3 Защита от поражения электрическим током
6.4.4 Выбор и установка электрооборудования
6.5 САУНА
6.5.1 Область применения
6.5.2 Классификация зон
6.5.3 Защита от поражения электрическим током
6.5.4 Выбор и установка электрооборудования
6.6 ХОЛОДИЛЬНЫЕ ПОМЕЩЕНИЯ
6.6.1 Область применения
6.6.2 Защита от поражения электрическим током
6.6.3 Выбор и установка электрооборудования
6.7 САНИТИЗАЦИЯ И ОБЩИЕ ОПЕРАЦИИ ПО УСТАНОВКЕ
6.7.1 Область применения
6.7.2 Классификация зоны
6.7.3 Защита от поражения электрическим током
6.7.4 Выбор и установка электрического оборудования
РАЗДЕЛ 7 СПЕЦИАЛЬНЫЕ ЭЛЕКТРИЧЕСКИЕ УСТАНОВКИ
7.1 ОБЩИЕ ПОЛОЖЕНИЯ
7.1.1 Применение
7.1.2 Выбор и установка
7.2 УСЛУГИ БЕЗОПАСНОСТИ
7.2.1 Область применения и общие
7.2.2 Системы электроснабжения
7.2.3 Главный распределительный щит и распределительное устройство
7.2.4 Главные выключатели
7.2.5 Пожарные насосы и оборудование управления пожарными насосами
7.2.6 Оборудование для обнаружения пожара и дыма и системы пожарной сигнализации
7.2.7 Системы вентиляции
7.2.8 Эвакуационное оборудование
7.2.9 Аварийные лифты
7.2.10 Аварийные лифты без моторного отсека
7.3 СИСТЕМЫ ГЕНЕРАЦИИ ЭЛЕКТРОЭНЕРГИИ
7.3.1 Общие положения
7.3.2 Выбор и монтаж системы
7.3.3 Управление
7.3.4 Изоляция
7.3.5 Защита от перегрузки по току
7.3.6 Заземление
7.3.7 Подключенное электрическое оборудование
7.3.8 Подключение к электроустановке
7.4 ЗАЩИТА ЭЛЕКТРИЧЕСКИМ РАЗДЕЛЕНИЕМ (ИЗОЛИРОВАННОЕ ПИТАНИЕ)
7.4.1 Общие положения
7.4.2 Источник питания
7.4.3 Расположение цепей
7.4.4 Коммутационные аппараты
7.4.5 Питание отдельных единиц электрооборудования
7.4.6 Поставка нескольких единиц электрического оборудования
7.4.7 Преобразователь частоты (VSD) Фильтры электромагнитных помех
7.4.8 Тестирование
7,5 ЭЛЕКТРИЧЕСКИЕ УСТАНОВКИ Сверхнизкого напряжения
7.5.1 Область применения
7.5.2 Приложение
7.5.3 Источники питания для систем SELV и PELV
7.5.4 Требования к разделению цепей SELV и PELV
7.5.5 Расположение цепей SELV
7.5.6 Расположение PELV цепей
7.5.7 Падение напряжения в проводниках
7.5.8 Управление электроустановкой
7.5.9 Защита от перегрузки по току
7.5.10 Соединительные устройства
7.5.11 Системы электропроводки
7.5.12 Испытания
7.6 ВЫСОКОВОЛЬТНЫЕ ЭЛЕКТРИЧЕСКИЕ УСТАНОВКИ
7.6.1 Область применения
7.6.2 Приложение
7.6.3 Проблемы, относящиеся к высоковольтным установкам
7.7 ОПАСНЫЕ ЗОНЫ (ВЗРЫВООПАСНЫЙ ГАЗ ИЛИ ГОРЮЧИЙ ВЗРЫВ
ПЫЛЬЯ)7.7.2 Классификация опасных зон
7.8 СТАНДАРТЫ ДЛЯ СПЕЦИАЛЬНЫХ ЭЛЕКТРИЧЕСКИХ УСТАНОВОК
7.8.1 Область применения
7.8.2 Стандарты, содержащие требования, которые дополняют, заменяют или изменяют общие требования настоящего Стандарта
7.8.3 Стандарты, содержащие руководство
7.9 ПОСТАВКИ ДЛЯ ЭЛЕКТРОТРАНСПОРТНЫХ СРЕДСТВ (ТОЛЬКО ДЛЯ Новой Зеландии)
7.9.1 Область применения
7.9.2 Поставка (только для Новой Зеландии)
7.9.3 Бытовые электрические установки (только для Новой Зеландии)
7.9.4 Прочие электрические установок (только для Новой Зеландии)
РАЗДЕЛ 8 ПРОВЕРКА
8.1 ОБЩИЕ ПОЛОЖЕНИЯ
8.1.1 Приложение
8.1.2 Общие требования
8.1.3 Периодические проверки и испытания
8.2 ВИЗУАЛЬНЫЙ ОСМОТР
8.2.1 Общие
8.2.2 Контрольный список
8.3 ИСПЫТАНИЯ
8.3.1 Общие
8.3.2 Методы испытаний
8.3.3 Обязательные испытания
8.3.4 Последовательность испытаний
8.3.5 Целостность системы заземления
8.3.6 Сопротивление изоляции
8.3.7 Полярность и правильное подключение цепей
8.3.8 «Текст удален»
8.3.9 Проверка полного сопротивления контура замыкания на землю (EFLI)
8.3.10 Работа УЗО
8.4 ЗАПИСИ ПРОВЕРКИ
ПРИЛОЖЕНИЕ A — СПРАВОЧНЫЕ ДОКУМЕНТЫ
ПРИЛОЖЕНИЕ B — РУКОВОДСТВО ПО ЗАЩИТЕ ЦЕПЕЙ
B1 ОБЪЕМ
B2 ЗАЩИТА ЦЕПИ
B2 ЗАЩИТА ЦЕПИ
B3 ЗАЩИТА ЦЕПИ
B3 Общая защита
CCC ЗАЩИТА ОТ ПЕРЕДАЧC ЗАЩИТА ОТ ПЕРЕДАЧустройств
B4 ЗАЩИТА АВТОМАТИЧЕСКИМ ОТКЛЮЧЕНИЕМ ПИТАНИЯ
B4.1 Приложение
B4.2 Принцип
B4.3 Время отключения
B4.4 Контур замыкания на землю
B4.5 Расчет полного сопротивления контура замыкания на землю
B4.6 Измерение полного сопротивления контура замыкания на землю
B5 МАКСИМАЛЬНАЯ ДЛИНА ЦЕПИ
B5.1 Общие положения
B5.2 Расчет максимальной длины цепи
ПРИЛОЖЕНИЕ C — КОНСТРУКЦИЯ ЦЕПЕЙ
C1 ОБЪЕМ
C2 МАКСИМАЛЬНЫЙ СПРОС
C2.1 Максимальный спрос после разнесения
C2.2 Расчет максимального спроса в электросети и вспомогательных сетях потребителя
C2.3 Внутренние установки
C2.4 Внешние установки
C2.5 Максимальный спрос в конечных подсхемах
C3 УПРОЩЕННЫЙ ВЫБОР ЗАЩИТНЫХ УСТРОЙСТВ
C4 УПРОЩЕННОЕ ПЕРЕПАД НАПРЯЖЕНИЯ
C4.1 Предпосылки
C4.2 Примеры КОЛИЧЕСТВО ТОЧЕК, ПОДКЛЮЧЕННЫХ К ЦЕПЯМ
C5.1 Количество цепей
C5.2 Конечные подсхемы
C6 РУКОВОДСТВО ПО МАКСИМАЛЬНОМУ КОЛИЧЕСТВУ КАБЕЛЕЙ, УСТАНОВЛЕННЫХ В ТРУБОПРОВОДАХ
C6.1 Общие
C6.2 Основы расчетов
C6.3 Замечания по применению
ПРИЛОЖЕНИЕ D — МИНИМАЛЬНЫЕ РАЗМЕРЫ СТОЙК, СТОЛБ И СТРЕЛК ДЛЯ ПРОВОДНИКОВ ВОЗДУШНОЙ ЛИНИИ
D1 ПРИМЕНЕНИЕ
D1.1 Общие
D1.2 таблицы в Приложении
D2 ОБЩИЕ ТРЕБОВАНИЯ К СТОЙКАМ И СТОЙКАМ
D2.1 Проходка столбов / столбов в землю
D2.2 Деревянные столбы / столбы
D2.3 Столбы / столбы из стальных труб
D3 ПРИНАДЛЕЖНОСТИ К ЗДАНИЯМ ИЛИ СООРУЖЕНИЯМ
D3.1 Ответственность за проектирование
D3.2 Горизонтальные и вертикальные стойки
D4 ПРИМЕР ИСПОЛЬЗОВАНИЕ ТАБЛИЦ ДЛЯ ОПРЕДЕЛЕНИЯ РАЗМЕРА ПОЛЮСА / СТОЙКИ ИЛИ СТРЕЛКИ
D4.1 Проблема
D4.2 Решение
ПРИЛОЖЕНИЕ E — УСТАНОВКА ЭЛЕКТРИЧЕСКОГО ОБОРУДОВАНИЯ СТРОИТЕЛЬНЫЕ КОДЫ
E1 ОБЛАСТЬ ПРИМЕНЕНИЯ
E2 АВСТРАЛИЯ
E2.1 Общие положения
E2.2 Принципы классификации
E2.3 Положения NCC
E3 NEW ZEALAND
E3.1 Общие
E3.2 Количество электроустановок в NZBC
E3.3 Разрешения на строительство
ПРИЛОЖЕНИЕ F — УСТРОЙСТВА ЗАЩИТЫ ОТ НАПРЯЖЕНИЯ
F1 УСТРОЙСТВА ЗАЩИТЫ ОТ НАПРЯЖЕНИЯ
F1.1 Общие
F1.2 Выбор и установка УЗИП
F2 ЗАЩИТНОЕ ЗАЗЕМЛЕНИЕ И СОЕДИНЕНИЕ
ПРИЛОЖЕНИЕ G — СТЕПЕНЬ ЗАЩИТЫ ЗАКРЫТОГО ОБОРУДОВАНИЯ
ПРИЛОЖЕНИЕ H — WS КЛАССИФИКАЦИЯ ЭЛЕКТРОПРОВОДНЫХ СИСТЕМ
h2
ОБЩИЕ ПОЛОЖЕНИЯ
h2
.1 Классификация
h2.2 Обозначение
h2.3 Первая характеристическая цифра
h2.4 Вторая характеристическая цифра
h2.5 Дополнительная буква W
h2.6 Поставка и установка
h3 ОСОБЕННОСТИ ПРИМЕНЕНИЯ ЭЛЕКТРИЧЕСКОЙ СИСТЕМЫ
h3 .1 Строительный кодекс
h3.2 Стандарты установки оборудования
h4 ПОЖАРНО-ЗАЩИЩЕННЫЕ ПРОВОДНЫЕ СИСТЕМЫ
h5 МЕХАНИЧЕСКИ ЗАЩИЩЕННЫЕ ПРОВОДНЫЕ СИСТЕМЫ
h5.1 Общие положения
h5.2 Применение систем электропроводки
h5.3 Незакрытые системы электропроводки
h5.4 Системы замкнутой электропроводки
H5 РУКОВОДСТВО ПО КЛАССИФИКАЦИИ МЕХАНИЧЕСКОЙ ЗАЩИТЫ
H5.1 Общие
H5.2 Системы механической защиты WSX1
H5.3 системы механической защиты
H5.4 WSX3 системы механической защиты
ПРИЛОЖЕНИЕ I — НОМИНАЛЫ ЗАЩИТНЫХ УСТРОЙСТВ И МЕТРИЧЕСКИЕ ЭКВИВАЛЕНТНЫЕ РАЗМЕРЫ ДЛЯ КАБЕЛЕЙ IMPERIAL, ИСПОЛЬЗУЕМЫХ ПРИ ИЗМЕНЕНИЯХ И РЕМОНТАХ
I1 SCOPE
I2 PROTECTIVE SIZE
I2
I2 PROTECTIVE DEVICE
I2 ПРОВОДНИКИ
ПРИЛОЖЕНИЕ J — ОБОЗНАЧЕНИЯ, ИСПОЛЬЗУЕМЫЕ В ДАННОМ СТАНДАРТЕ
ПРИЛОЖЕНИЕ K — ОБЗОР ТРЕБОВАНИЙ К ПАНЕЛИ
K1 ОБЩИЕ ПОЛОЖЕНИЯ
K1.1 Введение
K1.2 Соответствует
K2 СТАНДАРТЫ ПАНЕЛИ
K2.1 Общие положения
K2.2 Дата отзыва AS / NZS серии 3439
K2.3 Тестирование
K3 ПРИМЕНЕНИЕ AS / NZ СЕРИЯ 61439
K3.1 Общие правила
K3.2 Силовые распределительные устройства и устройства управления (PSC)
K3.3 Распределительные щиты, предназначенные для обслуживания обычных людей (DBO)
K4 РУКОВОДСТВО ПО ОЦЕНКЕ ЩИТОВ
K4 .1 Пользовательский шаблон
K4.2 Пункты по согласованию
K4.3 Проверка конструкции
K5 СООТВЕТСТВУЮЩИЕ ПОЛОЖЕНИЯМ ДАННОГО СТАНДАРТА И СЕРИИ AS / NZS 61439
K6 ОСОБЫЕ ПОЛОЖЕНИЯ, ОТНОСЯЩИЕСЯ К ДАННОМУ СТАНДАРТУ
Degreeзащита НКУ
K6.2 Форма внутреннего разделения
K6.3 Зазор
K6.4 Категория перенапряжения
K6.5 Ток утечки
K6.6 Заземление (цепь защитного заземления)
K6.7 Диэлектрические испытания для защиты от поражения электрическим током
K6.8 Номинальный ток по испытаниям и пределы температуры
K6.9 Расчет значений для аналогичных вариантов согласно AS / NZS 61439.1
K6.10 Проверочная оценка согласно AS / NZS 61439.1
K7 ПРОЧНОСТЬ ПРИ КРАТКОМ ЗАМЫКАНИИ
K7.1 Общие
K7.2 Номинальные характеристики
K7.3 Устойчивость к короткому замыканию в сравнении с эталонной конструкцией с использованием контрольного списка
K8 МАРКИРОВКА
K8.1 Коммутаторы PSC и DBO
K8.2 Дополнительная маркировка для DBO
K9 ДРУГИЕ СООТВЕТСТВУЮЩИЕ ХАРАКТЕРИСТИКИ, ОБЪЯВЛЯЕМЫЕ ИЗГОТОВИТЕЛЕМ МОНТАЖА
K10 ЗАМЕНА УСТРОЙСТВА
K10.1 Вопросы по замене устройства
K102 K10 К СУЩЕСТВУЮЩИМ ПАНЕЛИ
K12 ПРОВЕРКА ПРОИЗВОДИТЕЛЯ ПАНЕЛЬНЫХ ПЛАТ
ПРИЛОЖЕНИЕ L — (удалено)
ПРИЛОЖЕНИЕ M — СНИЖЕНИЕ ВЛИЯНИЯ ОТКЛЮЧЕНИЯ ИСТОЧНИКА ЭЛЕКТРОПИТАНИЯ 9000 MELIVER SUPPLY 9000 MELIVER 9000 SPLY 9000 SPLY 9000 ПОМОЩЬ ПИТАНИЯ 9000 ПОДДЕРЖКА ПИТАНИЯ 9000 ПОДДЕРЖКА ПИТАНИЯ 9000 ПОДДЕРЖКА ПИТАНИЯ 9000 ПОДДЕРЖКА ПИТАНИЯ. .1 Область применения
M1.2 Активный уход за престарелыми
M1.3 Медицинская помощь на дому
M2 РАСПОЛОЖЕНИЕ
ПРИЛОЖЕНИЕ N — ЭЛЕКТРОПРОВОДЫ
ОБЩАЯ ИНФОРМАЦИЯ СЕРИИ N1
N2 МАРКИРОВКА СЕРИИ AS / NZS 2053 И AS / NZS 2053 СЕРИИ AS / AS / NZS 2053 И AS / AS / NZS 2053
КЛАССИФИКАЦИИ N3
ПРИЛОЖЕНИЕ O — УСТАНОВКА УСТРОЙСТВ ДЛЯ ОБНАРУЖЕНИЯ ДУГОВОГО НЕИСПРАВНОСТИ (AFDD)
O1 ОБЩИЕ
O2 ХАРАКТЕРИСТИКИ AFDD
O3 ОБЩИЕ ТРЕБОВАНИЯ ДЛЯ ВЫБОРА
ИДЕНТИФИКАЦИИ ДЛЯ ДОПОЛНИТЕЛЬНЫХ УСТРОЙСТВ.1 РасположениеO4.2 Выбор AFDD
O4.3 Установка
O4.4 Защита от перенапряжения
ПРИЛОЖЕНИЕ P — РУКОВОДСТВО ПО УСТАНОВКЕ И РАСПОЛОЖЕНИЮ РОЗЕТКИ И ЗАРЯДНЫХ УСТАНОВОК ДЛЯ ЭЛЕКТРОМОБИЛЯ
P1.1 Область применения
P1.2 Приложения
P1.3 Дополнительные требования и тесты
P1.4 Исключения
P1.5 Определения
P2 МАКСИМАЛЬНЫЙ СПРОС
P3 УСТАНОВКА
P3.1 Общие
P3.2 Внешние воздействия
P4 УСТРОЙСТВА ДЛЯ ЗАЩИТЫ ОТ НЕПРЯМОГО КОНТАКТА ПРИ АВТОМАТИЧЕСКОМ ОТКЛЮЧЕНИИ ПИТАНИЯ
УЗО P4.1
P4.2 Устройства для защиты от сверхтоков
P5.3 ДРУГИЕ Защитные проводники
P4.3 ОБОРУДОВАНИЕ
P5.1 Розетки и автомобильные разъемы
P5.2 Характеристики автомобильных соединителей, розеток и вилок
P5.3 Разрешенные розетки или автомобильные разъемы
P5.4 Типы подключения
P6 ЗАРЯДНЫЕ СТАНЦИИ И КАБЕЛИ
P7 ПЕРИОДИЧЕСКАЯ ПРОВЕРКА
ПРИЛОЖЕНИЕ Q — РУКОВОДСТВО ПО ПРИМЕНЕНИЮ ЗАЩИТЫ ЦЕПИ ПОСТОЯННОГО ТОКА
Q1 SCOPE
SUPER CIRCUIT PROTECTION SUPER CIRCUIT PROTECTIONQ1 SCOPE
SUPER CIRCUIT PROTECTION APPLICATIONQ1 SCOPE
SUPPLYQ2000 Q3000 Polized 9000 ARC 9000 9000 TYPE 9000 Q3000 9000 ARC 9000 9000 Q3000 9000 9000 Q3000 9000 9000 Q3000 ARC 9000 9000 Q3000 9000 ARC 9000 9000 9000 Q3000 9000 9000 Q3000 9000 9000 9000 Q3
Q4.2 Неполяризованный тип
Q5 НОМИНАЛ ПОСТОЯННОГО ТОКА
Q5.1 Общие
Q5.2 Заземленный источник постоянного тока
Q6 ОБЕСПЕЧЕНИЕ ИЗОЛЯЦИИ И ЗАЩИТЫ ОТ ПЕРЕГРУЗКИ ПО ТОКУ
Q7 КОММУТАЦИОННАЯ ПЛАТА 9000 РАСПОЛОЖЕНИЙ 9000 КОЛЛЕКЦИИ ПОДКЛЮЧЕНИЙ Q8000
Q9 ИНВЕРТОРЫ
ИНДЕКС
| AA | АВТОМОБИЛЬНАЯ АССОЦИАЦИЯ |
| AAA | АССОЦИАЦИЯ AUXILIAIRE DE L’AUTOMOBILE |
| AAAS | РАСШИРЕННАЯ АКТИВНАЯ АДАПТИВНАЯ ВТОРИЧНАЯ БЕЗОПАСНОСТЬ |
| AAGR | СРЕДНИЙ ГОДОВОЙ РОСТ |
| AAIB | ОТДЕЛЕНИЕ ПО РАССЛЕДОВАНИЮ АВАРИЙ С ВОЗДУХОМ |
| AAM | АЛЬЯНС АВТОМОБИЛЬНЫХ ПРОИЗВОДИТЕЛЕЙ (США) |
| AAMA | АССОЦИАЦИЯ ПРОИЗВОДИТЕЛЕЙ АМЕРИКАНСКИХ АВТОМОБИЛЕЙ |
| AAMVA | АМЕРИКАНСКАЯ АССОЦИАЦИЯ АДМИНИСТРАТОРОВ АВТОМОБИЛЯ |
| Орхус | КОНВЕНЦИЯ ЕЭК ООН О ДОСТУПЕ К ПРАВОСУДИЮ ПО ВОПРОСАМ ОКРУЖАЮЩЕЙ СРЕДЫ |
| ABA | АМЕРИКАНСКАЯ АССОЦИАЦИЯ АВТОБУСОВ |
| ABC | КОНТРОЛЬ АКТИВНОГО ТЕЛА |
| ABI | АССОЦИАЦИЯ БРИТАНСКИХ СТРАХОВЩИКОВ |
| ABPA | ASSOCIAO BRASILIERA DE PNEUS & AROS (БРАЗИЛИЙСКАЯ ШИННАЯ АССОЦИАЦИЯ) |
| ABRO | АССОЦИАЦИЯ ЛОГИСТИКИ ЗАЩИТЫ |
| АБС | СИСТЕМА АНТИБЛОКИРОВКИ ТОРМОЗА |
| АБС | АКРИЛОНИТРИЛ-БУТАДИЕН-СТИРЕН |
| ABTC | Центр тестирования автобусов ALTOONA (штат Пенсильвания, США) |
| AC ИЛИ кондиционер | КОНДИЦИОНЕР ВОЗДУХА |
| ACAP | ASSOCIACAO DO COMERCIO AUTOMOVEL DE PORTUGAL |
| ACAROM | ASOCIATIEI CONSTRUCTORILOR DE AUTOMOBILE DIN ROMANIA |
| ACBE | КОНСУЛЬТАТИВНЫЙ КОМИТЕТ ПО БИЗНЕСУ И ОКРУЖАЮЩЕЙ СРЕДЕ |
| АКК | АДАПТИВНЫЙ КРУИЗ-КОНТРОЛЬ |
| АКК | КОНСОРЦИУМ АВТОМОБИЛЬНЫХ КОМПОЗИТОВ (USCAR) |
| ACE | АССОЦИАЦИЯ ИНЖЕНЕРОВ-КОНСАЛТИНГОВ |
| ACE | ИНДЕКС ОБЩЕЙ ЗАТРАТЫ |
| ACEA | ASSOCIATION DES CONSTRUCTEURS EUROPEENS D’AUTOMOBILES (ЕВРОПЕЙСКАЯ АССОЦИАЦИЯ ПРОИЗВОДИТЕЛЕЙ АВТОМОБИЛЕЙ) |
| ACEM | АССОЦИАЦИЯ ПРОИЗВОДИТЕЛЕЙ МОТОЦИКЛОВ ЕВРОПЫ (ASSOCIATION DES CONSTRUCTEURS EUROPEENS DE MOTORCYLES) |
| ACFO | АССОЦИАЦИЯ ОПЕРАТОРОВ АВТОПАРКА |
| ACICAE | BASQUE COUNTRY АВТОПРОМЫШЛЕННОСТЬ |
| ACM | УПРАВЛЕНИЕ СЧЕТАМИ |
| ACoP | УТВЕРЖДЕННЫЙ КОД ПРАКТИКИ |
| ACORD | АВТОМОБИЛЬНЫЙ КОНСОРЦИУМ ПО ПЕРЕРАБОТКЕ И УТИЛИЗАЦИИ (Великобритания) |
| ACPMS | АССОЦИАЦИЯ ПРОИЗВОДИТЕЛЕЙ КОМПОНЕНТОВ И ЗАПЧАСТЕЙ РАЗДЕЛ |
| АКПО | АССОЦИАЦИЯ ГЛАВНЫХ ПОЛИЦЕЙСКИХ |
| ACPOS | АССОЦИАЦИЯ ГЛАВНЫХ ПОЛИЦЕЙСКИХ ШОТЛАНДИИ |
| ACRIB | СОВЕТ КОНДИЦИОНЕРА И ХОЛОДИЛЬНОЙ ПРОМЫШЛЕННОСТИ |
| СКУД | АВТОМОБИЛЬНЫЕ КОМПОНЕНТЫ РАЗДЕЛ |
| СКУД | ПРЕДУПРЕЖДАЮЩЕЕ ОБНАРУЖЕНИЕ АВАРИЙ |
| ACTO | АССОЦИАЦИЯ ГЛАВНЫХ ТЕХНИЧЕСКИХ ДОЛЖНОСТЕЙ |
| АКТЫ | КОНСУЛЬТАТИВНЫЙ КОМИТЕТ ПО ТОКСИЧНЫМ ВЕЩЕСТВАМ |
| ADA | ЗАКОН АМЕРИКАНСКИМ ИНВАЛИДАМ |
| ADAC | АВТОМОБИЛЬНАЯ АССОЦИАЦИЯ (ГЕРМАНИЯ) |
| ADAPS | АССОЦИАЦИЯ СПЕЦИАЛИСТОВ ПО АДАПТАЦИИ ВОДИТЕЛЕЙ |
| ADAS | КОНСУЛЬТАЦИОННАЯ СЛУЖБА РАЗВИТИЯ СЕЛЬСКОГО ХОЗЯЙСТВА |
| АБР | АВТОБУС ДЛЯ РАСШИРЕННОГО ДИЗАЙНА |
| ADCCAT | АССОЦИАЦИЯ ВЫПУСКНИКОВ И ПРЕОБРАЗОВАТЕЛЕЙ КЛЕЙКИХ ЛЕНТ |
| ДОБАВИТЬ | АВТОМАТИЧЕСКОЕ ОБНАРУЖЕНИЕ ДЕФЕКТОВ |
| ADEFA | ASOCIACION DE FABRICAS DE AUTOMORES (АРГЕНТИНА) |
| АПД | ФЕДЕРАЦИЯ АВТОМОБИЛЬНОГО РАСПРЕДЕЛЕНИЯ |
| АДИ | УТВЕРЖДЕННЫЙ ИНСТРУКТОР ПО ВОЖДЕНИЮ |
| ADLO | АССОЦИАЦИЯ ПРЯМЫХ ТРУДОВЫХ ОРГАНИЗАЦИЙ |
| ADR | ПРАВИЛА АВСТРАЛИЙСКОГО ДИЗАЙНА |
| ADR | АВТОМАТИЧЕСКАЯ ДОРОГА ДОЛЖНОСТИ |
| ADR | ACCORD EUROPEEN RELATIF AUX TRANSPOR INTERNATIONAL DES MARCHANDISES DANGEREUSES PAR ROUTE (ЕВРОПЕЙСКОЕ СОГЛАШЕНИЕ ПЕРЕВОЗКИ ОПАСНЫХ ГРУЗОВ ДОРОГАМИ) |
| ADS | УСЛУГИ АВТОМОБИЛЬНЫХ ДАННЫХ |
| ADS | АССОЦИАЦИЯ АВТОМОБИЛЬНЫХ ПРОИЗВОДИТЕЛЕЙ И УПОЛНОМОЧЕННЫХ ИМПОРТЕРОВ (СЛОВЕНИЯ) |
| AE | УПОЛНОМОЧЕННЫЙ ЭКСПЕРТ — И ЛИЦА, УЧАСТВУЮЩИЕ В ПАРТНЕРСТВЕ ИЛИ КОМПАНИИ, ОТВЕЧАЮЩИМ ТРЕБОВАНИЯМ (ПОМЕЩЕНИЯ, ОБОРУДОВАНИЕ, ПЕРСОНАЛ И ДОПОЛНИТЕЛЬНАЯ РЕВИЗИЯ) ДЛЯ ПРОВЕДЕНИЯ ТОЗИРОВАНИЯ |
| AEA | АССОЦИАЦИЯ ИНЖЕНЕРОВ СЕЛЬСКОГО ХОЗЯЙСТВА |
| AEBS | СИСТЕМА АВТОМАТИЧЕСКОГО АВАРИЙНОГО ТОРМОЗА |
| AECC | АССОЦИАЦИЯ ПО КОНТРОЛЮ ВЫБРОСАМ ПО КАТАЛИЗАТОРУ |
| AECD | УСТРОЙСТВО КОНТРОЛЯ ДОПОЛНИТЕЛЬНЫХ ВЫБРОСОВ |
| AECS | СТРАТЕГИЯ КОНТРОЛЯ ВСПОМОГАТЕЛЬНЫХ ВЫБРОСОВ |
| AEG | ПЛОЩАДЬ ЭКОЛОГИЧЕСКАЯ ГРУППА |
| AEGPL | ЕВРОПЕЙСКАЯ АССОЦИАЦИЯ СЖИЖЕННОГО НЕФТЯНОГО ГАЗА |
| AEI | ИДЕНТИФИКАЦИЯ АВТОМАТИЧЕСКОГО ОБОРУДОВАНИЯ |
| AEMT | АССОЦИАЦИЯ ЭЛЕКТРОМЕХАНИЧЕСКИХ ПРОФЕССИОНАЛОВ |
| AENOR | ASOCIATION ESPANOL DE NORMALIZACION |
| AEO | АССОЦИАЦИЯ ОРГАНИЗАТОРОВ ВЫСТАВКИ |
| AEP | АССОЦИАЦИЯ ПРОИЗВОДИТЕЛЕЙ ЭЛЕКТРОЭНЕРГИИ |
| AETR | ДОГОВОР О РАБОЧИХ ЭКИПАЖАХ ТРАНСПОРТНЫХ СРЕДСТВ, ЗАНИМАЮЩИХСЯ МЕЖДУНАРОДНЫМ АВТОМОБИЛЬНЫМ ТРАНСПОРТОМ |
| AFC | АВТОМАТИЧЕСКИЙ СБОР ПЛАТЕЖЕЙ |
| AFCAR | АЛЬЯНС ЗА СВОБОДУ АВТОРЕМОНТА |
| AFIA | ASSOCIACAO DE FABRICANTES PARA INDUSTRIA AUTOMOVEL (ПОРТУГАЛИЯ) |
| AFNOR | АССОЦИАЦИЯ ФРАНЦИЯ ДЕ НОРМАЛИЗАЦИИ |
| AFQUAD | АССОЦИАЦИЯ EUROPEENNE DES TABRICANTS ET IMPORTATEURS DE QUADRICYCLES |
| AFRC | СОВЕТ ПО ИССЛЕДОВАНИЯМ СЕЛЬСКОГО ХОЗЯЙСТВА |
| AFRL | АВТОМАТИЧЕСКАЯ ПЕРВАЯ РЕГИСТРАЦИЯ И ЛИЦЕНЗИРОВАНИЕ |
| AFS | РАСШИРЕННЫЕ СИСТЕМЫ ПЕРЕДНЕГО ОСВЕЩЕНИЯ |
| AGB | СПЕЦИАЛЬНАЯ ГРУППА ПО ТОРМОЗАМ (EEC) |
| AGTC | ДОГОВОР О МЕЖДУНАРОДНЫХ КОМБИНИРОВАННЫХ ТРАНСПОРТНЫХ ЛИНИЯХ И СВЯЗАННЫХ С УСТАНОВКАХ |
| AHAI | АССОЦИАЦИЯ АВТОМОБИЛЬНОЙ ПРОМЫШЛЕННОСТИ ВЕНГРИИ |
| AHEG | СПЕЦИАЛЬНАЯ ГРУППА ЭКСПЕРТОВ |
| AHO | АВТОМАТИЧЕСКАЯ ФАРА ВКЛЮЧЕНА (ОСВЕЩЕНИЕ МОТОЦИКЛА) |
| AHS | АВТОМАТИЧЕСКАЯ ДОРОЖНАЯ СИСТЕМА |
| AIA | АВТОМОБИЛЬНЫЕ ИМПОРТЕРЫ АМЕРИКИ |
| AIA | АССОЦИАЦИЯ АВТОМОБИЛЬНОЙ ПРОМЫШЛЕННОСТИ |
| AIA CR (SAP) | АССОЦИАЦИЯ АВТОМОБИЛЬНОЙ ПРОМЫШЛЕННОСТИ ЧЕШСКОЙ РЕСПУБЛИКИ |
| AIA SR | АССОЦИАЦИЯ АВТОМОБИЛЬНОЙ ПРОМЫШЛЕННОСТИ (СЛОВАКИЯ) |
| AIAA | АССОЦИАЦИЯ АМЕРИКАНСКИХ ИМПОРТЕРОВ АГЕНТОВ |
| AIAG | ГРУППА ДЕЙСТВИЙ АВТОМОБИЛЬНОЙ ПРОМЫШЛЕННОСТИ |
| AIAM | АССОЦИАЦИЯ МЕЖДУНАРОДНЫХ АВТОМОБИЛЬНЫХ ПРОИЗВОДИТЕЛЕЙ (США) |
| AIAM | АССОЦИАЦИЯ ИНДИЙСКИХ ПРОИЗВОДИТЕЛЕЙ |
| AIAMC | АССОЦИАЦИЯ МЕЖДУНАРОДНЫХ АВТОМОБИЛЬНЫХ ПРОИЗВОДИТЕЛЕЙ КАНАДЫ |
| AIB | АККРЕДИТОВАННЫЙ, НЕЗАВИСИМЫЙ ИСПЫТАТЕЛЬНЫЙ ОРГАН |
| AIB | ИЗОЛЯЦИЯ ИЗ АСБЕСТА |
| AICA | ASSOCIAZIONE ITALIANA CONSTRUTTORI AUTOATTREZZATURE |
| AICC | АВТОНОМНЫЙ ИНТЕЛЛЕКТУАЛЬНЫЙ КРУИЗ-КОНТРОЛЬ |
| AICG | ГРУППА СЕРТИФИКАЦИИ АВТОМОБИЛЬНОЙ ПРОМЫШЛЕННОСТИ |
| AID | ДАННЫЕ ПО АВТОМОБИЛЬНОЙ ПРОМЫШЛЕННОСТИ |
| AIGT | КОМАНДА РОСТА АВТОМОБИЛЬНОЙ ПРОМЫШЛЕННОСТИ |
| AILU | АССОЦИАЦИЯ ПОЛЬЗОВАТЕЛЕЙ ПРОМЫШЛЕННЫХ ЛАЗЕРОВ |
| AIM | АВТОМАТИЧЕСКАЯ ИДЕНТИФИКАЦИЯ ПРОИЗВОДИТЕЛЕЙ |
| AIM | ASSOCIATION DES INDUSTRIES DE PRODUITS DE MARQUES (АССОЦИАЦИЯ ПРОМЫШЛЕННЫХ ПРОДУКТОВ) |
| AIMA | ASSOCIACAO DOS INDUSTRIAS DE MONTAGEM DE AUTOMOVEIS |
| AIMS | АССОЦИАЦИЯ НЕЗАВИСИМЫХ АВТОМОБИЛЬНЫХ МАГАЗИНОВ |
| AIRC | МЕЖДУНАРОДНАЯ АССОЦИАЦИЯ РЕПАРАТЕРОВ В КАРРОССЕРИ |
| AIRSO | АССОЦИАЦИЯ ПРОМЫШЛЕННЫХ ДОРОЖНЫХ БЕЗОПАСНОСТЕЙ |
| AIS | ТЯЖЕСТЬ ТРАВМЫ (МАСШТАБ) АВАРИИ |
| AIS | АВТОМОБИЛЬНЫЙ-ИМПОРТЕРНЕС SAMMENSLUTNING (ДАНИЯ) |
| AIS | АВТОМОБИЛЬНАЯ ИНФОРМАЦИОННАЯ СЛУЖБА (SMMT) |
| AIT | МЕЖДУНАРОДНАЯ ТУРИСТИЧЕСКАЯ АССОЦИАЦИЯ (МЕЖДУНАРОДНЫЙ ТУРИСТИЧЕСКИЙ АЛЬЯНС) |
| AITF | АВТОМОБИЛЬНАЯ ПРОМЫШЛЕННОСТЬ TASK FORCE |
| АЛАПА | ASSOCIAO LATINO AMERICANA DE PNEUS E AROS |
| ALARP | НАСКОЛЬКО РАЗУМНО ПРАКТИЧЕСКАЯ НИЗКАЯ |
| ALBRSO | АССОЦИАЦИЯ ЛОНДОНСКИХ БЕЗОПАСНОСТЕЙ ДОРОЖНОЙ БЕЗОПАСНОСТИ |
| АЛЕН | НЕДОСТАТОЧНАЯ СЕТЬ ЭСКОРТА НАГРУЗКИ |
| ALG | АССОЦИАЦИЯ ПРАВИТЕЛЬСТВА ЛОНДОНА |
| ALR | АВТОМАТИЧЕСКАЯ БЛОКИРОВКА ВЕТРАКТОРОВ |
| АЛЬРЕМ | АССОЦИАЦИЯ ОБОРУДОВАНИЯ ДЛЯ БЕЗОПАСНОСТИ ГРУЗА |
| AM | ПОПРАВКА |
| АМА | НАКОПИТЕЛЬНЫЙ ПРОБЕГ В АМЕРИКАНЕ |
| АМА | АМЕРИКАНСКАЯ АССОЦИАЦИЯ МОТОЦИКЛИСТОВ |
| AME | ГОДОВОЙ УПРАВЛЯЕМЫЙ БЮДЖЕТ |
| AMF | ADVANCED MOTOR FUELS, РЕАЛИЗАЦИЯ СОГЛАШЕНИЯ МЭА |
| AMFA | АЛЬТЕРНАТИВНЫЙ ЗАКОН МОТОРНОГО ТОПЛИВА (США 1988) |
| AMP | ПЛАН УПРАВЛЕНИЯ АКТИВАМИ |
| AMS | AUTO MOTOR SPORT (НЕМЕЦКИЙ ЖУРНАЛ) |
| AMT | ПЕРЕДОВЫЕ ТЕХНОЛОГИИ ПРОИЗВОДСТВА |
| AMVCB | СЕРТИФИКАЦИОННЫЙ СОВЕТ АВСТРАЛИЙСКИХ АВТОМОБИЛЕЙ |
| AMVIR | АССОЦИАЦИЯ ИМПОРТЕРОВ АВТОМОБИЛЕЙ (ГРЕЦИЯ) |
| ANA | СТАТЬЯ АССОЦИАЦИЯ НОМЕРА |
| ANFAC | ASOCIACION ESPANOLA DE FABRICANTES DE AUTOMOVILES Y CAMIONES (ИСПАНИЯ) |
| ANFAVEA | АССОЦИАЦИЯ НАЦИОНАЛЬНЫХ DOS FABRICANTES DE VEICULOS AUTOMOTORES (БРАЗИЛИЯ) |
| ANFIA | ASSOCIAZIONE NAZIONALE FRA INDUSTRIE AUTOMOBILISTICHE (ИТАЛИЯ) |
| ANPR | АВТОМАТИЧЕСКОЕ РАСПОЗНАВАНИЕ НОМЕРА |
| ANPRM | ПРЕДВАРИТЕЛЬНОЕ УВЕДОМЛЕНИЕ О ПРЕДЛАГАЕМЫХ ПРАВИЛАХ |
| ANSI | ИНСТИТУТ НАЦИОНАЛЬНЫХ СТАНДАРТОВ АМЕРИКИ |
| ANX | АВТОМОБИЛЬНАЯ СЕТЕВАЯ ОБМЕНА |
| АОНБ | ЗОНА ВЫДАЮЩЕЙСЯ ЕСТЕСТВЕННОЙ КРАСОТЫ (НАЦИОНАЛЬНЫЕ ПАРКИ И ДОСТУП НА ЗАГОРОДНЫЙ ЗАКОН 1949 г.) |
| AORC | СОВЕТ АВТОМОБИЛЬНЫХ ОГРАНИЧИТЕЛЕЙ (США) |
| APAS | РАЗДЕЛ АВТОЗАПЧАСТЕЙ И ПРИНАДЛЕЖНОСТЕЙ |
| БТР | КОНТРОЛЬ ЗАГРЯЗНЕНИЯ ВОЗДУХА |
| APDS | РАЗДЕЛ РАСПРЕДЕЛЕНИЯ АВТОЗАПЧАСТЕЙ |
| API | ИНТЕРФЕЙС ПРОГРАММИРОВАНИЯ ПРИЛОЖЕНИЙ |
| APIA | АССОЦИАЦИЯ ПРОИЗВОДИТЕЛЕЙ И ИМПОРТЕРОВ АВТОМОБИЛЕЙ (РУМЫНИЯ) |
| APME | АССОЦИАЦИЯ ПРОИЗВОДИТЕЛЕЙ ПЛАСТИКОВ В ЕВРОПЕ |
| APMG | ВСЕ СТОРОНА МОТОРНАЯ ГРУППА |
| APS | ДАТЧИК ПОЛОЖЕНИЯ ПЕДАЛИ АКСЕЛЕРАТОРА |
| APSN | РАСШИРЕННАЯ СЕТЬ ПАССИВНОЙ БЕЗОПАСНОСТИ |
| APTA | АССОЦИАЦИЯ ОБЩЕСТВЕННОГО ТРАНСПОРТА АМЕРИКИ |
| ВСУ | ДОПОЛНИТЕЛЬНАЯ СИЛОВАЯ БЛОК |
| AQMD | РАЙОН УПРАВЛЕНИЯ КАЧЕСТВОМ ВОЗДУХА |
| АРАИ | АССОЦИАЦИЯ АВТОМОБИЛЬНЫХ ИССЛЕДОВАНИЙ ИНДИИ |
| ARB | СОВЕТ ВОЗДУШНЫХ РЕСУРСОВ |
| АРЕНА | ИСПЫТАТЕЛЬНАЯ ПЛОЩАДКА (ШВЕЦИЯ) |
| ARFF | ЗАДНИЕ АВТОМАТИЧЕСКИЕ ПРОТИВОТУМАННЫЕ ФОНАРИ |
| ARTC | АВТОМОБИЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНИЧЕСКИЙ ЦЕНТР (ТАЙВАНЬ) |
| ARTEMIS | ОЦЕНКА И НАДЕЖНОСТЬ МОДЕЛЕЙ ТРАНСПОРТНЫХ ВЫБРОСОВ И СИСТЕМ УЧЕТА |
| ИСКУССТВО | СИСТЕМА АДАПТИВНОЙ БЕЗОПАСНОСТИ |
| AS | ПОСЛЕПРОДАЖНЫЙ СЕКТОР |
| ASA | BUNDESVERBAND DER HERSTELLER UND IMPORTEUR VON AUTOMOBIL-SERVICE AUSTUNGEN |
| ASCS | СХЕМА СЕРТИФИКАЦИИ АЭРОКОСМИЧЕСКОГО СЕКТОРА |
| ASD | УСТРОЙСТВО ПРОТИВОСКОЛЬЖЕНИЯ |
| ASE | (НАЦИОНАЛЬНЫЙ ИНСТИТУТ) АВТОМОБИЛЬНОЕ ОБСЛУЖИВАНИЕ (США) |
| ASE | ДОПОЛНИТЕЛЬНОЕ РУЛЕВОЕ ОБОРУДОВАНИЕ |
| ASEP | ДОПОЛНИТЕЛЬНЫЕ ПОЛОЖЕНИЯ ОБ ИЗЛУЧЕНИИ ЗВУКА (РГ ЕЭК) |
| ASG | ГРУППА АВТОМОБИЛЬНЫХ ИССЛЕДОВАНИЙ |
| ASME | АМЕРИКАНСКОЕ ОБЩЕСТВО ИНЖЕНЕРОВ-МЕХАНИКОВ |
| ASN | АБСТРАКТНОЕ СИНТАКСИЧЕСКОЕ ОБОЗНАЧЕНИЕ |
| ASN.1 | ABSTRACT SYNTAX NOTATION ONE |
| ASR | ОСТАТКИ АВТОМОБИЛЬНОГО ИЗМЕЛЬЧИТЕЛЯ |
| ASR | АВТОМАТИЧЕСКОЕ УМЕНЬШЕНИЕ ПРОКЛАДКИ (КОНТРОЛЬ ТЯГИ) |
| ASSI | ПОДДЕРЖКА ВОЗДУШНОЙ БЕЗОПАСНОСТИ, МЕЖДУНАРОДНАЯ |
| ASTM | АМЕРИКАНСКОЕ ОБЩЕСТВО ИСПЫТАНИЙ И МАТЕРИАЛОВ |
| ASV | СРЕДСТВА БЕЗОПАСНОСТИ |
| AT | AUTOTUOJAT (ФИНЛЯНДИЯ) |
| ATA | АККРЕДИТАЦИЯ ТЕХНИКА АВТОМОБИЛЯ |
| ATAG | КОНСУЛЬТАТИВНАЯ ГРУППА ПО ТРАНСПОРТУ СКОРОЙ ПОМОЩИ |
| ATA-MC | СОВЕТ ПО ТЕХОБСЛУЖИВАНИЮ АМЕРИКАНСКОЙ ГРУЗОВОЙ АССОЦИАЦИИ |
| ATB | ВСЕГО КОРПУСА |
| УВД | ТРАНСПОРТНЫЙ СОВЕТ АВСТРАЛИИ |
| УВД | ТЕХНИЧЕСКИЙ КОМИТЕТ ДОБАВОК |
| УВД | АССОЦИАЦИЯ ДОЛЖНОСТНЫХ ЛИЦ ПО ТРАНСПОРТНОЙ КООРДИНАЦИИ |
| ATD | УСТРОЙСТВО ДЛЯ АНТРОПОРМОРФНЫХ ИСПЫТАНИЙ |
| ATEIL | ASSOCIQUE DE L’INDUSTRIE EUROPEENNE DES LUBRIFIANTS |
| ATL | АВТОМАТИЧЕСКАЯ ИСПЫТАТЕЛЬНАЯ ПОЛОСА |
| ATOC | АССОЦИАЦИЯ ОПЕРАЦИОННЫХ ПРЕДПРИЯТИЙ ПО ЖЕЛЕЗНОДОРОЖНОЙ ОБЛАСТИ |
| ATP | МЕЖДУНАРОДНЫЙ ДОГОВОР НА ПЕРЕВОЗКУ БЫТОВЫХ ТОВАРОВ |
| ATPA | ОРГАН ПО ЗАЩИТЕ АВТОМОБИЛЕЙ ОТ КРАЖИ (МИЧИГАН) |
| АЦВР | СИСТЕМА ПОСЛЕ УГОНА ДЛЯ ВОССТАНОВЛЕНИЯ АВТОМОБИЛЯ |
| ATT | ДОПОЛНИТЕЛЬНАЯ ТЕЛЕМАТИКА ДЛЯ ДОРОЖНОГО ТРАНСПОРТА |
| ATV | ТРАНСПОРТНЫЙ ТРАНСПОРТ |
| ATVEA | ЕВРОПЕЙСКАЯ АССОЦИАЦИЯ ПО ВСЕЙ ТРАНСПОРТНОЙ ПРОМЫШЛЕННОСТИ |
| AU | АВТОМОБИЛЬНЫЙ (НАЗНАЧЕНИЕ КОМИТЕТА BSI) |
| АУЭ | АВТОМОБИЛЬНЫЙ ИНЖЕНЕР |
| АУЭ / 9 | ТЕХНИЧЕСКИЙ КОМИТЕТ BSI ПО ДЕТАЛЯМ И ПРИНАДЛЕЖНОСТЯМ АВТОМОБИЛЕЙ |
| AUE / 9/1 | BSI ТЕХНИЧЕСКИЙ КОМИТЕТ ПО АВТОМОБИЛЯМ |
| АУКОЙ | АССОЦИАЦИЯ НЕФТЯНЫХ НЕЗАВИСИМЫХ СОЕДИНЕННОГО КОРОЛЕВСТВА |
| AUTIG | AUTORESERVEDELS-OG TILBEHORS FORENINGEN 1 DANMARK |
| AUWED | ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ ПО ИСПОЛЬЗОВАНИЮ РАБОЧЕГО ОБОРУДОВАНИЯ (95/63 / EEC) |
| AV | БРОШЕННЫЙ АВТОМОБИЛЬ |
| AVC | РАСШИРЕННАЯ КОНЦЕПЦИЯ АВТОМОБИЛЯ |
| AVE | ПОМОЩНИК ЭКСПЕРТАТА |
| AVI | ИНДЕНТИФИКАЦИЯ АВТОМАТИЧЕСКОГО АВТОМОБИЛЯ |
| AVMS | СИСТЕМА МОНИТОРИНГА АВТОМОБИЛЯ |
| АВРО | АССОЦИАЦИЯ СПЕЦИАЛИСТОВ ПО ВОССТАНОВЛЕНИЮ АВТОМОБИЛЕЙ |
| AVSS | РАСШИРЕННАЯ СИСТЕМА БЕЗОПАСНОСТИ АВТОМОБИЛЯ |
| АВТ | ПРИСОЕДИНЕНИЕ АКТИВНОГО КЛАПАНА |
| AWD | ПРИВОД ПОЛНОСТЬЮ |
| AWF | Адаптированный весовой коэффициент |
| AWLREM | АССОЦИАЦИЯ ПРОИЗВОДИТЕЛЕЙ ОБОРУДОВАНИЯ ДЛЯ УПРАВЛЕНИЯ НАГРУЗКОЙ |
| АРМ | ПЛАН ОТХОДОВ (ШОТЛАНДИЯ X 11) |
| AWS | РАСШИРЕННЫЙ ДАТЧИК ВЕСА |
Авария Piper PA-25-235 Pawnee C VH-PXT, 10 июля 1986 г.
ASN Викибаза, происхождение # 31258
Последнее обновление: 26 августа 2021 г.
Эта информация добавлена пользователями ASN.Ни ASN, ни Фонд безопасности полетов не несут ответственности за полноту или правильность этой информации. Если вы считаете, что эта информация неполная или неверная, вы можете отправить исправленную информацию.| Дата: | 10-JUL-1986 |
| Время: | 14:05 |
| Тип: | Piper PA-25-235 Pawnee C |
| Регистрационный номер: | VH-PXT |
| MSN: | 25-4536 |
| Смертельные случаи: | Смертельные случаи: 1 / Люди: 1 | 259 0
| Повреждение самолета: | Списано (повреждение не подлежит ремонту) |
| Категория: | Несчастный случай |
| Местоположение: | Аэродром Беналла (YBLA), Беналла, Виктория — Австралия |
| Фаза: | Неизвестно |
| Тип: | Буксировка баннера и планера |
| Аэропорт вылета: | YBLA |
| YBLA | BASI |
Интенсивные занятия планеризмом проводились как часть курса по пилотированию планера.Для буксировки задействованы два буксирных самолета, и большинство полетов на планерах не превышает 20 минут. Пилот VH-PXT буксировал VH-GVZ примерно на 3000 футов, прежде чем отпустить его и вернуться к следующему планеру. Затем этот самолет был отбуксирован на высоту 3000 футов и выпущен, после чего пилот VH-PXT спустился, чтобы присоединиться к кругообороту движения на участке с подветренной стороны. VH-GVZ к этому времени снизился и также находился на подветренной стороне для посадки. Пилот VH-PXT маневрировал, чтобы присоединиться к последней части этого участка, и свидетели наблюдали, как самолет сближается с VH-GVZ сверху и сзади.Левое крыло самолета ударилось о правую сторону планера, и было видно, что около 75 сантиметров левого крыла висело вертикально, когда самолет вошел в штопор вправо. Это вращение продолжалось до тех пор, пока не произошло столкновение с землей. Инструктор на планере смог удержать управление своим самолетом и совершил безопасную посадку. Было очевидно, что пилот видел планер незадолго до столкновения. Свидетели видели, как самолет начал крутой поворот вправо непосредственно перед тем, как левое крыло ударилось о борт планера.Погодные условия в то время были хорошими, и причину, по которой пилот не увидел планер ранее, установить не удалось. Оба самолета были оснащены подходящими радиостанциями, но, как и другие самолеты в этом районе, не передавали свое местоположение в цепи.
Источники:
https://www.atsb.gov.au/publications/investigation_reports/1986/aair/aair198601425/
https://www.atsb.gov.au/media/33487/aair198601425.pdf
Расследование происшествий :
| ||||||||||||||||||||||||||||||||||||||