📌 Галогены — это… 🎓 Что такое Галогены?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 декабря 2011. |
| Группа → | 17 (VIIA) | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 | |||||||
| 5 | |||||||
| 6 |
| ||||||
| 7 |
| ||||||
Галоге́ны (от греч. ἁλός — соль и γένος — рождение, происхождение; иногда употребляется устаревшее название гало́иды) — химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы)[1].
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
| Фтор F | Хлор Cl | Бром Br | Иод I |
|---|---|---|---|
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F−) = +2,87 В и Eo(Cl2/Cl−) = +1,36 В показывают, что окислить ионы F− и Cl− можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде:
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na
Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения иода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br
Физические свойства галогенов
Фтор является трудносжижаемым, а хлор легкосжижаемым газом с удушливым резким запахом. Энергия связи галогенов сверху вниз по ряду изменяется не равномерно. Фтор имеет аномально низкую энергию связи (151 кДж/моль), это объясняется тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (Cl2 243, Br2 199, I2 150,7, At2117 кДж/моль). От хлора к астату энергия связи постепенно ослабевает, что связано с увеличением атомного радиуса. Аналогичные аномалии имеют и температуры кипения (плавления):
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309[2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
- 2Al + 3F2 = 2AlF3 + 2989 кДж,
- 2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
- Н2 + F2 = 2HF + 547 кДж,
- Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
- Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
- Хе + F2 = XeF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
- 3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
- 2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж,
- 2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж,
- Si + 2Cl2 = SiCl4(Ж) + 662 кДж,
- Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
- Cl2 + hν → 2Cl,
- Cl + Н2 → HCl + Н,
- Н + Cl2 → HCl + Cl,
- Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов (hν), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
- СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
- СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
- Cl2 + 2HBr = 2HCl + Br2,
- Cl2 + 2HI = 2HCl + I2,
- Cl2 + 2KBr = 2KCl + Br2,
а также обратимо реагирует с водой:
- Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
- Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
- 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
- Si + 2Br2 = SiBr4(ж) + 433 кДж,
- Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
- I2 + I− → I−3.
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
- 2Li + At2 = 2LiAt — астатид лития.
А при диссоциации образуются не только протоны, но и ионы At+:HAt диссоц. на:2HAt=H++At—+H—+At+.
Примечания
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 211. — 623 с. — 100 000 экз.
dic.academic.ru
Галогены — это… Соединения галогенов
Здесь читатель найдет сведения о галогенах, химических элементах периодической таблицы Д. И. Менделеева. Содержание статьи позволит вам ознакомиться с их химическими и физическими свойствами, нахождением в природе, способах применения и др.
Общие сведенья
Галогены – это все элементы химической таблицы Д. И. Менделеева, находящиеся в семнадцатой группе. По более строму способу классификации это все элементы седьмой группы, главной подгруппы.

Галогены – это элементы, способные вступать в реакции практически со всеми веществами простого типа за исключением некоторого количества неметаллов. Все они являются энергетическими окислителями, потому в условиях природы, как правило, находятся в смешанной форме с другими веществами. Показатель химической активности галогенов уменьшается с возрастанием их порядковой нумерации.
Галогенами считаются следующие элементы: фтор, хлор, бром, йод, астат и искусственно созданный теннесин.
Как говорилось ранее, все галогены – это окислители с ярко выраженными свойствами, к тому же все они являются неметаллами. Внешний энергетический уровень имеет семь электронов. Взаимодействие с металлами приводит к образованию ионной связи и солей. Почти все галогены, за исключением фтора, могут проявлять себя в качестве восстановителя, достигая высшей окислительной степени +7, однако для этого необходимо, чтобы они взаимодействовали с элементами, имеющими большую степень электроотрицательности.
Особенности этимологии

В 1841 г. шведский ученый-химик Й. Берцелиус предложил ввести термин галогенов, относя к ним известные в то время F, Br, I. Однако до введения этого термина по отношению ко всей группе таких элементов, в 1811 г., немецкий ученый И. Швейггер этим же словом назывался хлор, сам термин переводился с греческого языка как «солерод».
Атомное строение и окислительные степени
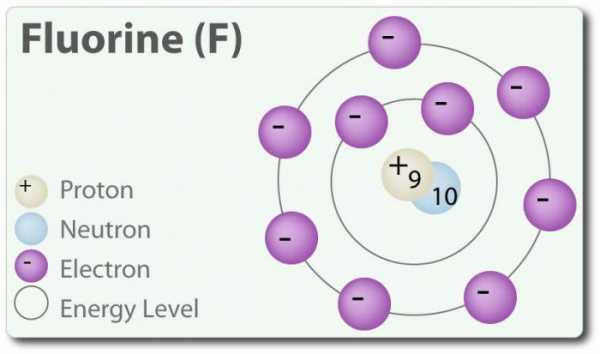
Конфигурация электронов внешней атомной оболочки галогенов имеет следующий вид: астат – 6s26p5, йод – 5s25p5, бром 4s24p5, хлор – 3s23p5, фтор 2s22p5.
Галогены – это элементы, имеющие на электронной оболочке внешнего типа семь электронов, что позволяет им «без особых усилий» присоединять электрон, которого недостаточно для завершения оболочки. Обычно степень окисления проявляется в виде -1. Cl, Br, I и At вступая в реакцию с элементами, имеющими более высокую степень, начинают проявлять положительную окислительную степень: +1, +3, +5, +7. Фтор имеет постоянную окислительную степень -1.
Распространение
Ввиду своей высокой степени реакционной способности галогены обычно находятся в виде соединений. Уровень распространения в коре земли убывает в соответствии с увеличением атомного радиуса от F к I. Астат в коре земли измеряется вовсе в граммах, а теннессин создается искусственно.
Галогены встречаются в природе чаще всего в соединениях галогенидов, а йод также может принимать форму йодата калия или натрия. В связи со своей растворимостью в воде присутствуют в океанических водах и рассолах природного происхождения. F – малорастворимый представитель галогенов и чаще всего обнаруживается в породах осадочного типа, а его главный источник – это фторид кальция.
Физические качественные характеристики
Галогены между собой могут сильно отличаться, и они имеют следующие физические свойства:
- Фтор (F2) – это газ светло-желтого цвета, имеет резкий и раздражающий запах, а также не подвергается сжатию в обычных температурных условиях. Температура плавления равна -220 °С, а кипения -188 °С.
- Хлор (Cl2) представляет собой газ, не сжимающийся при обычной температуре, даже находясь под воздействием давления, имеет удушливый, резкий запах и зелено-желтый окрас. Плавиться начинает при -101 °С, а кипеть при -34 °С.
- Бром (Br2) – это летучая и тяжелая жидкость с буро-коричневым цветом и резким зловонным запахом. Плавится при -7 °С, а кипит при 58 °С.
- Йод (I2) – это вещество твердого типа имеет тёмно-серый окрас, и ему свойственен металлический блеск, запах довольно резкий. Процесс плавления начинается при достижении 113,5 °С, а кипит при 184,885 °С.
- Редкий галоген – это астат (At2), который является твердым веществом и имеет черно-синий цвет с металлическим блеском. Температура плавления соответствует отметке в 244 °С, а кипение начинается после достижения 309 °С.
Химическая природа галогенов
Галогены – это элементы с очень высокой окислительной активностью, которая ослабевает в направлении от F к At. Фтор, будучи самым активным представителем галогенов, реагировать может со всеми видами металлов, не исключая ни один известный. Большинство представителей металлов, попадая в атмосферу фтора, подвергаются самовоспламенению, при этом выделяя теплоту в огромных количествах.
Без подвергания фтора нагреванию он может реагировать с большим количеством неметаллов, например h3, C, P, S, Si. Тип реакций в таком случае является экзотермическим и может сопровождаться взрывом. Нагреваясь, F принуждает окисляться остальные галогены, а подвергаясь облучению, этот элемент способен и вовсе реагировать с тяжелыми газами инертной природы.
Вступая во взаимодействие с веществами сложного типа, фтор вызывает высоко энергетические реакции, например, окисляя воду, он может вызывать взрыв.
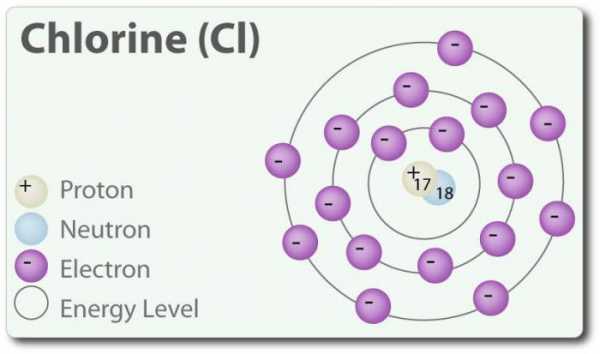
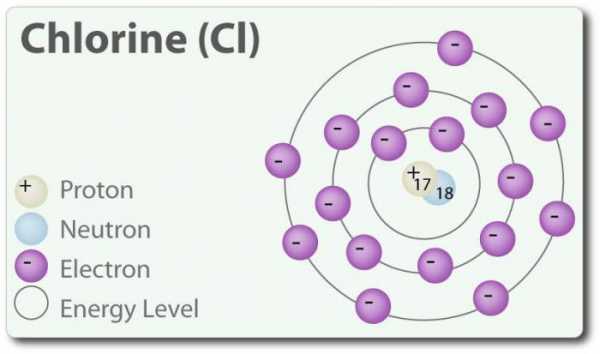
Реакционноспособным может быть и хлор, особенно в свободном состоянии. Уровень активности его меньше, чем у фтора, но он способен реагировать почти со всеми простыми веществам, но азот, кислород и благородные газы в реакцию не вступают с ним. Взаимодействуя с водородом, при нагревании или хорошем освещении хлор создает бурнопротекающую реакцию, сопровождаемую взрывом.
В реакциях присоединения и замещения Cl может реагировать с большим количеством веществ сложного типа. Способен вытеснять Br и I в результате нагревания из соединений, созданных ими с металлом или водородом, а также может вступать в реакцию со щелочными веществами.
Бром химически менее активный, чем хлор или фтор, но все же весьма ярко себя проявляет. Это обусловлено тем, что чаще всего бром Br используется в качестве жидкости, ведь в таком состоянии исходная степень концентрации при остальных одинаковых условиях выше, чем у Cl. Широко используется в химии, особенно органической. Может растворяться в H2O и реагировать с ней частично.
Галоген-элемент иод образует простое вещество I2 и способен вступать в реакции с H2O, растворяется в йодидах растворов, образуя при этом комплексные анионы. От большинства галогенов I отличается тем, что он не вступает в реакции с большинством представителей неметаллов и не спеша реагирует с металлами, при этом его необходимо нагревать. С водородом реагирует, лишь подвергаясь сильному нагреванию, а реакция является эндотермической.
Редкий галоген астат (At) проявляет реакционные способности меньше йода, однако может реагировать с металлами. В результате диссоциации возникают как анионы, так и катионы.
Области применения
Соединения галогенов широко применяются человеком в самых разнообразных областях деятельности. Природный криолит (Na3AlF6) используют для получения Al. Бром и йод в качестве простых веществ часто используют фармацевтические и химические компании. При производстве запчастей для машин часто используют галогены. Фары – это одна из таких деталей. Качественно выбрать материал для данной составной части машины очень важно, так как фары освещают дорогу в ночное время и являются способом обнаружения как вас, так и других автомобилистов. Одним из лучших составных материалов для создания фар считается ксенон. Галоген тем не менее ненамного уступает по качеству этому инертному газу.

Хороший галоген – это фтор, добавка, широко используемая при производстве зубных паст. Он помогает предотвращать возникновение заболевания зубов – кариеса.
Такой элемент-галоген, как хлор (Cl), находит свое применение в получении HCl, часто используется при синтезе органических веществ, таких как пластмасса, каучук, синтетические волокна, красители и растворители и т. д. А также соединения хлора используют в качестве отбеливателей льняного и хлопчатобумажного материала, бумаги и как средство для борьбы с бактериями в питьевой воде.

Внимание! Токсично!
Ввиду наличия очень высокой реакционной способности галогены по праву называются ядовитыми. Наиболее ярко способность к вступлению в реакции выражена у фтора. Галогены имеют ярко выраженные удушающие свойства и способны поражать ткани при взаимодействии.
Фтор в парах и аэрозолях считается одним из самых потенциально опасных форм галогенов, вредоносных для окружающих живых существ. Это связано с тем, что он слабо воспринимается обонянием и ощущается лишь по достижении большой концентрации.
Подводя итоги
Как мы видим, галогены являются очень важной частью периодической таблицы Менделеева, они имеют множество свойств, отличаются между собой по физическим и химическим качествам, атомному строению, степени окисления и способности реагировать с металлами и неметаллами. В промышленности используются разнообразным образом, начиная от добавок в средства личной гигиены и заканчивая синтезом веществ органической химии или отбеливателями. Несмотря на то что одним из лучших способов поддержания и создания света в фаре автомобиля является ксенон, галоген тем не менее ему практически не уступает и также широко используется и имеет свои преимущества.
Теперь вы знаете, что такое галоген. Сканворд с любыми вопросами об этих веществах для вас уже не помеха.
fb.ru
📌 ГАЛОГЕНЫ — это… 🎓 Что такое ГАЛОГЕНЫ?
Хорошим хлорирующим агентом является CCl4, например для превращения BeO в BeCl2. Для фторирования хлоридов часто применяют SbF3 (см. выше SO2ClF).
Галогены реагируют со многими галогенидами металлов с образованием полигалогенидов соединений, содержащих крупные анионные частицы Xn1. Например:
Первая реакция дает удобный метод получения высококонцентрированного раствора I2 путем добавления иода к концентрированному раствору KI. Полииодиды сохраняют свойства I2. Возможно также получение смешанных полигалогенидов: RbI + Br2 -> RbIBr2 RbIСl2 + Cl2 -> RbICl4
Растворимость. Галогены обладают некоторой растворимостью в воде, однако, как и следовало ожидать, из-за ковалентного характера связи XX и малого заряда растворимость их невелика. Фтор настолько активен, что оттягивает электронную пару от кислорода воды, при этом выделяется свободный O2 и образуются OF2 и HF. Хлор менее активен, но в реакции с водой получается некоторое количество HOCl и HCl. Гидраты хлора (например, Cl2*8h3O) могут быть выделены из раствора при охлаждении.
Иод проявляет необычные свойства при растворении в различных растворителях. При растворении небольших количеств иода в воде, спиртах, кетонах и других кислородсодержащих растворителях образуется раствор коричневого цвета (1%-ный раствор I2 в спирте обычный медицинский антисептик). Раствор иода в CCl4 или других бескислородных растворителях имеет фиолетовую окраску. Можно полагать, что в таком растворителе молекулы иода ведут себя подобно их состоянию в газовой фазе, которая имеет такую же окраску. В кислородсодержащих растворителях происходит оттягивание электронной пары кислорода на валентные орбитали иода.
Оксиды. Галогены образуют оксиды. Никакой систематической закономерности или периодичности в свойствах этих оксидов не наблюдается. Сходство и различия, а также основные способы получения оксидов галогенов указаны в табл. 8б.
Оксокислоты галогенов. При образовании оксокислот более четко проявляется систематичность галогенов. Галогены образуют галогеноватистые кислоты HOX, галогенистые кислоты HOXO, галогеноватые кислоты HOXO2 и галогеновые кислоты HOXO3, где X галоген. Но только хлор образует кислоты всех указанных составов, а фтор вообще не образует оксокислот, бром не образует HBrO4. Составы кислот и основные способы их получения указаны в табл. 8в.
Все кислоты галогенов неустойчивы, однако чистая HOClO3 наиболее стабильна (в отсутствие любых восстановителей). Все оксокислоты являются сильными окислителями, но скорость окисления необязательно зависит от степени окисления галогена. Так, HOCl (ClI) быстрый и эффективный окислитель, а разбавленная HOClO3 (ClVII) нет. В целом, чем выше степень окисления галогена в оксокислоте, тем сильнее кислота, поэтому HClO4 (ClVII) наиболее сильная из известных оксокислот в водном растворе. Ион ClO4, образующийся при диссоциации кислоты в воде, наиболее слабый из отрицательных ионов донор электронной пары. Гипохлориты Na и Ca находят промышленное применение при отбеливании и водоочистке. Межгалогенные соединения соединения различных галогенов друг с другом. Галоген с большим радиусом всегда имеет в таком соединении положительную степень окисления (подвергается окислению), а с меньшим радиусом более отрицательную (подвергается восстановлению). Этот факт вытекает из общей тенденции изменения активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных соединений (А галоген с более положительной степенью окисления).
Межгалогенные соединения образуются прямым синтезом из элементов. Необычная для иода степень окисления 7 реализуется в соединении IF7, а другие галогены не могут координировать 7 атомов фтора. Прикладное значение имеют BrF3 и ClF3 жидкие вещества, химически аналогичные фтору, но более удобные при фторировании. При этом более эффективен BrF3. Поскольку трифториды сильные окислители и находятся в жидком состоянии, их используют как окислители ракетного топлива.
Водородные соединения. Галогены реагируют с водородом, образуя HX, причем со фтором и хлором реакция протекает со взрывом при небольшой активации ее. Медленнее идет взаимодействие c Br2 и I2. Для протекания реакции с водородом достаточно активировать небольшую долю реагентов с помощью освещения или нагревания. Активированные частицы взаимодействуют с неактивированными, образуя HX и новые активированные частицы, которые продолжают процесс, а реакция двух активированных частиц по главной реакции заканчивается образованием продукта. Например, образование HCl из h3 и Cl2:
Более удобные методы получения галоиодоводородов, чем прямой синтез, дают, например, следующие реакции:
В газообразном состоянии HX являются ковалентными соединениями, однако в водном растворе они (за исключением HF) становятся сильными кислотами. Объясняется это тем, что молекулы воды эффективно оттягивают водород от галогена. Все кислоты хорошо растворимы в воде благодаря гидратации: HX + h3O -> h4O+ + X
HF более склонен к комплексообразованию, чем другие галогеноводороды. Заряды на H и F так велики, а эти атомы так малы, что происходит образование HX-ассоциатов типа полимеров состава (HF)x, где x і 3. В таком растворе диссоциация под действием молекулы воды идет не более чем на несколько процентов от общего количества ионов водорода. В отличие от других галогеноводородов фтороводород активно реагирует с SiO2 и силикатами, выделяя газообразный SiF4. Поэтому водный раствор HF (плавиковая кислота) используют в травлении стекла и хранят не в стеклянной, а в парафиновой или полиэтиленовой посуде. Чистый HF кипит чуть ниже комнатной температуры (19,52° С), поэтому его хранят в виде жидкости в стальных цилиндрах. Водный раствор HCl называют соляной кислотой. Насыщенный раствор, содержащий 36% (масс.) HCl, широко используют в химической промышленности и лабораториях (см. также ВОДОРОД).
Астат. Этот химический элемент семейства галогенов имеет символ At и атомный номер 85, он существует только в следовых количествах в некоторых минералах. Еще в 1869 Д.И.Менделеев предсказал его существование и возможность открытия в будущем. Астат был открыт Д.Корсоном, К.Маккензи и Э.Сегре в 1940. Известно более 20 изотопов, из которых наиболее долгоживущие 210At и 211At. По некоторым данным, при бомбардировке 20983Bi ядрами гелия образуется изотоп астат-211; сообщалось, что астат растворим в ковалентных растворителях, может образовывать At, как и другие галогены, и, вероятно, возможно получение иона AtO4. (Эти данные удалось получить на растворах с концентрацией 1010 моль/л.)
Энциклопедия Кольера. — Открытое общество. 2000.
- ХАЛЬКОГЕНЫ
- ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
Смотреть что такое «ГАЛОГЕНЫ» в других словарях:
ГАЛОГЕНЫ — ГАЛОГЕНЫ, химические элементы VII группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At. Фтор и хлор газы, бром жидкость, остальные кристаллы. Все галогены, кроме At, широко распространены в природе входят в состав многих… … Современная энциклопедия
ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Галогены… … Научно-технический энциклопедический словарь
ГАЛОГЕНЫ — (устар. выражение галоиды) химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals соль и genes рождающий (при соединении с металлами… … Большой Энциклопедический словарь
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
ГАЛОГЕНЫ — общее название пяти хим. элементов, составляющих VII подгруппу Периодической системы элементов Д. И. Менделеева, фтора, хлора, брома, йода и астата. Все Г. неметаллы, их молекулы двухатомны; Г. реагируют со всеми простыми веществами, являются… … Большая политехническая энциклопедия
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
ГАЛОГЕНЫ — ГАЛОИДЫ ИЛИ ГАЛОГЕНЫ химические элементы: хлор, иод, бром, фтор, образующие с металлами соли без кислорода, напр. хлористый натрий (повар. соль). Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГАЛОИДЫ или ГАЛОГЕНЫ … Словарь иностранных слов русского языка
галогены — ов; мн. (ед. галоген, а; м.). [от греч. hals соль и genesis род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, ая, ое. Г ые соединения. Г ая лампа (лампа… … Энциклопедический словарь
галогены — halogenai statusas T sritis chemija apibrėžtis F, Cl, Br, I, (At). atitikmenys: angl. halogens; haloid elements; haloids rus. галогены … Chemijos terminų aiškinamasis žodynas
Галогены — (от греч. hals соль и… genes рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы Г. по свойству давать соли при… … Большая советская энциклопедия
Книги
- Комплект таблиц. Химия. Неметаллы (18 таблиц), Учебный альбом из 18 листов. Арт. 5-8688-018 Галогены. Химия галогенов. Сера. Аллотропия. Химия серы. Серная кислота. Химия азота. Оксиды азота. Азотная кислота – окислитель. Фосфор.… Категория: Плакаты, наглядные пособия, карты Серия: Учебные таблицы. Химия Издатель: Спектр (пособия), Подробнее Купить за 4689 руб
- Тесты по химии. Азот и фосфор. Углерод и кремний. Металлы. 9 класс. К учебнику Г.Е.Рудзитиса. ФГОС, Боровских Татьяна Анатольевна, Данное пособие полностью соответствует федеральному государственному образовательному стандарту (второго поколения). Пособие включает тесты, охватывающие 3 темы учебника Г. Е. Рудзитиса,… Категория: Справочники, тесты, сборники задач по химии Серия: Учебно-методический комплект Издатель: Экзамен, Подробнее Купить за 115 руб
- Тесты по химии Классификация химических реакций Химические реакции в водных растворах Галогены Кислород и сера 9 класс К учебнику Г Е Рудзитиса Ф Г Фельдмана Химия 9 класс, Боровских Т., Данное пособие полностью соответствует федеральному государственному образовательному стандарту (второго поколения). Пособие включает тесты, охватывающие темы учебника Г.Е. Рудзитиса, Ф.Г.… Категория: Химия Подробнее Купить за 115 руб
dic.academic.ru
Галогены

Модуль V
Химия Элементов
Неметаллы VIIА-подгруппы
Элементы VIIА-подгруппы являются типичными неметаллами с высокой
электротрицательностью, они имеют групповое название – «галогены».
Основные вопросы, рассматриваемые в лекции
Общая характеристика неметаллов VIIА-подгруппы. Электронное строение, важнейшие характеристики атомов. Наиболее характерные сте-
пени окисления. Особенности химии галогенов.
Простые вещества.
Природные соединения.
Соединения галогенов
Галогенводородные кислоты и их соли. Соляная и плавиковая ки-
слота, получение и применение.
Галогенидные комплексы.
Бинарные кислородные соединения галогенов. Неустойчивость ок-
сидов.
Кислородсодержащие кислоты и их соли
Окислительно-восстановительные свойства простых веществ и со-
единений. Реакции диспропорционирования. Диаграммы Латимера.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Химия элементов VIIA-подгруппы
Общая характеристика
|
| периоды |
|
|
|
| группа | |
|
|
|
| ряды |
| VII | ||
|
|
|
|
|
|
| ||
|
|
|
|
|
|
| F | 9 |
| II | 2 |
| Фтор | ||||
|
|
|
|
|
|
| 18,998 | |
|
|
|
|
|
|
| Cl | 17 |
| III | 3 |
| Хлор | ||||
|
|
|
|
|
|
| 35,453 | |
|
|
|
|
|
|
| 25 | Mn |
|
|
|
| 4 |
| Марганец | ||
| IV |
|
|
| 54,938 | |||
|
|
|
| Br | 35 | |||
|
|
|
|
|
|
| ||
|
|
|
| 5 |
| Бром | ||
|
|
|
|
|
|
| 79,904 | |
|
|
|
|
|
|
| 43 | Tc |
|
|
|
| 6 |
| Технеций | ||
| V |
|
|
| 98,906 | |||
|
|
|
| I | 53 | |||
|
|
|
|
|
|
| ||
|
|
|
| 7 |
| Йод |
| |
|
|
|
|
|
|
| 126,905 | |
|
|
|
|
|
|
| 75 | Re |
|
|
|
| 8 |
| Рений | ||
| VI |
|
|
| 186,207 | |||
|
|
|
| At | 85 | |||
|
|
|
|
|
|
| ||
|
|
|
| 9 |
| Астат | ||
|
|
|
|
|
|
| [210] |
|
|
|
|
|
|
|
| 107 | Bh |
| VII | 10 |
| Борий | ||||
|
|
|
|
|
|
| [262] |
|
VIIА-группу образуют р-элементы: фтор F, хлор
Cl, бром Br, иод I и астат At.
Общая формула валентных электронов – ns2np5.
Все элементы VIIА-группы – типичные неметаллы.
| ns |
|
| np |
| Как видно из распреде- | |
|
|
|
|
|
|
| ления валентных электронов |
| |
| | |
| | |
|
|
|
|
|
|
|
|
по орбиталям атомам | не хватает всего одного электрона | ||||||
для формирования устойчивой восьмиэлектронной обо-
лочки, поэтому у них сильно выражена тенденция к
присоединению электрона.
Все элементы легко образуют простые однозаряд-
ные анионы Г –.
В форме простых анионов элементы VIIА-группы находятся в природной воде и в кристаллах природных солей, например, галита NaCl, сильвина KCl, флюорита
CaF2.
Общее групповое название элементов VIIА-
группы «галогены», т. е. «рождающие соли», связано с тем, что большинство их соединений с металлами пред-
ставляет собой типичные соли (CaF2, NaCl, MgBr2, KI), ко-
торые могут быть получены при непосредственном взаи-
модействии металла с галогеном. Свободные галогены получают из природных солей, поэтому название «галогены» также переводят, как «рожденные из солей».
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Минимальная степень окисления (–1) является наиболее устойчивой
у всех галогенов.
Некоторые характеристики атомов элементов VIIА-группы приведены в
таблице.
Таблица
Важнейшие характеристики атомов элементов VIIА-группы
Эле- | Радиус | Относитель- | Первая | Сродство |
|
|
|
мент | атома, | ная электро- | энергия | к элек- |
|
|
|
| нм | отрицатель- | ионизации, | трону, |
|
|
|
|
| ность (по | кДж/моль | кДж/моль |
|
|
|
|
| Поллингу) |
|
|
|
|
|
F | 0,064 | 4,0 | 1682 | 333 |
| увеличение числа |
|
Cl | 0,099 | 3,16 | 1255 | 345 |
| электронных слоев; |
|
Br | 0,114 | 2,96 | 1143 | 325 |
| увеличение размера |
|
I | 0,133 | 2,66 | 1009 | 290 |
| атома; |
|
At | – | 2,0 | 889 | 270 |
| уменьшение элек- |
|
|
|
|
|
|
| троотрицательности |
|
Галогены отличаются высоким сродством к электрону (максимальным у
Cl) и очень большой энергией ионизации (максимальной у F) и максимально
возможной в каждом из периодов электроотрицательностью. Фтор – самый
электроотрицательный из всех химических элементов.
Наличие одного неспаренного электрона в атомах галогенов обуславли-
вает объединение атомов в простых веществах в двухатомные молекулы Г2.
Для простых веществ галогенов наиболее характерны окислитель-
ные свойства, наиболее сильные у F2 и ослабевающие при переходе к I2.
Галогены характеризуются наибольшей реакционной способностью из всех неметаллических элементов. Фтор даже среди галогенов выделя-
ется чрезвычайно высокой активностью.
Элемент второго периода – фтор наиболее сильно отличается от дру-
гих элементов подгруппы. Это общая закономерность для всех неметаллов.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фтор, как самый электроотрицательный элемент, не проявляет поло-
жительных степеней окисления. В любых соединениях, в том числе с ки-
слородом, фтор находится в степени окисления (-1).
Все остальные галогены проявляют положительные степени окис-
ления вплоть до максимальной +7.
Наиболее характерные степени окисления галогенов:
F : -1, 0;
Cl, Br, I: -1, 0, +1, +3, +5, +7.
У Cl известны оксиды, в которых он находится в степенях окисления: +4 и +6.
Наиболее важными соединениями галогенов, в положительных сте-
пенях окисления, являются кислородсодержащие кислоты и их соли.
Все соединения галогенов в положительных степенях окисления яв-
ляются сильными окислителями.
Для соединений | галогенов в промежуточных степенях окисления | и |
для простых веществ | характерны реакции диспропорционирования. | В |
этих реакциях галоген | одновременно и понижает и увеличивает свою проме- | |
жуточную степень окисления. Диспропорционированию способствует щелочная среда.
Практическое применение простых веществ и кислородных соедине-
ний галогенов связано главным образом с их окислительным действием.
Самое широкое практическое применение находят простые вещества Cl2
и F2. Наибольшее количество хлора и фтора расходуется в промышленном ор-
ганическом синтезе: в производстве пластмасс, хладоагентов, растворителей,
ядохимикатов, лекарств. Значительное количество хлора и йода используется для получения металлов и для их рафинирования. Хлор используется также
для отбеливания целлюлозы, для обеззараживания питьевой воды и в произ-
водстве хлорной извести и соляной кислоты. Соли оксокислот используются в производстве взрывчатых веществ.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Широкое практическое применение находят кислоты – соляная и плави-
ковая.
Фтор и хлор принадлежат к двадцати самым распространенным элемен-
там, значительно меньше в природе брома и иода. Все галогены находятся в природе в степени окисления (–1). Лишь йод встречается в виде соли KIO3,
которая как примесь входит в чилийскую селитру (KNO3).
Астат – искусственно полученный радиоактивный элемент (его нет в природе). Неустойчивость At отражается в названии, которое происходит от греч. «астатос» – «неустойчивый». Астат является удобным –излучателем для радиотерапии раковых опухолей.
Простые вещества
Простые вещества галогенов образованы двухатомными молекулами Г2.
В простых веществах при переходе от F2 к I2 с увеличением числа элек-
тронных слоев и возрастанием поляризуемости атомов происходит усиление
межмолекулярного взаимодействия, приводящее к изменению агрегатного со-
стояния при стандартных условиях.
Фтор (при обычных условиях) – желтый газ, при –181оС переходит в
жидкое состояние.
Хлор – желто-зеленый газ, переходит в жидкость при –34оС. С цветом га-
за связано название Cl, оно происходит от греческого «хлорос» – «желто–
зеленый». Резкое повышение температуры кипения у Cl2 по сравнению с F2,
указывает на усиление межмолекулярного взаимодействия.
Бром – темно-красная, очень летучая жидкость, кипит при 58,8оС. На-
звание элемента связано с резким неприятным запахом газа и образовано от
«бромос» – «зловонный».
Йод – темно-фиолетовые кристаллы, со слабым «металлическим» бле-
ском, которые при нагревании легко возгоняется, образуя фиолетовые пары;
при быстром охлаждении | паров до 114оС |
| образуется жидкость. Температура | ||||||||||||||||
Исполнитель: |
|
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кипения йода равна 183оС. От цвета паров йода происходит его название –
«иодос» – «фиолетовый».
Все простые вещества имеют резкий запах и являются ядовитыми.
Вдыхание их паров вызывает раздражение слизистых оболочек и дыхательных органов, а при больших концентрациях – удушье. Во время первой мировой войны хлор применяли в качестве отравляющего вещества.
Газообразный фтор и жидкий бром вызывают ожоги кожи. Работая с га-
логенами, следует соблюдать меры предосторожности.
Поскольку простые вещества галогенов образованы неполярными моле-
кулами, они хорошо растворяются в неполярных органических растворителях:
спирте, бензоле, четыреххлористом углероде и т. п. В воде хлор, бром и иод ограниченно растворимы, их водные растворы называют хлорной, бромной и иодной водой. Лучше других растворяется Br2, концентрация брома в насы-
щенном растворе достигает 0,2 моль/л, а хлора – 0,1 моль/л.
Фтор разлагает воду:
2F2 + 2h3O = O2 + 4HF
Галогены проявляют высокую окислительную активность и перехо-
дят в галогенидные анионы.
Г2 + 2e– 2Г–
Особенно высокой окислительной активностью обладает фтор. Фтор окисляет благородные металлы (Au, Pt).
Pt + 3F2 = PtF6
Взаимодействует даже с некоторыми инертными газами (криптоном,
ксеноном и радоном), например,
Xe + 2F2 = XeF4
В атмосфере F2 горят многие очень устойчивые соединения, например,
вода, кварц (SiO2).
SiO2 + 2F2 = SiF4 + O2
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

В реакциях с фтором даже такие сильные окислители, как азотная и сер-
ная кислота, выступают в роли восстановителей, при этом фтор окисляет вхо-
дящий в их состав О(–2).
2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 h3SO4 + 4F2 = SF6 + 2HF + 2O2
Высокая реакционная способность F2 создает трудности с выбором кон-
струкционных материалов для работы с ним. Обычно для этих целей использу-
ют никель и медь, которые, окисляясь, образуют на своей поверхности плотные защитные пленки фторидов. Название F связано с его агрессивным действи-
ем, оно происходит от греч. «фторос» – «разрушающий».
В ряду F2, Cl2, Br2, I2 окислительная способность ослабевает из-за уве-
личения размера атомов и уменьшения электроотрицательности.
В водных растворах окислительные и восстановительные свойства ве-
ществ обычно характеризуют с помощью электродных потенциалов. В таблице приведены стандартные электродные потенциалы (Ео, В) для полуреакций вос-
становления галогенов. Для сравнения также приведено значение Ео для ки-
слорода – самого распространенного окислителя.
Таблица
Стандартные электродные потенциалы для простых веществ галогенов
Элемент |
| F |
|
| Cl |
|
| Br |
|
| I |
| Ео, В, для реакции |
|
|
|
|
|
|
|
|
| O2+ 4e– + 4H+ 2h3O | ||||
|
|
|
|
|
|
|
|
|
|
|
|
| |
Ео, В |
|
|
|
|
|
|
|
|
|
|
|
|
|
для электродной | +2,87 |
| +1,36 |
| +1,02 |
| +0,54 | +1,23 | |||||
реакции |
|
|
| ||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| |
2Г– +2е – = Г2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уменьшение окислительной активности
Как видно из таблицы, F2 – окислитель значительно более сильный,
чем О2, поэтому F2 в водных растворах не существует, он окисляет воду,
восстанавливаясь до F–. Судя по значению Eо окислительная способность Cl2
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
также выше, чем у О2. Действительно при длительном хранении хлорной воды происходит ее разложение с выделением кислорода и с образованием HCl. Но реакция идет медленно (молекула Cl2 заметно прочнее, чем молекула F2 и
энергия активации для реакций с хлором выше), быстрее происходит диспро-
порционирование:
Cl2 + h3O HCl + HOCl
В воде оно не доходит до конца (К = 3,9 .10–4), поэтому Cl2 существует в водных растворах. Еще большей устойчивостью в воде характеризуются Br2 и I2.
Диспропорционирование это очень характерная окислительно-
восстановительная реакция для галогенов. Диспропорционирование уси-
ливается в щелочной среде.
Диспропорционирование Cl2 в щелочи приводит к образованию анионов
Cl– и ClO–. Константа диспропорционирования равна 7,5 . 1015.
Cl2 + 2NaOH = NaCl + NaClO + h3O
При диспропорционировании йода в щелочи образуются I– и IO3–. Ана-
логично йоду диспропорционирует Br2. Изменение продукта диспропорцио-
нирования обусловлено тем, что анионы ГО– и ГО2– у Br и I неустойчивы.
Реакция диспропорционирования хлора используется в промышленно-
сти для получения сильного и быстро действующего окислителя гипохлорита,
белильной извести, бертолетовой соли.
Белильную известь получают по реакции: |
| |
Cl2 + Ca(OH)2 | = CaCl(ClO) + h3O | |
При диспропорционировании Cl2 в | горячем растворе щелочи образуется бер- | |
толетова соль KClO3, выпадающая в осадок после охлаждения раствора. | ||
0 | –1 | +5 |
3Cl2 + 6 KOH = 5KCl + KClO3 + 3h3O
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Взаимодействие галогенов с металлами
Галогены энергично взаимодействуют со многими металлами, например:
Mg + Cl2 = MgCl2 Ti + 2I2 TiI4
ГалогенидыNa+, в которых металл имеет низкую степень окисления (+1, +2),
– это солеобразные соединения с преимущественно ионной связью. Как прави-
ло, ионные галогениды – это твердые вещества с высокой температурой плав-
ления.
Галогениды металлов, в которых металл имеет высокую степень окисле-
ния, – это соединения с преимущественно ковалентной связью.
Многие из них при обычных условиях являются газами, жидкостями или легкоплавкими твердыми веществами. Например, WF6 – газ, MoF6 – жидкость,
TiCl4 – жидкость.
Взаимодействие галогенов с неметаллами
Галогены непосредственно взаимодействуют со многими неметаллами:
водородом, фосфором, серой и др. Например:
h3 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6
Связь в галогенидах неметаллов преимущественно ковалентная.
Обычно эти соединения имеют невысокие температуры плавления и кипения.
При переходе от фтора к йоду ковалентный характер галогенидов усиливается.
Ковалентные галогениды типичных неметаллов являются кислотными соединениями; при взаимодействии с водой они гидролизуются с образованием кислот. Например:
PBr3 + 3h3O = 3HBr + h4PO3
PI3 + 3h3O = 3HI + h4PO3
PCl5 + 4h3O = 5HCl + h4PO4
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Две первые реакции используются для получения бромо- и иодоводород-
ной кислоты.
Интергалиды. Галогены, соединяясь друг с другом, образуют интерга-
лиды. В этих соединениях более легкий и более электроотрицательный галоген находится в степени окисления (–1), а более тяжелый – в положительной сте-
пени окисления.
За счет непосредственного взаимодействия галогенов при нагревании получаются: ClF, BrF, BrCl, ICl. Существуют и более сложные интергалиды:
ClF3, BrF3, BrF5, IF5, IF7, ICl3.
Все интергалиды при обычных условиях – жидкие вещества с низкими температурами кипения. Интергалиды имеют высокую окислительную ак-
тивность. Например, в парах ClF3 горят такие химически устойчивые вещества, как SiO2, Al2O3, MgO и др.
2Al2O3 + 4ClF3 = 4 AlF3 + 3O2 + 2Cl2
Фторид ClF3 – агрессивный фторирующий реагент, действующий быст-
рее F2. Его применяют в органических синтезах и для получения защитных пленок на поверхности никелевой аппаратуры для работы с фтором.
В воде интергалиды гидролизуются с образованием кислот. Например,
ClF5 + 3h3O = HClO3 + 5HF
Галогены в природе. Получение простых веществ
В промышленности галогены получают из их природных соединений. Все
процессы получения свободных галогенов основаны на окислении галоге-
нид-ионов.
2Г – Г2 + 2e–
Значительное количество галогенов находится в природных водах в виде анионов: Cl–, F–, Br –, I–. В морской воде может содержаться до 2,5 % NaCl.
Бром и иод получают из воды нефтяных скважин и морской воды.
Исполнитель: |
| Дата: |
|
|
|
|
|
|
|
|
|
| Мероприятие № | 4 | 2 | 7 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
studfiles.net
физические свойства, химические свойства. Применение галогенов и их соединений
Галогены в периодической таблице расположены слева от благородных газов. Эти пять токсических неметаллических элементов входят в 7 группу периодической таблицы. К ним относятся фтор, хлор, бром, йод и астат. Хотя астат радиоактивен и имеет только короткоживущие изотопы, он ведет себя, как йод, и его часто причисляют к галогенам. Поскольку галогенные элементы имеют семь валентных электронов, им необходим лишь один дополнительный электрон для образования полного октета. Эта характеристика делает их более активными, чем другие группы неметаллов.
Общая характеристика
Галогены образуют двухатомные молекулы (вида Х2, где Х обозначает атом галогена) – устойчивую форму существования галогенов в виде свободных элементов. Связи этих двухатомных молекул являются неполярными, ковалентными и одинарными. Химические свойства галогенов позволяют им легко вступать в соединение с большинством элементов, поэтому они никогда не встречаются в несвязанном виде в природе. Фтор – наиболее активный галоген, а астат – наименее.
Все галогены образуют соли I группы с похожими свойствами. В этих соединениях галогены присутствуют в виде галоидных анионов с зарядом -1 (например, Cl—, Br—). Окончание -ид указывает на наличие галогенид-анионов; например Cl— называется «хлорид».
Кроме того, химические свойства галогенов позволяют им действовать в качестве окислителей – окислять металлы. Большинство химических реакций, в которых участвуют галогены – окислительно-восстановительные в водном растворе. Галогены образуют одинарные связи с углеродом или азотом в органических соединениях, где степень их окисления (СО) равна -1. Когда атом галогена замещён ковалентно-связанным атомом водорода в органическом соединении, префикс гало- может быть использован в общем смысле, или префиксы фтор-, хлор-, бром- , йод- – для конкретных галогенов. Галогенные элементы могут иметь перекрёстную связь с образованием двухатомных молекул с полярными ковалентными одинарными связями.
Хлор (Cl2) стал первым галогеном, открытым в 1774 г., затем были открыты йод (I2), бром (Br2), фтор (F2) и астат (At, обнаружен последним, в 1940 г.). Название «галоген» происходит от греческих корней hal- («соль») и -gen («образовывать»). Вместе эти слова означают «солеобразующий», подчёркивая тот факт, что галогены, вступая в реакцию с металлами, образуют соли. Галит – это название каменной соли, природного минерала, состоящего из хлорида натрия (NaCl). И, наконец, галогены используются в быту – фторид содержится в зубной пасте, хлор обеззараживает питьевую воду, а йод содействует выработке гормонов щитовидной железы.
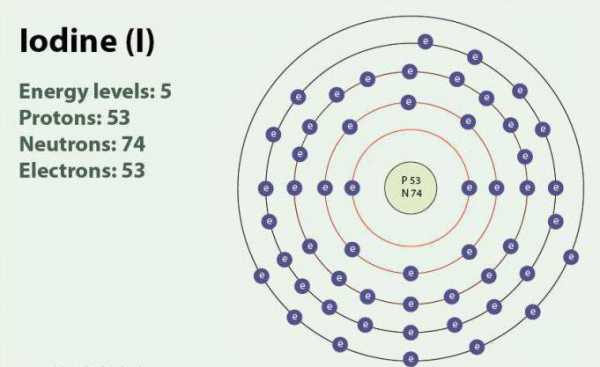
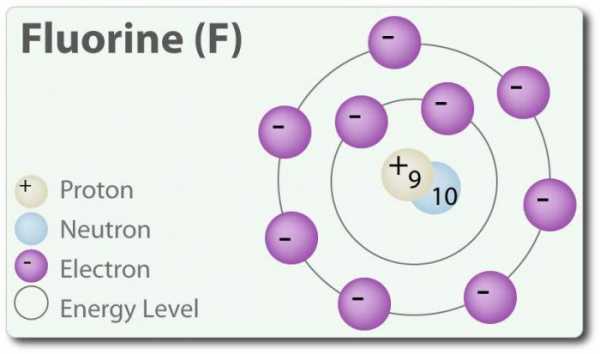
Химические элементы
Фтор – элемент с атомным номером 9, обозначается символом F. Элементарный фтор впервые был обнаружен в 1886 г. путем выделения его из плавиковой кислоты. В свободном состоянии фтор существует в виде двухатомной молекулы (F2) и является наиболее распространенным галогеном в земной коре. Фтор – наиболее электроотрицательный элемент в периодической таблице. При комнатной температуре является бледно-жёлтым газом. Фтор также имеет относительно небольшой атомный радиус. Его СО – -1, за исключением элементарного двухатомного состояния, в котором его степень окисления равна нулю. Фтор чрезвычайно химически активен и непосредственно взаимодействует со всеми элементами, кроме гелия (He), неона (Ne) и аргона (Ar). В растворе H2O, плавиковой кислоты (HF) является слабой кислотой. Хотя фтор сильно электроотрицателен, его электроотрицательность не определяет кислотность; HF является слабой кислотой в связи с тем, что ион фтора основной (рН> 7). Кроме того, фтор производит очень мощные окислители. Например, фтор может вступать в реакцию с инертным газом ксеноном и образует сильный окислитель дифторид ксенона (XeF2). У фтора множество применений.
Хлор – элемент с атомным номером 17 и химическим символом Cl. Обнаружен в 1774 г. путём выделения его из соляной кислоты. В своём элементарном состоянии он образует двухатомную молекулу Cl2. Хлор имеет несколько СО: -1, +1, 3, 5 и 7. При комнатной температуре он является светло-зеленым газом. Так как связь, которая образуется между двумя атомами хлора, является слабой, молекула Cl2 обладает очень высокой способностью вступать в соединения. Хлор реагирует с металлами с образованием солей, которые называются хлориды. Ионы хлора являются наиболее распространенными ионами, они содержатся в морской воде. Хлор также имеет два изотопа: 35Cl и 37Cl. Хлорид натрия является наиболее распространенным соединением из всех хлоридов.
Бром – химический элемент с атомным номером 35 и символом Br. Впервые был обнаружен в 1826 г. В элементарной форме бром является двухатомной молекулой Br2. При комнатной температуре представляет собой красновато-коричневую жидкость. Его СО – -1, + 1, 3, 4 и 5. Бром более активен, чем йод, но менее активен, чем хлор. Кроме того, бром имеет два изотопа: 79Вг и 81Вг. Бром встречается в виде солей бромида, растворённых в морской воде. За последние годы производство бромида в мире значительно увеличилось благодаря его доступности и продолжительному времени жизни. Как и другие галогены, бром является окислителем и очень токсичен.
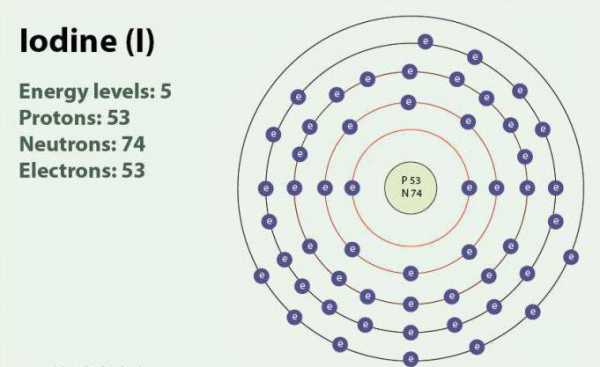
Йод – химический элемент с атомным номером 53 и символом I. Йод имеет степени окисления: -1, +1, +5 и +7. Существует в виде двухатомной молекулы, I2. При комнатной температуре является твёрдым веществом фиолетового цвета. Йод имеет один стабильный изотоп — 127I. Впервые обнаружен в 1811 г. с помощью морских водорослей и серной кислоты. В настоящее время ионы йода, могут быть выделены в морской воде. Несмотря на то что йод не очень хорошо растворим в воде, его растворимость может возрасти при использовании отдельных йодидов. Йод играет важную роль в организме, участвуя в выработке гормонов щитовидной железы.

Астат – радиоактивный элемент с атомным номером 85 и символом At. Его возможные степени окисления: -1, +1, 3, 5 и 7. Единственный галоген, не являющийся двухатомной молекулой. В нормальных условиях является металлическим твёрдым веществом чёрного цвета. Астат является очень редким элементом, поэтому о нём известно немного. Кроме того, астат имеет очень короткий период полураспада, не дольше нескольких часов. Получен в 1940 г. в результате синтеза. Полагают, что астат похож на йод. Отличается металлическими свойствами.
В таблице ниже показано строение атомов галогенов, структура внешнего слоя электронов.
Галоген | Конфигурация электронов |
Фтор | 1s2 2s2 2p5 |
Хлор | 3s2 3p5 |
Бром | 3d10 4s2 4p5 |
Иод | 4d10 5s2 5p5 |
Астат | 4f14 5d10 6s2 6p5 |
Подобное строение внешнего слоя электронов обусловливает то, что физические и химические свойства галогенов похожи. Вместе с тем при сопоставлении этих элементов наблюдаются и различия.
Периодические свойства в группе галогенов
Физические свойства простых веществ галогенов изменяются с повышением порядкового номера элемента. Для лучшего усвоения и большей наглядности мы предлагаем вам несколько таблиц.
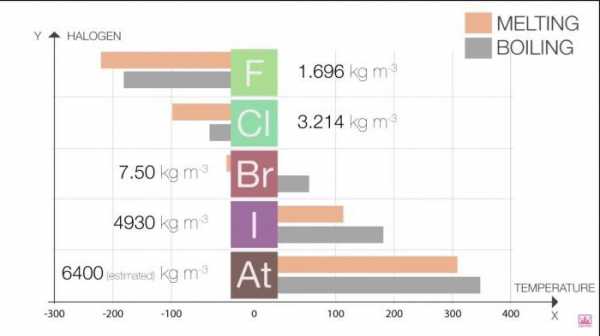
Точки плавления и кипения в группе возрастают по мере роста размера молекулы (F <Cl <Br <I <At). Это увеличение означает увеличение силы Ван-дер-Ваальса.
Таблица 1. Галогены. Физические свойства: точки плавления и кипения
Галоген | Т плавления (˚C) | Т кипения (˚C) |
Фтор | -220 | -188 |
Хлор | -101 | -35 |
Бром | -7.2 | 58.8 |
Иод | 114 | 184 |
Астат | 302 | 337 |
- Атомный радиус увеличивается.
Размер ядра увеличивается (F < Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома.
Таблица 2. Галогены. Физические свойства: атомные радиусы
Галоген | Ковалентный радиус (пм) | Ионный (X—) радиус (пм) |
Фтор | 71 | 133 |
Хлор | 99 | 181 |
Бром | 114 | 196 |
Иод | 133 | 220 |
Астат | 150 |
- Энергия ионизации уменьшается.
Если внешние валентные электроны не находятся вблизи ядра, то для их удаления от него не потребуется много энергии. Таким образом, энергия, необходимая для выталкивания внешнего электрона не столь высока в нижней части группы элементов, так как здесь больше энергетических уровней. Кроме того, высокая энергия ионизации заставляет элемент проявлять неметаллические качества. Йод и дисплей астат проявляют металлические свойства, потому что энергия ионизации снижается (At < I < Br < Cl < F).
Таблица 3. Галогены. Физические свойства: энергия ионизации
Галоген | Энергия ионизации (кДж/моль) |
фтор | 1681 |
хлор | 1251 |
бром | 1140 |
йод | 1008 |
астат | 890±40 |
- Электроотрицательность уменьшается.
Число валентных электронов в атоме возрастает с увеличением уровней энергии при прогрессивно более низких уровнях. Электроны прогрессивно дальше от ядра; Таким образом, ядро и электроны не как притягиваются друг к другу. Увеличение экранирования наблюдается. Поэтому Электроотрицательность уменьшается с ростом периода (At < I < Br < Cl < F).
Таблица 4. Галогены. Физические свойства: электроотрицательность
Галоген | Электроотрицательность |
фтор | 4.0 |
хлор | 3.0 |
бром | 2.8 |
иод | 2.5 |
астат | 2.2 |
- Сродство к электрону уменьшается.
Так как размер атома увеличивается с увеличением периода, сродство к электрону, как правило, уменьшается (В < I < Br < F < Cl). Исключение – фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором.
Таблица 5. Сродство галогенов к электрону
Галоген | Сродство к электрону (кДж/моль) |
фтор | -328.0 |
хлор | -349.0 |
бром | -324.6 |
иод | -295.2 |
астат | -270.1 |
- Реактивность элементов уменьшается.
Реакционная способность галогенов падает с ростом периода (At <I <Br <Cl <F). Это связано с увеличением радиуса атома с возрастанием уровней энергии электронов. Это снижает притяжение валентных электронов других атомов, снижая реакционную способность. Это уменьшение также происходит из-за падения электроотрицательности с увеличением периода, что также снижает притяжение электронов. Кроме того, с увеличением размера атома снижается и окислительная способность.
Галогенид образуется, когда галоген реагирует с другим, менее электроотрицательным элементом с образованием бинарного соединения. Водород реагирует с галогенами, образуя галогениды вида НХ:
- фтороводород HF;
- хлороводород HCl;
- бромоводород HBr;
- иодоводород HI.
Галогениды водорода легко растворяются в воде с образованием галогенводородной (плавиковой, соляной, бромистоводородной, иодистоводородной) кислоты. Свойства этих кислот приведены ниже.
Кислоты образуются следующей реакцией: HX (aq) + H2O (l) → Х— (aq) + H3O+ (aq).
Все галоидоводороды образуют сильные кислоты, за исключением HF.
Кислотность галогеноводородных кислот увеличивается: HF <HCl <HBr <HI.
Плавиковая кислота способна гравировать стекло и некоторые неорганические фториды длительное время.
Может показаться нелогичным, что HF является самой слабой галогенводородной кислотой, так как фтор обладает самой высокой электроотрицательностью. Тем не менее связь Н-F очень сильна, в результате чего кислота очень слабая. Сильная связь определяется короткой длиной связи и большой энергией диссоциации. Из всех галогенидов водорода HF имеет самую короткую длину связи и самую большую энергию диссоциации связи.
Галогенные оксокислоты
Галогенные оксокислоты представляют собой кислоты с атомами водорода, кислорода и галогена. Их кислотность может быть определена с помощью анализа структуры. Галогенные оксокислоты приведены ниже:
- Хлорноватистая кислота HOCl.
- Хлористая кислота HClO2.
- Хлорноватая кислота HClO3.
- Хлорная кислота HClO4.
- Бромноватистая кислота HOBr.
- Бромноватая кислота HBrO3.
- Бромная кислота HBrO4.
- Иодноватистая кислота HOI.
- Йодноватая кислота HIO3.
- Метайодная кислота HIO4, H5IO6.
В каждой из этих кислот протон связан с атомом кислорода, поэтому сравнение длин связей протонов здесь бесполезно. Доминирующую роль здесь играет электроотрицательность. Активность кислотны возрастает с увеличением числа атомов кислорода, связанный с центральным атомом.
Внешний вид и состояние вещества
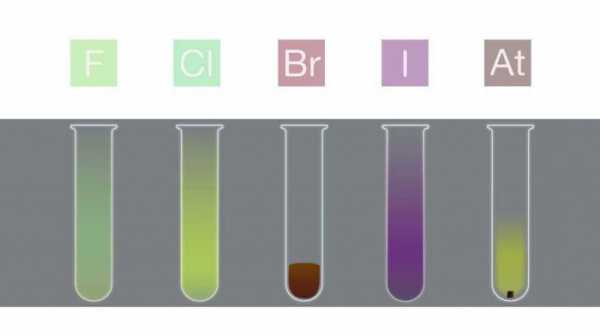
Основные физические свойства галогенов кратко можно выразить в следующей таблице.
Состояние вещества (при комнатной температуре) | Галоген | Внешний вид |
твёрдое | йод | фиолетовый |
астат | чёрный | |
жидкое | бром | красно-коричневый |
газообразное | фтор | бледно-жёлто-коричневый |
хлор | бледно-зелёный |
Объяснение внешнего вида
Цвет галогенов является результатом поглощения видимого света молекулами, что вызывает возбуждение электронов. Фтор поглощает фиолетовый свет, и, следовательно, выглядит светло-жёлтым. Йод, наоборот, поглощает жёлтый свет и выглядит фиолетовым (жёлтый и фиолетовый – дополняющие цвета). Цвет галогенов становится темнее с ростом периода.
В закрытых ёмкостях жидкий бром и твёрдый йод находятся в равновесии со своими парами, которые можно наблюдать в виде цветного газа.
Хотя цвет астата неизвестен, предполагается, что он должен быть темнее йода (т. е. черным) в соответствии с наблюдаемой закономерностью.
Теперь, если вас попросят: «Охарактеризуйте физические свойства галогенов», вам будет что сказать.
Степень окисления галогенов в соединениях
Степень окисления часто используется вместо понятия «валентность галогенов». Как правило, степень окисления равна -1. Но если галоген связан с кислородом или другим галогеном, он может принимать другие состояния: СО кислорода -2 имеет приоритет. В случае двух различных атомов галогена, соединенных вместе, более электроотрицательный атом превалирует и принимает СО -1.
Например, в хлориде йода (ICl) хлор имеет СО -1, и йод +1. Хлор является более электроотрицательным, чем йод, поэтому его СО равна -1.
В бромной кислоте (HBrO4) кислород обладает СО -8 (-2 х 4 атома = -8). Водород имеет общую степень окисления +1. Сложение этих значений даёт СО -7. Так как конечное СО соединения должно быть нулевым, то СО брома равна +7.
Третьим исключением из правила является степень окисления галогена в элементарной форме (X2), где его СО равна нулю.
Галоген | СО в соединениях |
фтор | -1 |
хлор | -1, +1, +3, +5, +7 |
бром | -1, +1, +3, +4, +5 |
йод | -1, +1, +5, +7 |
астат | -1, +1, +3, +5, +7 |
Почему СО фтора всегда -1?
Электроотрицательность увеличивается с ростом периода. Поэтому фтор имеет самую высокую электроотрицательность из всех элементов, что подтверждается его положением в периодической таблице. Его электронная конфигурация 1s2 2s2 2p5. Если фтор получает еще один электрон, крайние р-орбитали полностью заполнены и составляют полный октет. Поскольку фтор имеет высокую электроотрицательность, он может легко отобрать электрон у соседнего атома. Фтор в этом случае изоэлектронен инертному газу (с восемью валентными электронами), все его внешние орбитали заполнены. В таком состоянии фтор гораздо более стабилен.
Получение и применение галогенов
В природе галогены находятся в состоянии анионов, поэтому свободные галогены получают методом окисления путём электролиза или с помощью окислителей. Например, хлор вырабатывается гидролизом раствора поваренной соли. Применение галогенов и их соединений многообразно.
- Фтор. Несмотря на то что фтор очень реактивен, он используется во многих областях промышленности. Например, он является ключевым компонентов политетрафторэтилена (тефлона) и некоторых других фторполимеров. Хлорфторуглероды представляют собой органические химические вещества, которые ранее использовались в качестве хладагентов и пропеллентов в аэрозолях. Их применение прекратилось из-за возможного их воздействия на окружающую среду. Их заменили гидрохлорфторуглероды. Фтор добавляют в зубную пасту (SnF2) и питьевую воду (NaF) для предотвращения разрушения зубов. Этот галоген содержится в глине, используемой для производства некоторых видов керамики (LiF), используется в ядерной энергетике (UF6), для получения антибиотика фторхинолона, алюминия (Na3AlF6), для изоляции высоковольтного оборудования (SF6).
- Хлор также нашёл разнообразное применение. Он используется для дезинфекции питьевой воды и плавательных бассейнов. Гипохлорит натрия (NaClO) является основным компонентом отбеливателей. Соляная кислота широко используется в промышленности и лабораториях. Хлор присутствует в поливинилхлориде (ПВХ) и других полимерах, которые используются для изоляции проводки, труб и электроники. Кроме того, хлор оказался полезен и в фармацевтической промышленности. Лекарственные средства, содержащие хлор, используются для лечения инфекций, аллергии и диабета. Нейтральная форма гидрохлорида – компонент многих препаратов. Хлор используется также для стерилизации больничного оборудования и дезинфекции. В сельском хозяйстве хлор является компонентом многих коммерческих пестицидов: ДДТ (дихлородифенилтрихлорэтан) использовался в качестве сельскохозяйственного инсектицида, но его использование было прекращено.

- Бром, благодаря своей негорючести, применяется для подавления горения. Он также содержится в бромистом метиле, пестициде, используемом для хранения урожая и подавления бактерий. Однако чрезмерное использование бромистого метила было прекращено из-за его воздействия на озоновый слой. Бром применяют при производстве бензина, фотоплёнки, огнетушителей, лекарств для лечения пневмонии и болезни Альцгеймера.
- Йод играет важную роль в надлежащем функционировании щитовидной железы. Если организм не получает достаточного количества йода, происходит увеличение щитовидной железы. Для профилактики зоба данный галоген добавляют в поваренную соль. Йод также используется в качестве антисептического средства. Йод содержится в растворах, используемых для очистки открытых ран, а также в дезинфицирующих спреях. Кроме того, йодид серебра имеет важное значение в фотографии.
- Астат – радиоактивный и редкоземельный галоген, поэтому ещё нигде не используется. Тем не менее полагают, что этот элемент может помочь йоду в регуляции гормонов щитовидной железы.
fb.ru
📌 Галогены — это… 🎓 Что такое Галогены?
ГАЛОГЕНЫ — ГАЛОГЕНЫ, химические элементы VII группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At. Фтор и хлор газы, бром жидкость, остальные кристаллы. Все галогены, кроме At, широко распространены в природе входят в состав многих… … Современная энциклопедия
ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Галогены… … Научно-технический энциклопедический словарь
ГАЛОГЕНЫ — (устар. выражение галоиды) химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals соль и genes рождающий (при соединении с металлами… … Большой Энциклопедический словарь
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
ГАЛОГЕНЫ — общее название пяти хим. элементов, составляющих VII подгруппу Периодической системы элементов Д. И. Менделеева, фтора, хлора, брома, йода и астата. Все Г. неметаллы, их молекулы двухатомны; Г. реагируют со всеми простыми веществами, являются… … Большая политехническая энциклопедия
ГАЛОГЕНЫ — ПОДГРУППА VIIA. ГАЛОГЕНЫ ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ Галогены и особенно фтор, хлор и бром имеют большое значение для промышленности и лабораторной практики как в свободном состоянии, так и в виде различных органических и неорганических… … Энциклопедия Кольера
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
ГАЛОГЕНЫ — ГАЛОИДЫ ИЛИ ГАЛОГЕНЫ химические элементы: хлор, иод, бром, фтор, образующие с металлами соли без кислорода, напр. хлористый натрий (повар. соль). Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГАЛОИДЫ или ГАЛОГЕНЫ … Словарь иностранных слов русского языка
галогены — ов; мн. (ед. галоген, а; м.). [от греч. hals соль и genesis род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, ая, ое. Г ые соединения. Г ая лампа (лампа… … Энциклопедический словарь
галогены — halogenai statusas T sritis chemija apibrėžtis F, Cl, Br, I, (At). atitikmenys: angl. halogens; haloid elements; haloids rus. галогены … Chemijos terminų aiškinamasis žodynas
Галогены — (от греч. hals соль и… genes рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы Г. по свойству давать соли при… … Большая советская энциклопедия
dic.academic.ru
Галогены Википедия
| Группа → | 17 (VIIA) | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 | |||||||
| 5 | |||||||
| 6 |
| ||||||
| 7 |
| ||||||
Галоге́ны (от греч. ἁλός — «соль» и γένος — «рождение, происхождение»; иногда употребляется устаревшее название гало́иды) — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы)[1].
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент теннессин Ts.
| Фтор F | Хлор Cl | Бром Br | Иод I |
|---|---|---|---|
ru-wiki.ru