Галогены — это… Что такое Галогены?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 декабря 2011. |
| Группа → | 17 (VIIA) | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 | |||||||
| 3 | |||||||
| 4 | |||||||
| 5 | |||||||
| 6 |
| ||||||
| 7 |
| ||||||
Галоге́ны (от греч. ἁλός — соль и γένος — рождение, происхождение; иногда употребляется устаревшее название гало́иды) — химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы)[1].
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
| Фтор F | Хлор Cl | Бром Br | Иод I |
|---|---|---|---|
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F−) = +2,87 В и Eo(Cl2/Cl−) = +1,36 В показывают, что окислить ионы F− и Cl− можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде:
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na
Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения иода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br
Физические свойства галогенов
Фтор является трудносжижаемым, а хлор легкосжижаемым газом с удушливым резким запахом. Энергия связи галогенов сверху вниз по ряду изменяется не равномерно. Фтор имеет аномально низкую энергию связи (151 кДж/моль), это объясняется тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (Cl2 243, Br2 199, I2 150,7, At2117 кДж/моль). От хлора к астату энергия связи постепенно ослабевает, что связано с увеличением атомного радиуса. Аналогичные аномалии имеют и температуры кипения (плавления):
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309[2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
- 2Al + 3F2 = 2AlF3 + 2989 кДж,
- 2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
- Н2 + F2 = 2HF + 547 кДж,
- Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
- Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
- Хе + F2 = XeF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
- 3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
- 2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж,
- 2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж,
- Si + 2Cl2 = SiCl4(Ж) + 662 кДж,
- Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
- Cl2 + hν → 2Cl,
- Cl + Н2 → HCl + Н,
- Н + Cl2 → HCl + Cl,
- Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов (hν), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
- СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
- СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
- Cl2 + 2HBr = 2HCl + Br2,
- Cl2 + 2HI = 2HCl + I2,
- Cl2 + 2KBr = 2KCl + Br2,
а также обратимо реагирует с водой:
- Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
- Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
- 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
- Si + 2Br2 = SiBr4(ж) + 433 кДж,
- Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
- I2 + I− → I−3.
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
- 2Li + At2 = 2LiAt — астатид лития.
А при диссоциации образуются не только протоны, но и ионы At+:HAt диссоц. на:2HAt=H++At—+H—+At+.
Примечания
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 211. — 623 с. — 100 000 экз.
dic.academic.ru
Галогены — это… Что такое Галогены?
ГАЛОГЕНЫ — ГАЛОГЕНЫ, химические элементы VII группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At. Фтор и хлор газы, бром жидкость, остальные кристаллы. Все галогены, кроме At, широко распространены в природе входят в состав многих… … Современная энциклопедия
ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Галогены… … Научно-технический энциклопедический словарь
ГАЛОГЕНЫ — (устар. выражение галоиды) химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals соль и genes рождающий (при соединении с металлами… … Большой Энциклопедический словарь
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
ГАЛОГЕНЫ — общее название пяти хим. элементов, составляющих VII подгруппу Периодической системы элементов Д. И. Менделеева, фтора, хлора, брома, йода и астата. Все Г. неметаллы, их молекулы двухатомны; Г. реагируют со всеми простыми веществами, являются… … Большая политехническая энциклопедия
ГАЛОГЕНЫ — ПОДГРУППА VIIA. ГАЛОГЕНЫ ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ Галогены и особенно фтор, хлор и бром имеют большое значение для промышленности и лабораторной практики как в свободном состоянии, так и в виде различных органических и неорганических… … Энциклопедия Кольера
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
ГАЛОГЕНЫ — ГАЛОИДЫ ИЛИ ГАЛОГЕНЫ химические элементы: хлор, иод, бром, фтор, образующие с металлами соли без кислорода, напр. хлористый натрий (повар. соль). Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГАЛОИДЫ или ГАЛОГЕНЫ … Словарь иностранных слов русского языка
галогены — ов; мн. (ед. галоген, а; м.). [от греч. hals соль и genesis род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, ая, ое. Г ые соединения. Г ая лампа (лампа… … Энциклопедический словарь
галогены — halogenai statusas T sritis chemija apibrėžtis F, Cl, Br, I, (At). atitikmenys: angl. halogens; haloid elements; haloids rus. галогены … Chemijos terminų aiškinamasis žodynas
Галогены — (от греч. hals соль и… genes рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы Г. по свойству давать соли при… … Большая советская энциклопедия
dic.academic.ru
ГАЛОГЕНЫ — это… Что такое ГАЛОГЕНЫ?
Хорошим хлорирующим агентом является CCl4, например для превращения BeO в BeCl2. Для фторирования хлоридов часто применяют SbF3 (см. выше SO2ClF).
Галогены реагируют со многими галогенидами металлов с образованием полигалогенидов соединений, содержащих крупные анионные частицы Xn1. Например:
Первая реакция дает удобный метод получения высококонцентрированного раствора I2 путем добавления иода к концентрированному раствору KI. Полииодиды сохраняют свойства I2. Возможно также получение смешанных полигалогенидов: RbI + Br2 -> RbIBr2 RbIСl2 + Cl2 -> RbICl4
Растворимость. Галогены обладают некоторой растворимостью в воде, однако, как и следовало ожидать, из-за ковалентного характера связи XX и малого заряда растворимость их невелика. Фтор настолько активен, что оттягивает электронную пару от кислорода воды, при этом выделяется свободный O2 и образуются OF2 и HF. Хлор менее активен, но в реакции с водой получается некоторое количество HOCl и HCl. Гидраты хлора (например, Cl2*8h3O) могут быть выделены из раствора при охлаждении.
Иод проявляет необычные свойства при растворении в различных растворителях. При растворении небольших количеств иода в воде, спиртах, кетонах и других кислородсодержащих растворителях образуется раствор коричневого цвета (1%-ный раствор I2 в спирте обычный медицинский антисептик). Раствор иода в CCl4 или других бескислородных растворителях имеет фиолетовую окраску. Можно полагать, что в таком растворителе молекулы иода ведут себя подобно их состоянию в газовой фазе, которая имеет такую же окраску. В кислородсодержащих растворителях происходит оттягивание электронной пары кислорода на валентные орбитали иода.
Оксиды. Галогены образуют оксиды. Никакой систематической закономерности или периодичности в свойствах этих оксидов не наблюдается. Сходство и различия, а также основные способы получения оксидов галогенов указаны в табл. 8б.
Оксокислоты галогенов. При образовании оксокислот более четко проявляется систематичность галогенов. Галогены образуют галогеноватистые кислоты HOX, галогенистые кислоты HOXO, галогеноватые кислоты HOXO2 и галогеновые кислоты HOXO3, где X галоген. Но только хлор образует кислоты всех указанных составов, а фтор вообще не образует оксокислот, бром не образует HBrO4. Составы кислот и основные способы их получения указаны в табл. 8в.
Все кислоты галогенов неустойчивы, однако чистая HOClO3 наиболее стабильна (в отсутствие любых восстановителей). Все оксокислоты являются сильными окислителями, но скорость окисления необязательно зависит от степени окисления галогена. Так, HOCl (ClI) быстрый и эффективный окислитель, а разбавленная HOClO3 (ClVII) нет. В целом, чем выше степень окисления галогена в оксокислоте, тем сильнее кислота, поэтому HClO4 (ClVII) наиболее сильная из известных оксокислот в водном растворе. Ион ClO4, образующийся при диссоциации кислоты в воде, наиболее слабый из отрицательных ионов донор электронной пары. Гипохлориты Na и Ca находят промышленное применение при отбеливании и водоочистке. Межгалогенные соединения соединения различных галогенов друг с другом. Галоген с большим радиусом всегда имеет в таком соединении положительную степень окисления (подвергается окислению), а с меньшим радиусом более отрицательную (подвергается восстановлению). Этот факт вытекает из общей тенденции изменения активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных соединений (А галоген с более положительной степенью окисления).
Межгалогенные соединения образуются прямым синтезом из элементов. Необычная для иода степень окисления 7 реализуется в соединении IF7, а другие галогены не могут координировать 7 атомов фтора. Прикладное значение имеют BrF3 и ClF3 жидкие вещества, химически аналогичные фтору, но более удобные при фторировании. При этом более эффективен BrF3. Поскольку трифториды сильные окислители и находятся в жидком состоянии, их используют как окислители ракетного топлива.
Водородные соединения. Галогены реагируют с водородом, образуя HX, причем со фтором и хлором реакция протекает со взрывом при небольшой активации ее. Медленнее идет взаимодействие c Br2 и I2. Для протекания реакции с водородом достаточно активировать небольшую долю реагентов с помощью освещения или нагревания. Активированные частицы взаимодействуют с неактивированными, образуя HX и новые активированные частицы, которые продолжают процесс, а реакция двух активированных частиц по главной реакции заканчивается образованием продукта. Например, образование HCl из h3 и Cl2:
Более удобные методы получения галоиодоводородов, чем прямой синтез, дают, например, следующие реакции:
В газообразном состоянии HX являются ковалентными соединениями, однако в водном растворе они (за исключением HF) становятся сильными кислотами. Объясняется это тем, что молекулы воды эффективно оттягивают водород от галогена. Все кислоты хорошо растворимы в воде благодаря гидратации: HX + h3O -> h4O+ + X
HF более склонен к комплексообразованию, чем другие галогеноводороды. Заряды на H и F так велики, а эти атомы так малы, что происходит образование HX-ассоциатов типа полимеров состава (HF)x, где x і 3. В таком растворе диссоциация под действием молекулы воды идет не более чем на несколько процентов от общего количества ионов водорода. В отличие от других галогеноводородов фтороводород активно реагирует с SiO2 и силикатами, выделяя газообразный SiF4. Поэтому водный раствор HF (плавиковая кислота) используют в травлении стекла и хранят не в стеклянной, а в парафиновой или полиэтиленовой посуде. Чистый HF кипит чуть ниже комнатной температуры (19,52° С), поэтому его хранят в виде жидкости в стальных цилиндрах. Водный раствор HCl называют соляной кислотой. Насыщенный раствор, содержащий 36% (масс.) HCl, широко используют в химической промышленности и лабораториях (см. также ВОДОРОД).
Астат. Этот химический элемент семейства галогенов имеет символ At и атомный номер 85, он существует только в следовых количествах в некоторых минералах. Еще в 1869 Д.И.Менделеев предсказал его существование и возможность открытия в будущем. Астат был открыт Д.Корсоном, К.Маккензи и Э.Сегре в 1940. Известно более 20 изотопов, из которых наиболее долгоживущие 210At и 211At. По некоторым данным, при бомбардировке 20983Bi ядрами гелия образуется изотоп астат-211; сообщалось, что астат растворим в ковалентных растворителях, может образовывать At, как и другие галогены, и, вероятно, возможно получение иона AtO4. (Эти данные удалось получить на растворах с концентрацией 1010 моль/л.)
Энциклопедия Кольера. — Открытое общество. 2000.
- ХАЛЬКОГЕНЫ
- ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
Смотреть что такое «ГАЛОГЕНЫ» в других словарях:
ГАЛОГЕНЫ — ГАЛОГЕНЫ, химические элементы VII группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At. Фтор и хлор газы, бром жидкость, остальные кристаллы. Все галогены, кроме At, широко распространены в природе входят в состав многих… … Современная энциклопедия
ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Галогены… … Научно-технический энциклопедический словарь
ГАЛОГЕНЫ — (устар. выражение галоиды) химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals соль и genes рождающий (при соединении с металлами… … Большой Энциклопедический словарь
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
ГАЛОГЕНЫ — общее название пяти хим. элементов, составляющих VII подгруппу Периодической системы элементов Д. И. Менделеева, фтора, хлора, брома, йода и астата. Все Г. неметаллы, их молекулы двухатомны; Г. реагируют со всеми простыми веществами, являются… … Большая политехническая энциклопедия
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
ГАЛОГЕНЫ — ГАЛОИДЫ ИЛИ ГАЛОГЕНЫ химические элементы: хлор, иод, бром, фтор, образующие с металлами соли без кислорода, напр. хлористый натрий (повар. соль). Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГАЛОИДЫ или ГАЛОГЕНЫ … Словарь иностранных слов русского языка
галогены — ов; мн. (ед. галоген, а; м.). [от греч. hals соль и genesis род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, ая, ое. Г ые соединения. Г ая лампа (лампа… … Энциклопедический словарь
галогены — halogenai statusas T sritis chemija apibrėžtis F, Cl, Br, I, (At). atitikmenys: angl. halogens; haloid elements; haloids rus. галогены … Chemijos terminų aiškinamasis žodynas
Галогены — (от греч. hals соль и… genes рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы Г. по свойству давать соли при… … Большая советская энциклопедия
dic.academic.ru
Галогены — это… Что такое Галогены?
ГАЛОГЕНЫ — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной массы. Галоидоводородные кислоты, их соли и простые органические галоидные соединения имеют также много общих физических и химических свойств. Г. используются в химической промышленности, для очистки воды и отходов, в производстве пластмасс, фармацевтических препаратов, целлюлозы и бумаги, тканей, смазочных материалов, как отбеливающие и дезинфицирующие моющие средства. Хлор применяется в производстве специальных аккумуляторов и хлорированных углеводородов. Диоксид хлора служит отбеливающим средством в пищевой, кожевенной, текстильной промышленности, а также окислителем, бактерицидом и антисептиком. Бром и йод применяются при синтезе органических красителей, при получении ряда металлов высокой чистоты и др.
Газы (фтор, хлор) и пары брома и йода раздражают органы дыхания. Вдыхание относительно низких концентраций этих газов и паров вызывает острые неприятные ощущения, которые сопровождаются чувством удушья, кашлем, стеснением в груди. Из-за повреждения легочной ткани происходит скопление жидкости в легких, развивается отек, который может оказаться смертельным. Резко выраженное раздражающее действие проявляется и при др. контактах — с кожным покровом, слизистыми глаз и при приеме внутрь с тяжелыми острыми и отдаленными последствиями.
Содержание галогенов и их соединений
в воздухе рабочей зоны
Наименование вещества, № CAS, синонимы | ПДК, мг/м3 | Характеристика |
Фтор [7782-41-4] | 0,03 | п, «+», 1 класс |
Фтороводород [7664-39-3] | 0,05 | п, 1 класс |
Фторид кислорода [7783-41-7] | 0,01 | п, «+», 1 класс |
Фторид натрия [7681-49-4] | 1 | а, «+», 2 класс |
Фторид кальция [7789-75-5] | 2,5 | п, 2 класс |
Хлор [7782-50-5] | 1 | п, «+», 2 класс |
Хлороводород [7447-01-0] | 5 | п, 2 класс |
Диоксид хлора [10049-04-4] | 0,1 | п, 2 класс |
Фосген [75-44-5] | 0,5 | п, 2 класс |
Хлорид серы [10025-67-9] | 0,3 | п, 2 класс |
Бром [7726-95-6] | 0,5 | п, «+», 2 класс |
Бромоводород [10035-10-6] | 2 | п, 2 класс |
Таллийбромид [7789-40-4] | 0,01 | а, 1 класс |
Йод [7553-56-2] | 1 | п, 2 класс |
Сокращения и обозначения: ПДК — предельно допустимая концентрация в воздухе рабочей зоны; п — пары; а — аэрозоль; класс — класс опасности вещества согласно ГОСТ 12.1.007—76; «+» — требуется специальная защита кожи и глаз.
Фтор (Ф.). Обладая чрезвычайно высокой реакционной способностью и проникая через защитные барьеры организма, Ф. вызывает многие нарушения обмена веществ, что позволяет оценивать его как яд политропного характера действия. В концентрациях 23 мг/м3 в течение 15 мин, 16 мг/м3 — 30 мин, 7,8 мг/м3 — 60 мин Ф. вызывает сильное раздражение верхних дыхательных путей. Длительное поступление Ф. в организм ингалляционно или с питьевой водой в концентрациях, превышающих допустимый уровень, ведет к заболеванию флюорозом.
Профессиональный флюороз чаще всего встречается у рабочих электролизных цехов алюминиевых заводов, производств плавиковой кислоты и ее солей, суперфосфата и др. Клинические проявления хронического флюороза регистрируются у части лиц при стаже 10—15 лет и более в условиях повышенных концентраций. К ранним признакам заболевания (1-я стадия из 3 стадий) относятся: жалобы на общее недомогание, слабость, повышенную утомляемость, раздражение слизистых оболочек глаз и носа, носовые кровотечения, жжение в носоглотке, боли в суставах и костях, головные боли, головокружения, боли в сердце, диспепсические явления.
Объективная симптоматика свидетельствует о развитии гипертрофических ринита, фарингита, ларингита; иногда — изъязвления и прободения носовой перегородки, нарушения бронхиальной проходимости. Обнаруживаются нейроциркулярная дистония, компенсаторная гиперфункция миокарда, пародонтоз, нарушение эмали зубов, хронический гастрит, проявления токсического гепатита и нарушение функционального состояния почек. Рентгенографических проявлений остеосклероза не выявляется.
У больных флюорозом (1-я и 2-я стадии) все указанные субъективные и объективные проявления резко усиливаются; в костно-суставной системе регистрируются периостальные наслоения. Обнаруживаются: выраженная легочная недостаточность, склерозирование сосудов сетчатки глаза, снижение проводимости звука. При прекращении контакта с Ф. проявления висцеральных нарушений уменьшаются, но костные изменения сохраняются длительное время.
При соприкосновении с кожей пары Ф. вызывают у человека зуд, раздражение, появление пузырей, мацерацию век, конъюнктивит, воспалительные и дистрофические изменения слизистой оболочки глаз и роговицы. Контакт с чистым Ф. вызывает ожог II степени, при концентрации 150—300 мг/м3 — раздражение открытых частей кожи.
Фтороводород очень токсичен; сильно раздражает дыхательные пути, слизистые оболочки глаз, носа (с кровотечением), полости рта, гортани и бронхов. Действует на ЦНС, вызывая приступы тетании. Возможно нарушение коронарного кровообращения, падение АД. Могут быть бронхиты, пневмосклероз, дистрофические изменения в печени и миокарде. При очень высоких концентрациях — спазм гортани и бронхов. Смерть в результате кровоизлияний и отека легких. В эксперименте на крысах в концентрациях 4,98 и 0,47 мг/м3 обладает эмбриотропным и мутагенным эффектами.
Фториды (Ф.) — соли фтороводородной кислоты, протоплазматические яды, нарушающие прежде всего углеводный, кальциевый и фосфорный обмен. При остром отравлении Ф. действуют на ЦНС и мускулатуру, при заглатывании — местное действие в желудочно-кишечном тракте. При хронической интоксикации — основные изменения в костях и зубах. Выявляются также сосудистые нарушения в органах дыхания, пищеварительном тракте, в нервной системе и кожном покрове. Тяжесть токсического действия фторсодержащих соединений зависит от их растворимости в биологических средах, что определяет количество поглощенного фтора.
Хлор (Х.). Газообразный Х. — прежде всего раздражитель органов дыхания. При концентрациях 6—8 мг/м3 он раздражает слизистые оболочки верхних дыхательных путей, бронхов и глаз. При высоких концентрациях и длительном воздействии поражения распространяются на глубокие отделы дыхательных путей, вызывая явления токсического трахеобронхита, появление признаков бронхиолита, бронхопневмонии, а иногда токсического отека легких. Концентрации 100—200 мг/м3 при 30—60 мин воздействия оцениваются как опасные для жизни.
В производственных условиях чаще всего встречаются легкие формы отравления. Жалобы на боль и жжение в груди, першение в горле, сухой кашель, затруднение дыхания, небольшое удушье, резь в глазах, слезотечение. Объективно — умеренная гиперемия слизистой оболочки дыхательных путей, серозные выделения из носа; в легких рассеянные сухие (местами влажные) хрипы. В острый период — головная боль, боль в подложечной области в правом подреберье. В крови — лейкоцитоз, нейтрофилия; в моче — белок. Последствия острых отравлений Х. могут усиливаться на протяжении 36 ч после контакта. Поэтому пострадавшие должны находиться под наблюдением врача. При отравлении средней тяжести все проявления субъективного и объективного характера усиливаются: увеличен и гиперемирован язычок, отечны дужки миндалин, истинные и ложные голосовые связки. Напряжена дыхательная мускулатура; кровь темная, густая, легко свертывается, что нередко приводит к закупорке вен, особенно на ногах.
Как отдаленные последствия острых отравлений Х. наблюдаются хронические катары верхних дыхательных путей, хронические рецидивирующие бронхиты и перибронхиты с последующим возникновением пневмосклероза, эмфиземы, бронхоэктатической болезни, легочно-сердечной недостаточности. У лиц, имеющих стаж работы с Х. свыше 5 лет, на флюорограммах обнаружено усиление рисунка корней легких, а после 8 лет — усиление и деформация легочного рисунка. Длительное воздействие малых концентраций Х. может привести к атрофическому катару верхних дыхательных путей, хроническому бронхиту, пневмосклерозу. На коже наблюдаются прыщи. Может происходить разрушение зубной эмали.
Хлороводород. При высоких концентрациях — раздражение слизистых, в особенности носа, конъюнктивит, помутнение роговицы. Охриплость голоса, чувство удушья, покалывание в груди, кашель с кровью в мокроте. Концентрации 75—150 мг/м3 для человека непереносимы; 50—75 мг/м3 переносятся с трудом; при 15 мг/м3 — раздражение слизистых оболочек верхних дыхательных путей и глаз. Длительное воздействие вызывает катары дыхательных путей, эрозию эмали зубов, изъязвление слизистой оболочки носа (иногда ее прободение), желудочно-кишечные расстройства. При непосредственном контакте с кожей возникает ожог и серозное воспаление с пузырями, изъязвления развиваются только при длительном воздействии.
Диоксид хлора раздражает дыхательные пути и глаза — подобно газообразному хлору, только в значительно большей степени. Раздражение и жжение в глазах ощущается в первые секунды при концетрациях 3—5 мг/м3. Кратковременное острое воздействие вызывает развитие бронхита астомоидного характера и эмфизему легких.
Фосген (Ф.) вызывает отек в результате поражения капилляров легких, приводящего к резкому повышению проницаемости воды и белка для капилляров и стенок легочных альвеол. Вследствие накопления жидкости в легких и затруднения газообмена наступает кислородное голодание организма, которое усиливается из-за повышения вязкости крови. Раздражающее действие на верхние дыхательные пути выражено не резко. Признаки легкого бронхита после однократного кратковременного воздействия Ф. в концентрации 16—19 мг/м3 быстро ослабевают и исчезают — «ложное выздоровление». Через латентный период (1—23 ч), длительность которого определяется тяжестью отравления, развиваются все признаки отека легких и токсической пневмонии, которые начинаются с нижних долей: повышается температура, наступает одышка, учащение дыхания, цианоз кожи и слизистых; развиваются нарушения кровообращения, кровь сгущена, повышена ее свертываемость, увеличено количество лейкоцитов и эритроцитов. В тяжелых случаях — потеря сознания. При длительном воздействии концентрация 5 мг/м3 опасна для жизни. Частые осложнения: бронхопневмония, облитерирующие бронхиолиты. В случае выздоровления клинические проявления, а также слабость и одышка исчезают медленно. Возможные частые последствия: эмфизема легких, хронические пневмонии.
Хлорид серы обладает специфическим раздражающим действием. Концентрация, вызывающая у человека раздражение верхних дыхательных путей, — 10 мг/м3; раздражение конъюнктивы глаз при минутной экспозиции 5 мг/м3.
Бром (Б.) относится к группе раздражающих веществ, обладающих сильным местноприжигающим действием. Длительный контакт Б. с тканями организма может вызвать глубокие ожоги, которые долго не заживают и приводят к образованию язв. Имеют место нарушения функции ЦНС, проявляющиеся в усилении процессов торможения в коре головного мозга. Начальные (пороговые) проявления раздражения у человека наблюдаются при воздействии Б. в концентрации 1—6 мг/м3; выраженный раздражающий эффект — при 13—22 мг/м3; содержание Б. в концентрации 30—60 мг/м3 считается чрезвычайно опасным для жизни; 200—220 мг/м3 — смертельно для человека.
При легкой интоксикации Б. — те же симптомы, как при соответствующем воздействии хлора. При более высоких концентрациях Б. усиливается раздражение. Слизистые оболочки носоглотки, верхних дыхательных путей, язык и конъюнктива приобретают коричневый цвет. Возможны бронхиальная астма, блефароспазм, вегетативные нарушения и гиперплазия щитовидной железы, сопровождающаяся ее дисфункцией. Сердечно-сосудистые нарушения проявляются в форме дегенерации миокарда и гипотонии. Происходят изменения отдельных функций печени и почек. Концентрации Б. в крови колеблются от 0,15 мг на 100 см3 до 1,5 мг на 100 см3 независимо от степени интоксикации.
Бромоводород по степени токсичности в 3 раза слабее, чем бром, но более чем в 2 раза сильнее хлороводорода. Раздражает слизистые оболочки верхних дыхательных путей и глаз. Порог раздражающего действия при однократной 4-часовой ингаляции в эксперименте на животных равен 26 мг/м3; изменения функционального состояния ЦНС и терморегуляции выявлено при концентрации 66 мг/м3. Хроническое отравление характеризуется воспалением верхних дыхательных путей, нарушением состава периферической крови, изменением функции ЦНС и нарушением пищеварения. Контакт с кожей и слизистыми оболочками может привести к ожогам.
Йод (Й.). Пары Й. даже в низких концентрациях чрезвычайно сильно раздражают дыхательные пути и глаза и в меньшей степени — кожу. При длительном воздействии в концентрации 1,03 мг/м3 Й. может вызвать незначительное раздражение конъюнктивы. Концентрации выше указанной приводят к усиливающемуся раздражению глаз и дыхательных путей (в итоге — к отеку легких). Др. системные повреждения в результате вдыхания паров Й. наблюдались у рабочих только при концентрациях, значительно превышающих ПДК. В таких условиях выявлены (помимо выраженных изменений в органах зрения и дыхательной системе): дисфункция щитовидной железы, снижение АД, функциональные изменения в миокарде и в ЦНС по типу астено-вегетативного синдрома. Хроническое воздействие Й. может привести к развитию заболевания, называемого «йодизм», при котором имеют место тахикардия, тремор, потеря массы тела, бессонница, диарея, конъюнктивит, ринит, бронхит.
Й. в кристаллической форме или в виде концентрированных растворов является сильным раздражителем кожи. Он с трудом удаляется с кожи, проникает внутрь, вызывая дальнейшие нарушения. Повреждения кожи напоминают тепловые ожоги, окрашенные в коричневый цвет. Из-за оставшегося в тканях Й. могут образовываться незаживающие язвы. Действие йодоводорода и йодоводородной кислоты подобно действию хлороводорода и хлороводородной кислоты, но выражено слабее.
labor_protection.academic.ru
Общая характеристика галогенов — урок. Химия, 8–9 класс.
Общая характеристика элементов
Галогены — элементы \(VIIA\) группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At.
Астат является радиоактивным элементом и встречается в природе редко.
Все галогены относятся к неметаллам.
В атомах галогенов на внешнем энергетическом уровне находится по \(7\) электронов:
F +9)2)7
Cl +17)2)8)7
Br +35)2)8)18)7
I +53)2)8)18)18)7
Валентные электроны галогенов образуют три электронные пары, а один электрон внешнего энергетического уровня остаётся неспаренным.
С возрастанием порядкового номера от фтора к иоду увеличиваются радиусы атомов, снижается их электроотрицательность. Значит, неметаллическиесвойства галогенов по группе сверху вниз ослабевают.
До завершения внешнего электронного слоя атомам галогенов не хватает только одного электрона, поэтому им наиболее характерна степень окисления \(–1\).
У фтора электроотрицательность больше, чем у остальных элементов, и поэтому степень окисления \(–1\) — его единственная возможная степень окисления в соединениях.
Атомы других галогенов способны также и отдавать валентные электроны, проявляя при этом положительные степени окисления \(+1\), \(+3\), \(+5\), \(+7\). Так, положительные степени окисления атомы хлора проявляют в соединениях с более электроотрицательными фтором, кислородом и азотом.
Галогены образуют с металлами соединения с ионной связью, а с другими неметаллами — соединения с ковалентной полярной связью.
Общая характеристика простых веществ
Атомы галогенов соединяются попарно и образуют двухатомные молекулы: F2, Cl2, Br2, I2.
Связь в молекулах ковалентная неполярная, одинарная. Кристаллическая решётка — молекулярная. Поэтому у галогенов невысокие температуры кипения и плавления.
При обычных условиях фтор представляет собой светло-жёлтый газ, хлор — жёлто-зелёный газ, бром — красно-коричневую жидкость, иод — тёмно-фиолетовые кристаллы.
Фтор

Хлор

Бром
Иод
Твёрдый иод при нагревании легко возгоняется (переходит в газообразное состояние и обратно в твёрдое, не превращаясь в жидкость).
Возгонка иода
У всех галогенов — резкий неприятный запах, и они очень токсичны.
В ряду галогенов с увеличением относительной молекулярной массы возрастают температуры кипения и плавления, увеличивается плотность, более интенсивной становится окраска.
В воде галогены растворяются слабо.
Фтор с водой вступает в химическую реакцию и вытесняет из неё кислород:
2F2+2h3O=4HF+O2↑.
www.yaklass.ru
физические свойства, химические свойства. Применение галогенов и их соединений
Галогены в периодической таблице расположены слева от благородных газов. Эти пять токсических неметаллических элементов входят в 7 группу периодической таблицы. К ним относятся фтор, хлор, бром, йод и астат. Хотя астат радиоактивен и имеет только короткоживущие изотопы, он ведет себя, как йод, и его часто причисляют к галогенам. Поскольку галогенные элементы имеют семь валентных электронов, им необходим лишь один дополнительный электрон для образования полного октета. Эта характеристика делает их более активными, чем другие группы неметаллов.
Общая характеристика
Галогены образуют двухатомные молекулы (вида Х2, где Х обозначает атом галогена) – устойчивую форму существования галогенов в виде свободных элементов. Связи этих двухатомных молекул являются неполярными, ковалентными и одинарными. Химические свойства галогенов позволяют им легко вступать в соединение с большинством элементов, поэтому они никогда не встречаются в несвязанном виде в природе. Фтор – наиболее активный галоген, а астат – наименее.
Все галогены образуют соли I группы с похожими свойствами. В этих соединениях галогены присутствуют в виде галоидных анионов с зарядом -1 (например, Cl—, Br—). Окончание -ид указывает на наличие галогенид-анионов; например Cl— называется «хлорид».
Кроме того, химические свойства галогенов позволяют им действовать в качестве окислителей – окислять металлы. Большинство химических реакций, в которых участвуют галогены – окислительно-восстановительные в водном растворе. Галогены образуют одинарные связи с углеродом или азотом в органических соединениях, где степень их окисления (СО) равна -1. Когда атом галогена замещён ковалентно-связанным атомом водорода в органическом соединении, префикс гало- может быть использован в общем смысле, или префиксы фтор-, хлор-, бром- , йод- – для конкретных галогенов. Галогенные элементы могут иметь перекрёстную связь с образованием двухатомных молекул с полярными ковалентными одинарными связями.
Хлор (Cl2) стал первым галогеном, открытым в 1774 г., затем были открыты йод (I2), бром (Br2), фтор (F2) и астат (At, обнаружен последним, в 1940 г.). Название «галоген» происходит от греческих корней hal- («соль») и -gen («образовывать»). Вместе эти слова означают «солеобразующий», подчёркивая тот факт, что галогены, вступая в реакцию с металлами, образуют соли. Галит – это название каменной соли, природного минерала, состоящего из хлорида натрия (NaCl). И, наконец, галогены используются в быту – фторид содержится в зубной пасте, хлор обеззараживает питьевую воду, а йод содействует выработке гормонов щитовидной железы.
Химические элементы
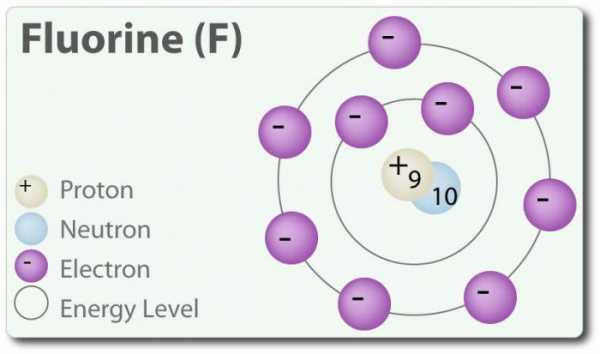
Фтор – элемент с атомным номером 9, обозначается символом F. Элементарный фтор впервые был обнаружен в 1886 г. путем выделения его из плавиковой кислоты. В свободном состоянии фтор существует в виде двухатомной молекулы (F2) и является наиболее распространенным галогеном в земной коре. Фтор – наиболее электроотрицательный элемент в периодической таблице. При комнатной температуре является бледно-жёлтым газом. Фтор также имеет относительно небольшой атомный радиус. Его СО – -1, за исключением элементарного двухатомного состояния, в котором его степень окисления равна нулю. Фтор чрезвычайно химически активен и непосредственно взаимодействует со всеми элементами, кроме гелия (He), неона (Ne) и аргона (Ar). В растворе H2O, плавиковой кислоты (HF) является слабой кислотой. Хотя фтор сильно электроотрицателен, его электроотрицательность не определяет кислотность; HF является слабой кислотой в связи с тем, что ион фтора основной (рН> 7). Кроме того, фтор производит очень мощные окислители. Например, фтор может вступать в реакцию с инертным газом ксеноном и образует сильный окислитель дифторид ксенона (XeF2). У фтора множество применений.
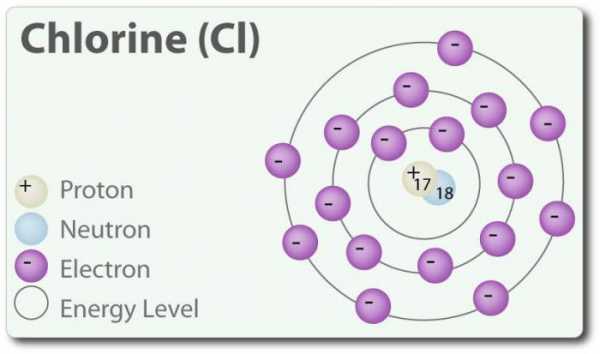
Хлор – элемент с атомным номером 17 и химическим символом Cl. Обнаружен в 1774 г. путём выделения его из соляной кислоты. В своём элементарном состоянии он образует двухатомную молекулу Cl2. Хлор имеет несколько СО: -1, +1, 3, 5 и 7. При комнатной температуре он является светло-зеленым газом. Так как связь, которая образуется между двумя атомами хлора, является слабой, молекула Cl2 обладает очень высокой способностью вступать в соединения. Хлор реагирует с металлами с образованием солей, которые называются хлориды. Ионы хлора являются наиболее распространенными ионами, они содержатся в морской воде. Хлор также имеет два изотопа: 35Cl и 37Cl. Хлорид натрия является наиболее распространенным соединением из всех хлоридов.
Бром – химический элемент с атомным номером 35 и символом Br. Впервые был обнаружен в 1826 г. В элементарной форме бром является двухатомной молекулой Br2. При комнатной температуре представляет собой красновато-коричневую жидкость. Его СО – -1, + 1, 3, 4 и 5. Бром более активен, чем йод, но менее активен, чем хлор. Кроме того, бром имеет два изотопа: 79Вг и 81Вг. Бром встречается в виде солей бромида, растворённых в морской воде. За последние годы производство бромида в мире значительно увеличилось благодаря его доступности и продолжительному времени жизни. Как и другие галогены, бром является окислителем и очень токсичен.
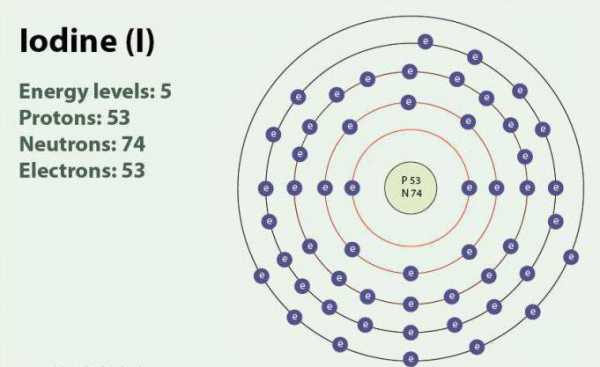
Йод – химический элемент с атомным номером 53 и символом I. Йод имеет степени окисления: -1, +1, +5 и +7. Существует в виде двухатомной молекулы, I2. При комнатной температуре является твёрдым веществом фиолетового цвета. Йод имеет один стабильный изотоп — 127I. Впервые обнаружен в 1811 г. с помощью морских водорослей и серной кислоты. В настоящее время ионы йода, могут быть выделены в морской воде. Несмотря на то что йод не очень хорошо растворим в воде, его растворимость может возрасти при использовании отдельных йодидов. Йод играет важную роль в организме, участвуя в выработке гормонов щитовидной железы.

Астат – радиоактивный элемент с атомным номером 85 и символом At. Его возможные степени окисления: -1, +1, 3, 5 и 7. Единственный галоген, не являющийся двухатомной молекулой. В нормальных условиях является металлическим твёрдым веществом чёрного цвета. Астат является очень редким элементом, поэтому о нём известно немного. Кроме того, астат имеет очень короткий период полураспада, не дольше нескольких часов. Получен в 1940 г. в результате синтеза. Полагают, что астат похож на йод. Отличается металлическими свойствами.
В таблице ниже показано строение атомов галогенов, структура внешнего слоя электронов.
Галоген | Конфигурация электронов |
Фтор | 1s2 2s2 2p5 |
Хлор | 3s2 3p5 |
Бром | 3d10 4s2 4p5 |
Иод | 4d10 5s2 5p5 |
Астат | 4f14 5d10 6s2 6p5 |
Подобное строение внешнего слоя электронов обусловливает то, что физические и химические свойства галогенов похожи. Вместе с тем при сопоставлении этих элементов наблюдаются и различия.
Периодические свойства в группе галогенов
Физические свойства простых веществ галогенов изменяются с повышением порядкового номера элемента. Для лучшего усвоения и большей наглядности мы предлагаем вам несколько таблиц.
Точки плавления и кипения в группе возрастают по мере роста размера молекулы (F <Cl <Br <I <At). Это увеличение означает увеличение силы Ван-дер-Ваальса.
Таблица 1. Галогены. Физические свойства: точки плавления и кипения
Галоген | Т плавления (˚C) | Т кипения (˚C) |
Фтор | -220 | -188 |
Хлор | -101 | -35 |
Бром | -7.2 | 58.8 |
Иод | 114 | 184 |
Астат | 302 | 337 |
- Атомный радиус увеличивается.
Размер ядра увеличивается (F < Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома.
Таблица 2. Галогены. Физические свойства: атомные радиусы
Галоген | Ковалентный радиус (пм) | Ионный (X—) радиус (пм) |
Фтор | 71 | 133 |
Хлор | 99 | 181 |
Бром | 114 | 196 |
Иод | 133 | 220 |
Астат | 150 |
- Энергия ионизации уменьшается.
Если внешние валентные электроны не находятся вблизи ядра, то для их удаления от него не потребуется много энергии. Таким образом, энергия, необходимая для выталкивания внешнего электрона не столь высока в нижней части группы элементов, так как здесь больше энергетических уровней. Кроме того, высокая энергия ионизации заставляет элемент проявлять неметаллические качества. Йод и дисплей астат проявляют металлические свойства, потому что энергия ионизации снижается (At < I < Br < Cl < F).
Таблица 3. Галогены. Физические свойства: энергия ионизации
Галоген | Энергия ионизации (кДж/моль) |
фтор | 1681 |
хлор | 1251 |
бром | 1140 |
йод | 1008 |
астат | 890±40 |
- Электроотрицательность уменьшается.
Число валентных электронов в атоме возрастает с увеличением уровней энергии при прогрессивно более низких уровнях. Электроны прогрессивно дальше от ядра; Таким образом, ядро и электроны не как притягиваются друг к другу. Увеличение экранирования наблюдается. Поэтому Электроотрицательность уменьшается с ростом периода (At < I < Br < Cl < F).
Таблица 4. Галогены. Физические свойства: электроотрицательность
Галоген | Электроотрицательность |
фтор | 4.0 |
хлор | 3.0 |
бром | 2.8 |
иод | 2.5 |
астат | 2.2 |
- Сродство к электрону уменьшается.
Так как размер атома увеличивается с увеличением периода, сродство к электрону, как правило, уменьшается (В < I < Br < F < Cl). Исключение – фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором.
Таблица 5. Сродство галогенов к электрону
Галоген | Сродство к электрону (кДж/моль) |
фтор | -328.0 |
хлор | -349.0 |
бром | -324.6 |
иод | -295.2 |
астат | -270.1 |
- Реактивность элементов уменьшается.
Реакционная способность галогенов падает с ростом периода (At <I <Br <Cl <F). Это связано с увеличением радиуса атома с возрастанием уровней энергии электронов. Это снижает притяжение валентных электронов других атомов, снижая реакционную способность. Это уменьшение также происходит из-за падения электроотрицательности с увеличением периода, что также снижает притяжение электронов. Кроме того, с увеличением размера атома снижается и окислительная способность.

Галогенид образуется, когда галоген реагирует с другим, менее электроотрицательным элементом с образованием бинарного соединения. Водород реагирует с галогенами, образуя галогениды вида НХ:
- фтороводород HF;
- хлороводород HCl;
- бромоводород HBr;
- иодоводород HI.
Галогениды водорода легко растворяются в воде с образованием галогенводородной (плавиковой, соляной, бромистоводородной, иодистоводородной) кислоты. Свойства этих кислот приведены ниже.
Кислоты образуются следующей реакцией: HX (aq) + H2O (l) → Х— (aq) + H3O+ (aq).
Все галоидоводороды образуют сильные кислоты, за исключением HF.
Кислотность галогеноводородных кислот увеличивается: HF <HCl <HBr <HI.
Плавиковая кислота способна гравировать стекло и некоторые неорганические фториды длительное время.
Может показаться нелогичным, что HF является самой слабой галогенводородной кислотой, так как фтор обладает самой высокой электроотрицательностью. Тем не менее связь Н-F очень сильна, в результате чего кислота очень слабая. Сильная связь определяется короткой длиной связи и большой энергией диссоциации. Из всех галогенидов водорода HF имеет самую короткую длину связи и самую большую энергию диссоциации связи.
Галогенные оксокислоты
Галогенные оксокислоты представляют собой кислоты с атомами водорода, кислорода и галогена. Их кислотность может быть определена с помощью анализа структуры. Галогенные оксокислоты приведены ниже:
- Хлорноватистая кислота HOCl.
- Хлористая кислота HClO2.
- Хлорноватая кислота HClO3.
- Хлорная кислота HClO4.
- Бромноватистая кислота HOBr.
- Бромноватая кислота HBrO3.
- Бромная кислота HBrO4.
- Иодноватистая кислота HOI.
- Йодноватая кислота HIO3.
- Метайодная кислота HIO4, H5IO6.
В каждой из этих кислот протон связан с атомом кислорода, поэтому сравнение длин связей протонов здесь бесполезно. Доминирующую роль здесь играет электроотрицательность. Активность кислотны возрастает с увеличением числа атомов кислорода, связанный с центральным атомом.
Внешний вид и состояние вещества
Основные физические свойства галогенов кратко можно выразить в следующей таблице.
Состояние вещества (при комнатной температуре) | Галоген | Внешний вид |
твёрдое | йод | фиолетовый |
астат | чёрный | |
жидкое | бром | красно-коричневый |
газообразное | фтор | бледно-жёлто-коричневый |
хлор | бледно-зелёный |
Объяснение внешнего вида
Цвет галогенов является результатом поглощения видимого света молекулами, что вызывает возбуждение электронов. Фтор поглощает фиолетовый свет, и, следовательно, выглядит светло-жёлтым. Йод, наоборот, поглощает жёлтый свет и выглядит фиолетовым (жёлтый и фиолетовый – дополняющие цвета). Цвет галогенов становится темнее с ростом периода.

В закрытых ёмкостях жидкий бром и твёрдый йод находятся в равновесии со своими парами, которые можно наблюдать в виде цветного газа.
Хотя цвет астата неизвестен, предполагается, что он должен быть темнее йода (т. е. черным) в соответствии с наблюдаемой закономерностью.
Теперь, если вас попросят: «Охарактеризуйте физические свойства галогенов», вам будет что сказать.
Степень окисления галогенов в соединениях
Степень окисления часто используется вместо понятия «валентность галогенов». Как правило, степень окисления равна -1. Но если галоген связан с кислородом или другим галогеном, он может принимать другие состояния: СО кислорода -2 имеет приоритет. В случае двух различных атомов галогена, соединенных вместе, более электроотрицательный атом превалирует и принимает СО -1.
Например, в хлориде йода (ICl) хлор имеет СО -1, и йод +1. Хлор является более электроотрицательным, чем йод, поэтому его СО равна -1.
В бромной кислоте (HBrO4) кислород обладает СО -8 (-2 х 4 атома = -8). Водород имеет общую степень окисления +1. Сложение этих значений даёт СО -7. Так как конечное СО соединения должно быть нулевым, то СО брома равна +7.
Третьим исключением из правила является степень окисления галогена в элементарной форме (X2), где его СО равна нулю.
Галоген | СО в соединениях |
фтор | -1 |
хлор | -1, +1, +3, +5, +7 |
бром | -1, +1, +3, +4, +5 |
йод | -1, +1, +5, +7 |
астат | -1, +1, +3, +5, +7 |
Почему СО фтора всегда -1?
Электроотрицательность увеличивается с ростом периода. Поэтому фтор имеет самую высокую электроотрицательность из всех элементов, что подтверждается его положением в периодической таблице. Его электронная конфигурация 1s2 2s2 2p5. Если фтор получает еще один электрон, крайние р-орбитали полностью заполнены и составляют полный октет. Поскольку фтор имеет высокую электроотрицательность, он может легко отобрать электрон у соседнего атома. Фтор в этом случае изоэлектронен инертному газу (с восемью валентными электронами), все его внешние орбитали заполнены. В таком состоянии фтор гораздо более стабилен.
Получение и применение галогенов
В природе галогены находятся в состоянии анионов, поэтому свободные галогены получают методом окисления путём электролиза или с помощью окислителей. Например, хлор вырабатывается гидролизом раствора поваренной соли. Применение галогенов и их соединений многообразно.
- Фтор. Несмотря на то что фтор очень реактивен, он используется во многих областях промышленности. Например, он является ключевым компонентов политетрафторэтилена (тефлона) и некоторых других фторполимеров. Хлорфторуглероды представляют собой органические химические вещества, которые ранее использовались в качестве хладагентов и пропеллентов в аэрозолях. Их применение прекратилось из-за возможного их воздействия на окружающую среду. Их заменили гидрохлорфторуглероды. Фтор добавляют в зубную пасту (SnF2) и питьевую воду (NaF) для предотвращения разрушения зубов. Этот галоген содержится в глине, используемой для производства некоторых видов керамики (LiF), используется в ядерной энергетике (UF6), для получения антибиотика фторхинолона, алюминия (Na3AlF6), для изоляции высоковольтного оборудования (SF6).
- Хлор также нашёл разнообразное применение. Он используется для дезинфекции питьевой воды и плавательных бассейнов. Гипохлорит натрия (NaClO) является основным компонентом отбеливателей. Соляная кислота широко используется в промышленности и лабораториях. Хлор присутствует в поливинилхлориде (ПВХ) и других полимерах, которые используются для изоляции проводки, труб и электроники. Кроме того, хлор оказался полезен и в фармацевтической промышленности. Лекарственные средства, содержащие хлор, используются для лечения инфекций, аллергии и диабета. Нейтральная форма гидрохлорида – компонент многих препаратов. Хлор используется также для стерилизации больничного оборудования и дезинфекции. В сельском хозяйстве хлор является компонентом многих коммерческих пестицидов: ДДТ (дихлородифенилтрихлорэтан) использовался в качестве сельскохозяйственного инсектицида, но его использование было прекращено.

- Бром, благодаря своей негорючести, применяется для подавления горения. Он также содержится в бромистом метиле, пестициде, используемом для хранения урожая и подавления бактерий. Однако чрезмерное использование бромистого метила было прекращено из-за его воздействия на озоновый слой. Бром применяют при производстве бензина, фотоплёнки, огнетушителей, лекарств для лечения пневмонии и болезни Альцгеймера.
- Йод играет важную роль в надлежащем функционировании щитовидной железы. Если организм не получает достаточного количества йода, происходит увеличение щитовидной железы. Для профилактики зоба данный галоген добавляют в поваренную соль. Йод также используется в качестве антисептического средства. Йод содержится в растворах, используемых для очистки открытых ран, а также в дезинфицирующих спреях. Кроме того, йодид серебра имеет важное значение в фотографии.
- Астат – радиоактивный и редкоземельный галоген, поэтому ещё нигде не используется. Тем не менее полагают, что этот элемент может помочь йоду в регуляции гормонов щитовидной железы.
fb.ru
Галогены: характеристика, свойства и примеры
Общая характеристика галогенов
Электронная конфигурация внешнего энергетического уровня галогенов ns2np5. Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления «-1» и является самым электроотрицательным элементом.
Молекулы галогенов двухатомны: F2, Cl2, Br2, I2. С ростом заряда ядра атома химического элемента, т.е. при переходе от фтора к йоду окислительная способность галогенов снижается, что подтверждается способностью вытеснения нижестоящих галогенов вышестоящими из галогеноводородных кислот и их солей:
Br2 + 2HI = I2 + 2HBr
Cl2 + 2KBr = Br2 + 2KCl
Физические свойства галогенов
При н.у. фтор – газ светло-желтого цвета, обладающий резким запахом. Ядовит. Хлор – газ светло-зеленого цвета, также как и фтор имеет резкий запах. Сильно ядовит. При повышенном давлении и комнатной температуре легко переходит в жидкое состояние. Бром – тяжелая жидкость красно-бурого цвета с характерным неприятным резким запахом. Жидкий бром, а также его пары сильно ядовиты. Бром плохо растворяется в воде и хорощо в неполярных растворителях. Йод – твердое вещество темно-серого цвета с металлическим блеском. Пары йода имеют фиолетовый цвет. Йод легко возгоняется, т.е. переходит в газообразное состояние из твердого, при этом минуя жидкое состояние.
Получение галогенов
Галогены можно получить при электролизе растворов или расплавов галогенидов:
MgCl2 = Mg + Cl2 (расплав)
Наиболее часто галогены получают по реакции окисления галогенводородных кислот:
MnO2 + 4HCl = MnCl2 + Cl2↑ +2H2O
K2Cr2O7 + 14HCl = 3Cl2↑ + 2KCl +2CrCl3 +7H2O
2KMnO4 +16HCl = 2MnCl2 +5Cl2↑ +8H2O +2KCl
Химические свойства галогенов
Наибольшей химической активностью обладает фтор. Большинство химических элементов даже при комнатной температуре взаимодействует с фтором, выделяя большое количество теплоты. Во фторе горит даже вода:
2H2O + 2F2 =4HF + O2↑
Свободный хлор менее реакционноспособен, чем фтор. Он непосредственно не реагирует с кислородом, азотом и благородными газами. Со всеми остальными веществами он взаимодействует подобно фтору:
2Fe + Cl2 = 2FeCl3
2P + 5Cl2 = 2PCl5
При взаимодействии хлора с водой на холоде происходит обратимая реакция:
Cl2 + H2O↔HCl +HClO
Смесь, представляющую собой продукты реакции, называют хлорной водой.
При взаимодействии хлора с щелочами на холоде образуются смеси хлоридов и гипохлоритов:
Cl2 + Ca(OH)2 = Ca(Cl)OCl + H2O
При растворении хлора в горячем растворе щелочи происходит реакция:
3Cl2 + 6KOH=5KCl +KClO3+3H2O
Бром, как и хлор растворяется в воде и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод в воде практически нерастворим.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Примеры решения задач
ru.solverbook.com
