Общая характеристика галогенов
Цели урока:
Образовательные:
- Охарактеризовать особенности положения галогенов в Периодической системе Д.И.Менделеева.
- Охарактеризовать особенности строения атомов галогенов.
- Охарактеризовать физические свойства галогенов.
- Охарактеризовать химические свойства галогенов.
- Обобщить знания учащихся об областях применения галогенов, их роли в работе организма человека.
Развивающие:
- Продолжить формирование умений учащихся описывать положение элементов в Периодической системе, строение атомов, исходя из этого положения.
- Продолжить формирование умений учащихся описывать химические свойства элементов исходя из их положения в Периодической системе и строения атомов этих элементов.
- Закрепить знания, умения и навыки учащихся по составлению уравнений окислительно-восстановительных реакций.

Воспитывающие: Развить у учащихся навыков логического мышления, умений делать выводы, обобщать и сравнивать.
Оборудование:
- Периодическая система химических элементов Д.И.Менделеева,
- Учебник «Химия – 8» под редакцией Н.Е.Кузнецовой, 2011 г.
- компьютер,
- проектор,
- Электронная презентация урока Power Point «Галогены» (Презентация)
Реактивы:
- иод кристаллический
- круглодонная колба
- спиртовка
- спички
Класс разбивается на группы, которые получают задание подготовить дополнительный материал по темам
- Применение и действие на организм фтора.
- Применение и действие на организм хлора.
- Применение и действие на организм брома.
- Применение и действие на организм иода.

Тип урока: изучение нового учебного материала.
Вид урока: смешанный
Ход урокаI. Организационный момент- приветствие
- подготовка учащихся к работе
- наличие учащихся
Сегодня мы с Вами поговорим об элементах, расположенных в одной группе периодической системы (седьмая группа, главная подгруппа) (Слайд № 3). Эти элементы объединены одним названием «Галогены», что в переводе с греческого означает рождающие соли (греч. hals — соль и genes — рождающий, рожденный). Галогены так названы потому, что при взаимодействии с металлами они непосредственно (сразу) образуют соли.
III. Основная часть урока.1. Положение в Периодической системе.
Положение в Периодической системе.
Галогены находятся в VII группе главной подгруппе.
К галогенам относятся
- ФТОР 2 период
- ХЛОР 3 период
- БРОМ 4 период
- ИОД 5 период
- АСТАТ 6 период (Слайд 4)
2. Строение атомов (Заполнение таблицы Слайд № 5)
Как вниз по группе изменяется относительная атомная масса?
Какой физический смысл имеет номер периода, в котором находится элемент?
Как вниз по группе изменяется число электронных слоев?
Как вниз по группе изменяется радиус атомов?
Какой физический смысл имеет номер группы, в которой находится элемент?
Сколько же электронов на внешнем слое у галогенов?
Как вниз по группе изменяются неметаллические свойства?
Как вниз по группе изменяются окислительно-восстановительные свойства?
| Элемент | Ar | Число электронных слоев | Радиус атома | Числовалентных электронов | не Металлические свойства | Окислительные свойства |
| F | 19 | 2 слоя | увеличивается | 7 электронов | уменьшаются | уменьшаются |
| Cl | 35, 5 | 3 слоя | 7 электронов | |||
| Br | 80 | 4 слоя | 7 электронов | |||
| I | 5 слоев | 7 электронов | ||||
| At | [210] | 6 слоев | 7 электронов |
Итак, мы выяснили, как изменяются свойства элементов вниз по группе и что общего в их строении.
Наличие 7 электронов на внешнем слое определяет общее в строении молекул галогенов.
3. Строение молекулы галогенов.
Строение молекулы галогенов рассмотрим на примере хлора. Построим двухатомную молекулу хлора. (На доске это задание выполняет ученик) Проверка осуществляется с помощью слайда презентации. (Слайд № 6)
Все галогены образуют двухатомные молекулы – F2, Cl2, Br2, I2.
Связь одинарная.
Тип связи – ковалентная неполярная связь.
Как вы думаете, какая кристаллическая решетка характерна для галогенов?
Какие физические свойства характерны для веществ с молекулярной кристаллической решеткой?
4. Физические свойства галогенов.
Рассмотрим фотографии галогенов (Слайды №7 – №11)
Фтор и хлор газы, бром летучая жидкость ( все пространство в ампуле заполнено парами брома). Иод твердое вещество, но он тоже обладает свойством летучести. Для него характерна возгонка – процесс перехода из твердого состояния в газообразное, минуя жидкость.
Заполним таблицу (Слайд №12)
| Галоген | Агрегатное состояние | Цвет | Запах |
T плавления | Т кипения |
| F2 | газ | Бледно-желтый | Резкий, раздражающий запах | − 219,7°С | − 188,2°С |
| Cl2 | газ | Желто-зеленый | Резкий, неприятный запах | − 100°С | − 34°С |
| Br2 | жидкость | Красно-бурый | Резкий удушающий, пары токсичны | − 7,2°С | 58,8°С |
| I2 | тв.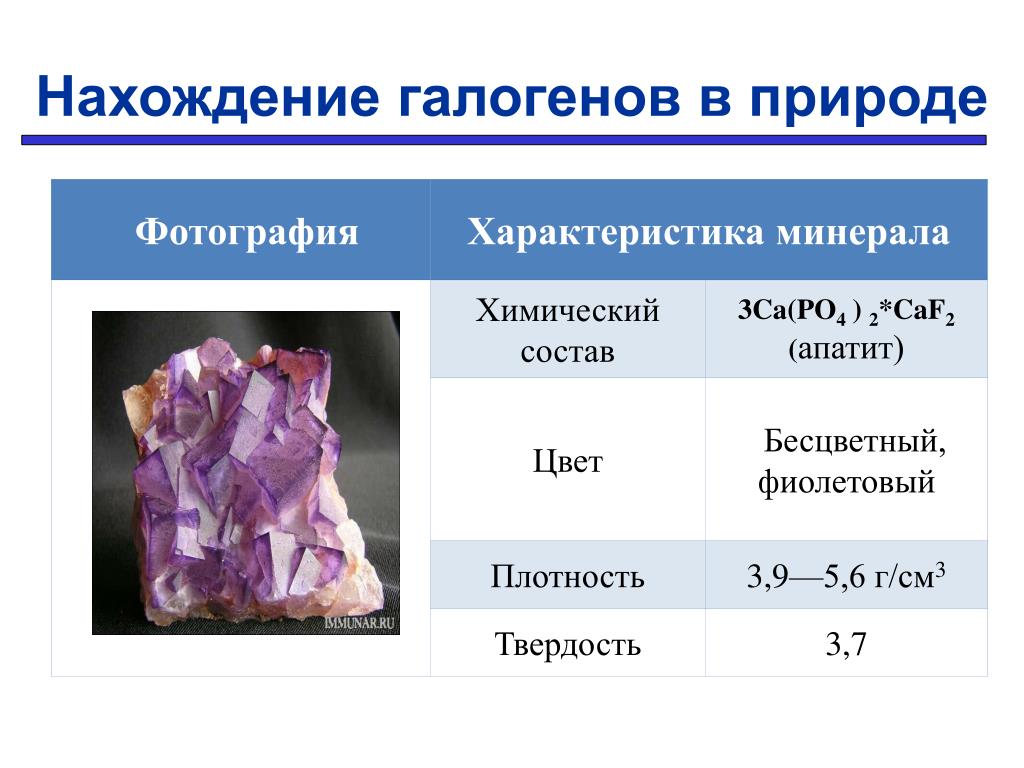 вещество вещество |
Темно-фиолетовый | Специфический резкий запах | 113,5°С | 184,3°С |
Астат – радиоактивный элемент. (Слайд № 13)
Астат был вторым (после технеция) элементом, синтезированным искусственно.
Он является наиболее редким элементом среди всех, обнаруженных в природе.
В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.
Образует сине-чёрные кристаллы.
Очень радиоактивен, поэтому о нём сравнительно мало известно.
Период полураспада наиболее долгоживущего изотопа астата-210 равен 8,1 часа.
Химические свойства мало изучены.
5. Нахождение галогенов в природе.
Галогены в свободном виде в природе не встречаются.
Фтор распространен в виде минерала флюорита (плавиковый шпат) СаF2. (Слайд № 14)
Хлор встречается в виде минерала галит (каменная соль) NaCl (Слайд № 15) и сильвин KCl (Слайд № 16)
Бром и иод встречаются в виде соединений в природных водах. Много иода содержится в морских водорослях ламинарии. (Слайд № 17)
Много иода содержится в морских водорослях ламинарии. (Слайд № 17)
6. Химические свойства галогенов. (Слайд № 18)
На уроке рассмотрены следующие химические свойства:
- А) Взаимодействие с металлами (Слайд № 19)
- Б) Взаимодействие с водородом (Слайд № 20)
- В) Взаимодействие с водой (Слайд № 21)
- Г) Взаимодействие со сложными веществами. (Слайд № 22)
Ребята записывают уравнения реакций, разбирают их как окислительно-восстановительные реакции.
Учитель показывает видео опыты
- «Взаимодействие железа с хлором»
- «Взаимодействие алюминия с бромом»
- «Получение иодида алюминия»
- «Взаимодействия водорода с хлором»
7. Применение галогенов.
Выступление ребят, которые готовили дома сообщения о применении галогенов:
- Фтор (Слайд № 23)
- Хлор (Слайд № 24)
- Бром (Слайд № 25)
- Иод (Слайд № 26)
8. Ребята рассказываю о роли, которую играют галогены в жизнедеятельности организма человека. (Слайды № 27 — № 30)
Ребята рассказываю о роли, которую играют галогены в жизнедеятельности организма человека. (Слайды № 27 — № 30)
Итак, о каких элементах мы говорили сегодня на уроке?
Что общего в строении этих элементов?
Каково строение молекул галогенов?
Какая у них кристаллическая решетка?
Какие физические свойства характерны для веществ с этой кристаллической решеткой?
Назовите основные химические свойства галогенов?
Какой галоген самый химически активный?
Как изменяется активность галогенов вниз по группе?
Какой галоген является единственным жидким неметаллом?
Какой галоген входит в состав зубной эмали и костей?
Недостаток какого галогены вызывает заболевания щитовидной железы?
Какой галоген входит в состав большинства зубных паст?
V. Домашнее задание:Учебник «Химия-8» Кузнецова Н. Е. § 55, № 1 – 5. (Слайд № 31)
Е. § 55, № 1 – 5. (Слайд № 31)
(Приложение 1)
Галогены, подготовка к ЕГЭ по химии
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.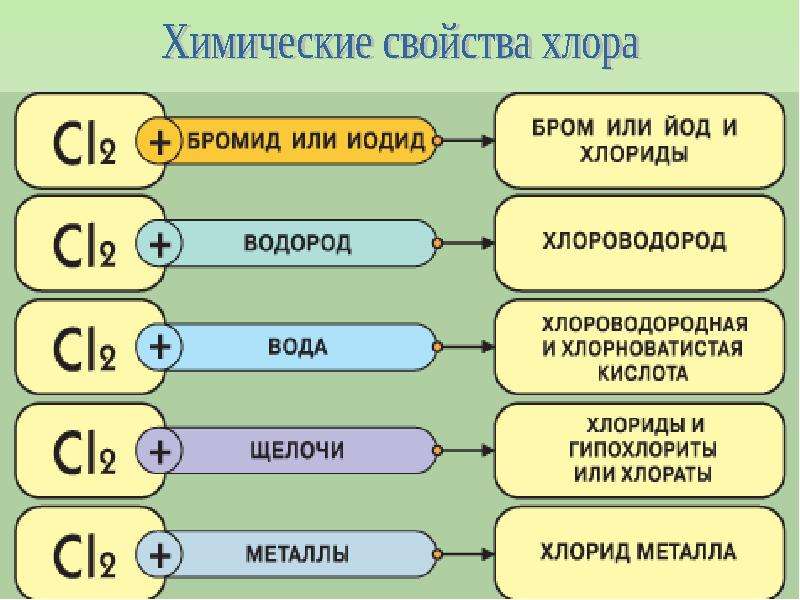
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F — 2s22p5
- Cl — 3s23p5
- Br — 4s24p5
- I — 5s25p5
- At — 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит
Простые вещества — F
2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают
электролизом водного раствора хлорида натрия.
Например, хлор в промышленности получают
электролизом водного раствора хлорида натрия.
NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl
В лабораторных условиях галогены могут быть получены следующими реакциями.
HCl + MnO2 → MnCl2 + Cl2 + H2O
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере
фтора самовоспламеняются.
Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере
фтора самовоспламеняются.
Al + F2 → AlF3
Cu + Cl2 → CuCl2
Na + Br2 → NaBr
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ;)
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F—)
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод — Br—)
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO
Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
Более активные вытесняют менее активные.
KCl + F2 → KF + Cl2
KBr + Cl2 → KCl + Br2
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
Получение
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.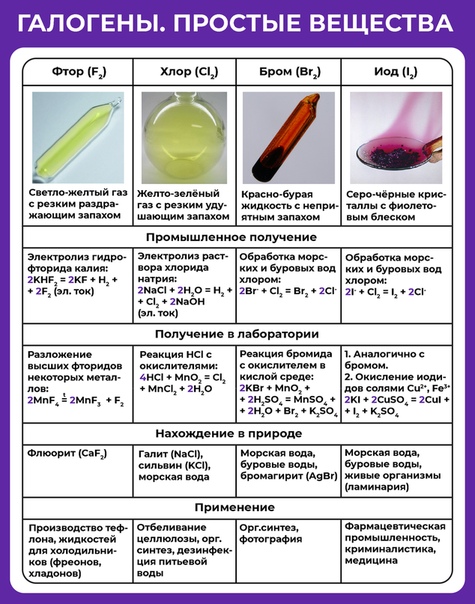
H2 + Cl2 → HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H2SO4 → NaHSO4 + HCl↑
CaF2 + H2SO4 → CaSO4 + HF
PBr3 + H2O → HBr↑ + H3PO3
H2S + I2 → S + HI
Химические свойства
- Кислотные свойства
- С солями
- Восстановительные свойства
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Mg + HBr → MgBr2 + H2↑
Zn + HCl → ZnCl2 + H2↑
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na2O + HCl → NaCl + H2O
ZnO + HI → ZnI2 + H2O
KOH + HCl → KCl + H2O (реакция нейтрализации)
Cr(OH)3 + HCl → CrCl3 + H2O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO3 + HCl → AgCl + HNO3
Li2CO3 + HBr → LiBr + H2CO3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
HI + MnO2 → I2 + MnI2 + H2O
HI + H2SO4 → I2 + H2S + H2O
HI + O2 → H2O + I2
HI + Br2 → HBr + I2
HBr + H2SO4 → Br2 + SO2 + H2O
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с
плавиковой кислотой.
В этой связи важно выделить реакцию SiO2 с
плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Галогены: характеристика, свойства и примеры
Общая характеристика галогенов
Электронная конфигурация внешнего энергетического уровня галогенов ns2np5. Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления
«-1» и является самым электроотрицательным элементом.
Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления
«-1» и является самым электроотрицательным элементом.
Молекулы галогенов двухатомны: F2, Cl2, Br2, I2. С ростом заряда ядра атома химического элемента, т.е. при переходе от фтора к йоду окислительная способность галогенов снижается, что подтверждается способностью вытеснения нижестоящих галогенов вышестоящими из галогеноводородных кислот и их солей:
Br2 + 2HI = I2 + 2HBr
Cl2 + 2KBr = Br2 + 2KCl
Физические свойства галогенов
При н.у. фтор – газ светло-желтого цвета, обладающий резким запахом. Ядовит. Хлор – газ светло-зеленого цвета, также как и фтор имеет резкий запах. Сильно ядовит. При повышенном давлении и комнатной температуре легко переходит в жидкое состояние. Бром – тяжелая жидкость красно-бурого цвета с характерным неприятным резким запахом. Жидкий бром, а также его пары сильно ядовиты. Бром плохо растворяется в воде и хорощо в неполярных растворителях. Йод – твердое вещество темно-серого цвета с металлическим блеском. Пары йода имеют фиолетовый цвет. Йод легко возгоняется, т.е. переходит в газообразное состояние из твердого, при этом минуя жидкое состояние.
Сильно ядовит. При повышенном давлении и комнатной температуре легко переходит в жидкое состояние. Бром – тяжелая жидкость красно-бурого цвета с характерным неприятным резким запахом. Жидкий бром, а также его пары сильно ядовиты. Бром плохо растворяется в воде и хорощо в неполярных растворителях. Йод – твердое вещество темно-серого цвета с металлическим блеском. Пары йода имеют фиолетовый цвет. Йод легко возгоняется, т.е. переходит в газообразное состояние из твердого, при этом минуя жидкое состояние.
Получение галогенов
Галогены можно получить при электролизе растворов или расплавов галогенидов:
MgCl2 = Mg + Cl2 (расплав)
Наиболее часто галогены получают по реакции окисления галогенводородных кислот:
MnO2 + 4HCl = MnCl2 + Cl2↑ +2H2O
K2Cr2O7 + 14HCl = 3Cl2↑ + 2KCl +2CrCl3 +7H2O
2KMnO4 +16HCl = 2MnCl2 +5Cl2↑ +8H2O +2KCl
Химические свойства галогенов
Наибольшей химической активностью обладает фтор. Большинство химических элементов даже при комнатной температуре взаимодействует с фтором, выделяя большое количество теплоты. Во фторе горит даже вода:
Большинство химических элементов даже при комнатной температуре взаимодействует с фтором, выделяя большое количество теплоты. Во фторе горит даже вода:
2H2O + 2F2 =4HF + O2↑
Свободный хлор менее реакционноспособен, чем фтор. Он непосредственно не реагирует с кислородом, азотом и благородными газами. Со всеми остальными веществами он взаимодействует подобно фтору:
2Fe + Cl2 = 2FeCl3
2P + 5Cl2 = 2PCl5
При взаимодействии хлора с водой на холоде происходит обратимая реакция:
Cl2 + H2O↔HCl +HClO
Смесь, представляющую собой продукты реакции, называют хлорной водой.
При взаимодействии хлора с щелочами на холоде образуются смеси хлоридов и гипохлоритов:
Cl2 + Ca(OH)2 = Ca(Cl)OCl + H2O
При растворении хлора в горячем растворе щелочи происходит реакция:
3Cl2 + 6KOH=5KCl +KClO3+3H2O
Бром, как и хлор растворяется в воде и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод в воде практически нерастворим.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Примеры решения задач
Галогены. Химия галогенов и их соединений
1. Положение галогенов в периодической системе химических элементов
2. Электронное строение галогенов
3. Физические свойства и нахождение в природе
4. Соединения галогенов
5. Способы получения галогенов
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с серой
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6. 1.5. Взаимодействие с водородом
1.5. Взаимодействие с водородом
6.1.6. Взаимодействие с галогенами
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с водой
6.2.2. Взаимодействие с щелочами
6.2.3. Взаимодействие с солями и галогеноводородами
6.2.4. Взаимодействие с восстановителями
Галогеноводороды
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Диссоциация
3.3. Взаимодействие с солями
3.4. Восстановительные свойства
3.5. Взаимодействие с оксидом кремния (IV)
Соли-галогениды
Способы получения галогенидов
Химические свойства галогенидов
Кислородсодержащие кислоты галогенов
1. Хлорноватистая кислота и ее соли
2. Хлористая кислота и ее соли
3. Хлорноватая кислота и ее соли
4. Хлорная кислота и ее соли
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д. И. Менделеева.
И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns2np5.
Например, электронная конфигурация фтора:
Электронная концигурация хлора:
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII.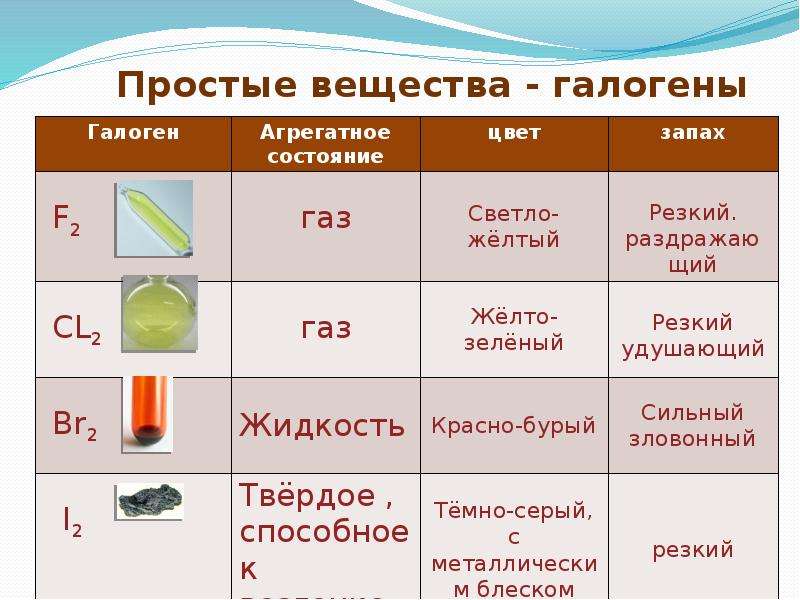 Также для галогенов характерны валентности I, III, V.
Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s22p5 | … 3s23p5 | … 4s24p5 | … 5s25p5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220оС | –101оС | –7оС | 113,5оС |
| Т кипения | –188оС | –34оС | 58оС | 185оС |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются ионы натрия:
K(–): Na+ +1e → Na0
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза расплава хлорида натрия:
2Na+ + 2Cl− → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH−
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза раствора хлорида натрия:
2H2O + 2Cl− → H2°↑ + 2OH− + Cl2°↑
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например, взаимодействием соляной кислоты с оксидом марганца (IV)
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
2KHF2 → 2K + H2 + 2F2
3. Получение брома.
Бром можно получить окислением ионов Br– сильными окислителями.
Например, бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например, оксид марганца (IV):
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
4. Получение йода.
Йод получают окислением ионов I– сильными окислителями.
Например, хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например, оксид марганца (IV) в кислой среде окисляет йодид калия:
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей. Галогены реагируют с металлами и неметаллами.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
2F2 + O2 → 2OF2
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример: алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
F2 + H2 → 2HF
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Cl2 + H2 → 2HCl
Бром также реагирует с водородом с образованием бромоводорода:
Br2 + H2 → 2HBr
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
I2 + H2 ↔ 2HI
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например, фтор окисляет хлор, бром и йод:
Cl2 + F2 → 2ClF
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например, хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлорную кислоту:
Cl2 + 6H2O ↔ 5HCl + HClO3
Фтор реагирует с водой со взрывом:
2F2 + 2H2O → 4HF + O2
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например, хлор реагирует с холодным раствором гидроксидом натрия:
Сl2 + 2NaOH (хол.) → NaCl + NaClO + H2O
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
3Cl2 + 6NaOH (гор.) → 5NaCl + NaClO3 + 3H2O
Еще пример: хлор растворяется в холодном растворе гидроксида кальция:
2Сl2 + 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2 + 2H2O
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например, фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl+F–
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
Cl2 + I2 + H2O → HCl + HIO3
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например, хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Cl2 + H2O + Na2SO3 → 2HCl + Na2SO4
Также галогены окисляют пероксиды:
Cl2 + 3H2O2 → 2HCl + 2H2O + O2
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
ГалогеноводородыСтроение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например, действием концентрированной серной кислоты на хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) → NaHSO4 + HCl↑
Галогеноводороды получают также прямым взаимодействием простых веществ:
Cl2 + H2 → 2HCl
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства. Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами. Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например, хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
HCl + NH3 → NH4Cl
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами, расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например, соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют, образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H+ + F–
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H+ + Cl–
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например, соляная кислота реагирует с карбонатом кальция:
2HCl + CaCO3 → CaCl2 + 2H2O + CO2
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами. При этом более активные галогены вытесняют менее активные.
Например, бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например: концентрированная соляная кислота окисляется оксидом марганца (IV):
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например, бромоводород окисляется концентрированной серной кислотой:
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
14HBr + K2Cr2O7 → 2KBr + 2CrBr3 + 3Br2 + 7H2O
Или с оксидом марганца (IV):
4HBr + MnO2 → MnBr2 + Br2 + 2H2O
Пероксид водорода также окисляет бромоводород до молекулярного брома:
2HBr + H2O2 → Br2 + 2H2O
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например, йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
2HI + Fe2(SO4)3 → 2FeSO4 + I2 + H2SO4
Йодоводород легко окисляется соединениями азота, например, оксидом азота (IV):
2HI + NO2 → I2 + NO + H2O
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + 6HF(изб) → H2[SiF6] + H2O
Галогениды металловГалогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами. При этом галогены проявляют свойства окислителя.
Например, хлор взаимодействует с магнием и кальцием:
Cl2 + Mg → MgCl2
Cl2 + Ca → CaCl2
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например, соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например, при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример: взаимодействие оксида алюминия с соляной кислотой:
6HCl + Al2O3 → 2AlCl3 + 3H2O
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например, при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
2HCl + Cu(OH)2 → CuCl2 + 2H2O
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например, гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями, если образуется осадок, газ или вода.
Например, бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами. При этом более активные металлы вытесняют менее активные.
Например, магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например, натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например, при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
2KBr + 2H2O → H2↑ + 2KOH + Br2↑
4. Галогениды металлов проявляют восстановительные свойства. Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например, бромид калия окисляется концентрированной серной кислотой:
2KBr + 2H2SO4 (конц.) → 4K2SO4 + 4Br2 + SO2 + 2H2O
Еще пример: йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
8KI + 5H2SO4 (конц.) → 4K2SO4 + 4I2 + H2S + 4H2O или
8KI + 9H2SO4 (конц.) → 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 → I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 → I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O → 2CuI + 2K2SO4 + H2SO4
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака.
Например, хлорид серебра (I) растворяется под действием избытка раствора аммиака:
AgCl + NH3 → [Ag(NH3)2]Cl
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например, хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогеновРассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде:
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается:
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями.
Например, с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например, хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например, пероксид водорода:
HClO + H2O2 → HCl + H2O + O2
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например, соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Ca(ClO)2 + H2SO4 → CaSO4 + 2HCl + O2
Даже угольная кислота вытесняет гипохлориты:
Ca(ClO)2 + CO2 + H2O → CaCO3 + 2HClO
2. Гипохлориты вступают в обменные реакции с другими солями, если образуется слабый электролит.
Например, гипохлорит кальция реагирует с растворимыми карбонатами:
Ca(ClO)2 + Na2CO3 → CaCO3 + 2NaClO
3. При нагревании гипохлориты разлагаются:
Ca(ClO)2 → CaCl2 + O2
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
2ClO2 + H2O2 → 2HClO2 + O2
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
HClO2 + KOH → KClO2 + H2O
2. При длительном хранении разлагается:
4HClO2 → HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например, из хлората бария под действием серной кислоты:
Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
HClO3 + KOH → KClO3 + H2O
2. Хлорноватая кислота – сильный окислитель.
Например, хлорноватая кислота окисляет фосфор:
6P + 5HClO3 → 3P2O5 + 5HCl
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например, хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример: хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
5KClO3 + 6P → 5KCl + 3P2O5
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например, из перхлората натрия под действием серной кислоты:
2NaClO4 + H2SO4 → 2HClO4 + Na2SO4
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
HClO4 + KOH → KClO4 + H2O
2. Хлорная кислота – сильный окислитель.
Например, хлорная кислота окисляет углерод:
8HClO4 + 14C → 14CO2 + 4Cl2 + 4H2O
3. При нагревании хлорная кислота разлагается:
4HClO4 → 4ClO2 + 3O2 + 2H2O
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например, перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
KClO4 → KCl + 2O2↑
Еще пример: перхлорат калия окисляет алюминий:
3KClO4 + 8Al → 3KCl + 4Al2O3
Галогены — Госстандарт
О происхождении названий галогенов
Названия всех галогенов, за исключением фтора, происходят от греческих слов:
Название | Исходное слово | Значение |
Галоген | галс (греч.) ген (греч.) | Соль Образующий |
Фтор | флуо (лат.) | Течь, текучий (в старину минерал полевой шпат CaF, использовали в металлургии в качестве флюса для придания легкоплавкости шлакам) |
Хлор | хлорос (греч.) | Зеленовато-желтый |
Бром | бромос (греч.) | Зловонный |
Иод | иодес (греч.) | Фиолетовый |
Астат | астатос (греч.) | Неустойчивый |
Слог «ген» в качестве приставки либо суффикса входит во многие научные термины, например в слова генератор и антиген. Обычно он означает рост или образование чего-либо. Таким образом, слово галоген (гало + ген) означает «образующий соль».
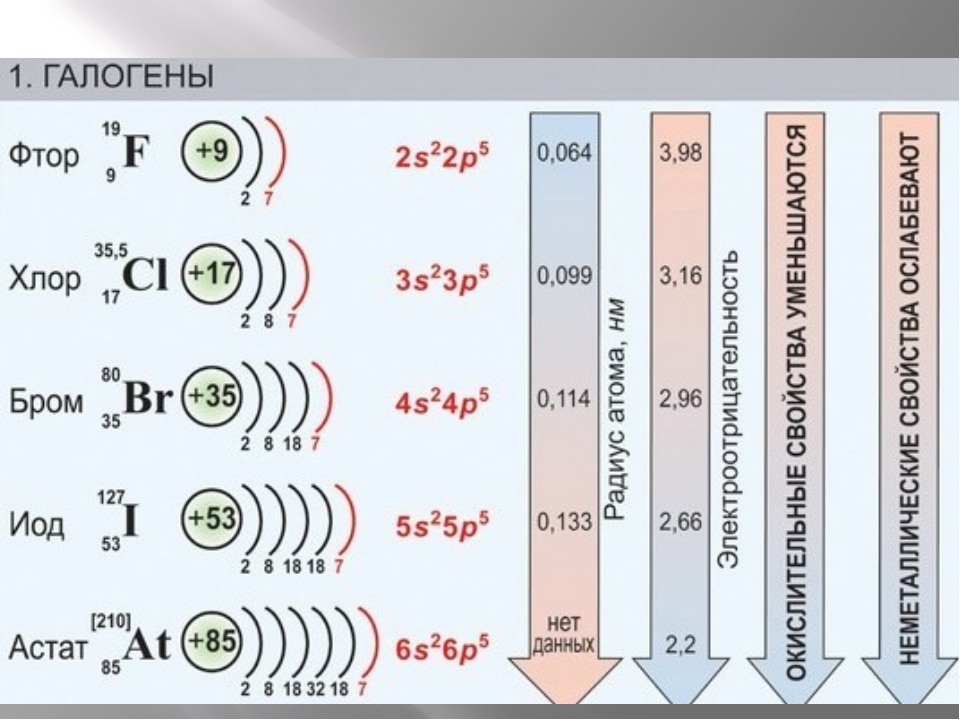
Электронная структура атомов галогенов
Атомы всех галогенов имеют во внешней оболочке семь электронов. Они легко присоединяют еще один электрон, образуя галогенидные ионы. Галогенид-ион имеет устойчивый октет электронов. Галогены характеризуются высокой электроотрицательностью и реакционной способностью и поэтому в свободном виде не встречаются в природе. Однако галогенид-ионы широко распространены в природе.
Галогены в свободном виде существуют в форме двухатомных молекул. Атомы в этих молекулах связаны между собой простой ковалентной связью. Каждая такая связь образуется в результате обобществления пары электронов — по одному от каждого атома:
В табл. 1 приведены некоторые данные о структуре атомов и молекул галогенов. Обратим внимание на то, что атомные и ионные радиусы галогенов, а также длины связи в их молекулах последовательно возрастают при перемещении к нижней части группы. Однако энергии диссоциации связи и, следовательно, прочность связи в молекулах галогенов при этом, наоборот, уменьшаются. Исключением в этом отношении является только фтор. Небольшая прочность связи фтора, по-видимому, обусловлена слишком близким расположением атомов в его молекуле. Это приводит к сильному отталкиванию между несвязывающими электронами, что вызывает ослабление связи.
Таблица 1. Электронное строение и свойства галогенов
Элемент | Атомный номер | Электронная конфигурация атомов | Конфигурация внешней оболочки | Атомный радиус, нм | Ионный радиус, нм | Длина связи, нм | Энергия диссоциации связи, кДж/моль |
Фтор | 9 | 2.7 | 2s22p5 | 0,072 | 0,136 | 0,142 | 158 |
Хлор | 17 | 2.8.7 | Зs23p5 | 0,099 | 0,181 | 0,200 | 242 |
Бром | 35 | 2.8.18.7 | 4s24р5 | 0,114 | 0,195 | 0,229 | 193 |
Иод | 53 | 2.8.18.18.7 | 5s25р5 | 0,133 | 0,216 | 0,266 | 151 |
Лабораторные методы получения галогенов
Хлор. Хлор можно получить в лабораторных условиях окислением концентрированной соляной кислоты манганатом(VII) калия:
Выделяющийся хлор пропускают через воду, чтобы удалить следы хлороводородов, а затем через концентрированную серную кислоту, чтобы осушить его. Полученный хлор собирают в перевернутом сосуде, из которого он вытесняет воздух.
Другой способ лабораторного получения хлора основан на реакции между отбеливающим порошком (гипохлоритом кальция) и разбавленной соляной кислотой:
Бром. Для получения брома в лабораторных условиях добавляют оксид марган-Ha(IV) к смеси концентрированной серной кислоты с бромидом калия. Бромоводород-ная кислота, обоазуюшаяся в оеакции между сеоной кислотой и бромидом калия:
окисляется оксидом марганца(IV)
Бром отделяют от реакционной смеси перегонкой.
Иод. Иод получают тем же способом, что и бром, только вместо бромида калия используется иодид калия. Полученный иод отделяют от реакционной смеси возгонкой.
Физические и биологические свойства
Все галогены — токсичные вещества.
Отравление хлором. Жидкий хлор вызывает серьезные ожоги кожи. Газообразный хлор оказывает сильное раздражающее действие, особенно на глаза и дыхательную систему. Он реагирует с водой, содержащейся в глазах, легких и слизистых оболочках органов дыхания, образуя соляную кислоту и хлорноватистую кислоту (см. ниже «Реакции с водой и щелочами»). Симптомами отравления хлором являются жжение глаз и органов дыхания, непрекращающийся кашель и, в тяжелых случаях, кровавая мокрота. В легких, отравленных хлором, может развиваться бронхиальная пневмония. Предельно допустимая концентрация хлора в воздухе составляет 0,005 мг/дм3. Уровень 0,2 мг/дм3 считается опасным, а концентрация 2 мг/дм3 может вызвать быструю смерть. Однако случаи отравления хлором со смертельным исходом в аварийной обстановке нечасты, поскольку людей, надышавшихся этим газом, обычно удается вовремя удалить из отравленной зоны.
Галогены имеют характерный резкий запах, хорошо знакомый тем, кто посещает плавательные бассейны.
Все галогены имеют большую летучесть. Она объясняется тем, что их молекулы удерживаются вместе лишь слабыми вандерваальсовыми силами. Хотя вандерваальсовы силы постепенно возрастают при перемещении к нижней части группы галогенов, они остаются очень слабыми даже в кристаллах иода, которые поэтому легко возгоняются при нагревании. При этом образуются фиолетовые пары иода. Температуры плавления и кипения галогенов указаны в табл. 2.
Таблица 2. Физические свойства галогенов
Элемент | Температура плавления, °С | Температура кипения, °С | Агрегатное состояние и внешний вид при 20°С |
Фтор | -220 | -188 | Бледно-желтый газ |
Хлор | -101 | -34 | Желто-зеленый газ |
Бром | -7 | 58 | Коричневая жидкость с тяжелыми коричневыми парами |
Иод | 114 | 183 | Блестящие серо-черные кристаллы |
Все галогены — окрашенные вещества. Интенсивность их окраски возрастает по мере перемещения к нижней части группы.
Галогены обладают небольшой растворимостью в воде. Раствор хлора в воде называется хлорной водой. Галогены хорошо растворяются в органических растворителях, образуя окрашенные растворы. Например, хлор растворяется в тетрахлоро-метане, образуя желтый раствор, бром образует красный раствор, а иод-фиолетовый.
Реакционная способность галогенов
Галогены представляют собой наиболее реакционноспособную группу элементов в периодической системе. Они состоят из молекул с очень низкими энергиями диссоциации связи (см. табл. 1), а их атомы имеют во внешней оболочке семь электронов и поэтому очень электроотрицательны. Фтор-наиболее электроотрицательный и наиболее реакционноспособный неметаллический элемент в периодической системе. Реакционная способность галогенов постепенно уменьшается при перемещении к нижней части группы. В следующем разделе будет рассмотрена способность галогенов окислять металлы и неметаллы и показано, как эта способность уменьшается в направлении от фтора к иоду.
Галогены как окислители
При пропускании газообразного сероводорода через хлорную воду происходит осаждение серы. Реакция протекает по уравнению
В этой реакции хлор окисляет сероводород, отнимая у него водород. Хлор окисляет также железо (II) до железа (III). Например, если перемешивать встряхиванием хлор с водным раствором сульфата железа (II), образуется сульфат железа (III):
Происходящая при этом окислительная полуреакция описывается уравнением
В качестве другого примера окислительного действия хлора приведем синтез хлорида натрия при сжигании натрия в хлоре:
В этой реакции происходит окисление натрия, поскольку каждый атом натрия теряет электрон, образуя ион натрия:
Хлор присоединяет эти электроны, образуя хлорид-ионы:
Таблица 3. Стандартные электродные потенциалы галогенов
Электродная реакция | Стандартный электродный потенциал Е°, В |
F2 (г.)+2e–«2F– (водн.) | +2,87 |
Cl2 (г.)+2e–«2Cl– (водн.) | +1,36 |
Br2 (ж.)+2e–«2Br– (водн.) | +1,09 |
I2 (тв.)+2e–«2I– (водн.) | +0,54 |
Таблица 4. Стандартные энтальпии образования галогенидов натрия
Галогенид | Стандартная энтальпия образования, DH°обр, m, кДж/моль |
NaF | -573 |
NaCl | -414 |
NaBr | -361 |
Nal | -288 |
Окислителями являются все галогены, из них фтор-самый сильный окислитель. В табл. 3 указаны стандартные электродные потенциалы галогенов. Из этой таблицы видно, что окислительная способность галогенов постепенно уменьшается в направлении к нижней части группы. Эту закономерность можно продемонстрировать, добавляя раствор бромида калия в сосуд с газообразным хлором. Хлор окисляет бромид-ионы, в результате чего образуется бром; это приводит к появлению окраски у прежде бесцветного раствора:
Таким образом, можно убедиться, что хлор более сильный окислитель, чем бром. Точно так же, если смешать раствор иодида калия с бромом, образуется черный осадок из твердого иода. Это означает, что бром окисляет иодид-ионы:
Обе описанные реакции являются примерами реакций вытеснения (замещения). В каждом случае более реакционноспособный, то есть являющийся более сильным окислителем, галоген вытесняет из раствора менее реакционноспособный галоген.
Окисление металлов. Галогены легко окисляют металлы. Фтор легко окисляет все металлы, исключая золото и серебро. Мы уже упоминали о том, что хлор окисляет натрий, образуя с ним хлорид натрия. Приведем еще один пример: когда поток газообразного хлора пропускают над поверхностью нагретых железных опилок, образуется хлорид железа (III), твердое коричневое вещество:
Даже иод способен, хотя и медленно, окислять металлы, расположенные в электрохимическом ряду ниже его. Легкость окисления металлов различными галогенами уменьшается при перемещении к нижней части VII группы. В этом можно убедиться, сравнивая энергии образования галогенидов из исходных элементов. В табл. 4 указаны стандартные энтальпии образования галогенидов натрия в порядке перемещения к нижней части группы.
Окисление неметаллов. За исключением азота и большинства благородных газов, фтор окисляет все остальные неметаллы. Хлор реагирует с фосфором и серой. Углерод, азот и кислород не вступают в реакции непосредственно с хлором, бромом или иодом. Об относительной реакционной способности галогенов к неметаллам можно судить, сравнивая их реакции с водородом (табл. 5).
Окисление углеводородов. При определенных условиях галогены окисляют углеводороды. Например, хлор полностью отщепляет водород от молекулы скипидара:
Окисление ацетилена может протекать со взрывом:
Таблица 5. Реакции галогенов с водородом
Реакция | Характер и условия протекания |
Н2(г.)+F2(г.) ® 2НF (г.) | Протекает со взрывом |
Н2(г.)+Сl2(г.) ® 2НСl (г.) | Протекает со взрывом на свету, но медленно в темноте |
Н2(г.)+Вr2(г.) ® 2НВr (г.) | Протекает только при нагревании и в присутствии катализатора |
Н2(г.)+I2(г.) ® 2НI (г.) | Протекает медленно даже при нагревании |
Реакции с водой и щелочами
Фтор реагирует с холодной водой, образуя фтороводород и кислород:
Хлор медленно растворяется в воде, образуя хлорную воду. Хлорная вода имеет небольшую кислотность вследствие того, что в ней происходит диспропорционирование хлора с образованием соляной кислоты и хлорноватистой кислоты:
Бром и иод диспропорционируют в воде аналогичным образом, но степень диспропорционирования в воде уменьшается от хлора к иоду.
Хлор, бром и иод диспропорционируют также в щелочах. Например, в холодной разбавленной щелочи бром диспропорционирует на бромид-ионы и гипобромит-ионы (бромат (I)-ионы):
При взаимодействии брома с горячими концентрированными щелочами диспропорционирование протекает дальше:
Иодат (I), или гипоиодит-ион, неустойчив даже в холодных разбавленных щелочах. Он самопроизвольно диспропорционирует с образованием иодид-иона и иодат(V)-иона.
Реакция фтора со щелочами, как и его реакция с водой, не похожа на аналогичные реакции других галогенов. В холодной разбавленной щелочи протекает следующая реакция:
В горячей концентрированной щелочи реакция с фтором протекает так:
Анализ на галогены и с участием галогенов
Качественный и количественный анализ на галогены обычно выполняется с помощью оаствора нитрата серебра. Например
Для качественного и количественного определения иода может использоваться раствор крахмала. Поскольку иод очень мало растворим в воде, его обычно анализируют в присутствии иодида калия. Так поступают по той причине, что иод образует с иодид-ионом растворимый трииодидный ион
Растворы иода с иодидами используются для аналитического определения различных восстановителей, например тиосульфат (VI)-ионов, а также некоторых окислителей, например манганат(VII)-ионов. Окислители смещают указанное выше равновесие влево, высвобождая иод. Иод затем титруют тиосульфатом (VI).
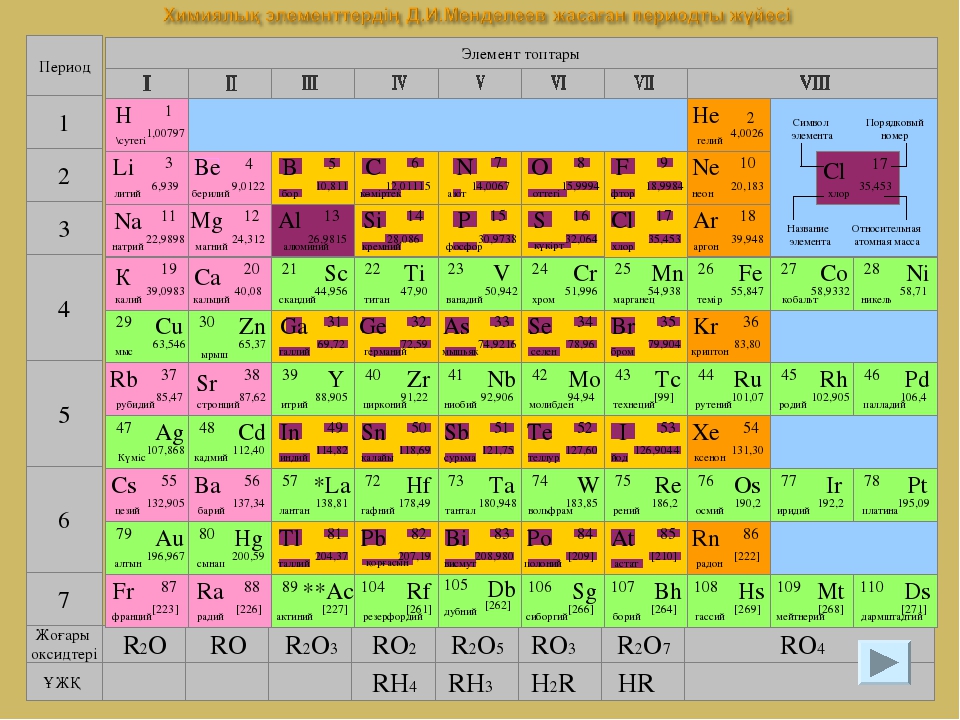
Галогены. Положение галогенов а периодической таблице. Хлор | Презентация к уроку по химии (8 класс):
Слайд 1
Положение галогенов в периодической таблице и строение их атомов F Cl At Br IСлайд 2
Улыбнись новому знанию Мы изучим непременно элементы галогены. А по-русски — солероды, Все – от фтора и до йода. Даже неустойчивый астат Быть в семействе этом рад. F Cl At Br I
Слайд 3
Ar Аргон 1 8 39,948 К r Криптон 36 83,80 Xe Ксенон 54 131,30 Группы элементов 1 2 4 5 6 3 7 I II III IV V VI VII VIII Na Натрий 11 22,9898 М g Магний 12 24,312 Al Алюминий 1 3 26,9815 Cl Хлор 1 7 35,453 Si Кремний 14 28,086 P Фосфор 15 30,9738 S Сера 17 32,064 К Калий 19 39,102 С a Кальций 20 40,08 Н Водород 1 1,00797 Не Гелий 2 4.0026 Li Литий 3 6.939 Ве Бериллий 4 9,0122 F Фтор 9 18,9984 О Кислород 8 15,9994 N Азот 7 14,0067 С Углерод 6 12,01115 В Бор 5 10,811 N е Неон 10 20,183 Скандий Sc 21 44 , 956 Титан Ti 22 47 , 90 Ванадий V 2 3 50,942 Хром Cr 2 4 51,996 Марганец 2 5 44 , 956 М n Железо 2 6 55,847 Fe Кобальт 2 7 58,9332 Со Никель 2 8 58,71 Ni Цинк 30 65,37 Zn Медь 2 9 63,546 С u Ge Германий 32 72,59 Ga Галлий 31 26,9815 Br Бром 35 79,904 Se Селен 34 78,96 As Мышьяк 33 74,9216 Sr Стронций 38 87,62 Rb Рубидий 37 85,47 Y 39 88,905 Иттрий Рутений 44 101,07 Ru Родий 45 102,905 Rh Палладий 46 106,4 Pd Технеций 43 [ 99 ] Тс Молибден 42 95,94 Мо Ниобий 41 92,906 Nb Цирконий 40 91,22 Zr Кадмий 48 112,40 С d Серебро 47 107,868 Ag In Индий 49 114,82 Sb Сурьма 51 121,75 Sn Олово 50 118,69 Т e Теллур 52 78,96 I 53 126,9044 Йод Ва Барий 56 137.34 Cs Цезий 55 132,905 La 57 138,81 Лантан * Гафний 72 178.49 Hf Тантал 73 180,948 Та Вольфрам 74 183.85 W Рений 75 186,2 Re Осмий 76 190,2 О s Иридий 77 192,2 Ir Платина 78 195,09 Р t Ртуть 80 200,59 Hg Золото 79 196,967 А u Т I Таллий 81 204,37 Ро Полоний 84 [ 210 ] В i Висмут 83 208,980 Pb Свинец 82 207,19 At 85 210 Астат Rn Радон 86 [ 222 ] R а Радий 88 [ 226 ] Fr Франций 87 [ 223 ] Ас 89 138,81 Актиний ** Борий 107 [ 262 ] Bh Сиборгий 106 [ 263 ] Sg Резерфордий 104 [ 261 ] Rf Дубний 105 [ 262 ] Db Хассий 108 [ 265 ] Hs Мейтнерий 109 [ 266 ] М t Пери – оды RO 4 RH R 2 O 7 RO 3 RH 2 R 2 O 5 RH 3 RO 2 RH 4 R 2 O 3 RO R 2 О Высшие оксиды ЛВС Галогены Положение галогенов в ПСХЭ
Слайд 4
Строение атома
Слайд 5
Строение атома
Слайд 6
История открытия галогенов F 2 Cl 2 Br 2 I 2 At
Слайд 7
В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора А. Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины. История открытия фтора Анри Муассан (1852 – 1907 г.) 2HF→H 2 ↑ + F 2 ↑
Слайд 8
В 1774 году шведский аптекарь К. Шееле открыл хлор. «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах». В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его «хлорин» (от «хлорос» — желто-зеленый). В 1812 году Гей-Люсеок дал газу название хлор. История открытия хлора Карл Вильгельм Шееле (1742 – 1786 г.) MnO 2 + 4HCl Cl 2 + MnCl 2 + 2H 2 O
Слайд 9
В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал — «мурид» (от латинского слова muria , означающего «рассол»). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от «бромос», с греческого «зловонный»). Балар писал: «Точь-в-точь как ртуть есть единственный металл, который имеет жидкую фазу при комнатной температуре, бром есть единственный жидкий неметалл» . История открытия брома Антуан Жером Балар (1802 – 1876 г.) 2NaBr + Cl 2 → 2NaCl + Br 2
Слайд 10
В 1811 году французский химик Бернар Куртуа открыл йод путём перегонки маточных растворов от азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (фармацевтической фирме в Дижоне. В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название «иод» происходит от греческого слова «иодэс» — «фиолетовый» (по цвету паров). История открытия йода Бернар Куртуа (1777 – 1838 г. ) 2 NaI + 2 H 2 SO 4 = I 2 + SO 2 + Na 2 SO 4 + 2 H 2 O
Слайд 11
В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат был получен искусственно в 1940 г. открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли). Для синтеза изотопа 211 At они облучали висмут альфа-частицами. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата. История открытия астата 209 83 Bi + 4 2 He → 211 85 At + 2 1 0 n Эрст Сегре (1914 – 1985 г.)
Слайд 12
Галогены
Слайд 13
Сравнение физических свойств Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются F 2 At 2 I 2 Br 2 Cl 2 светло-желтый газ желто-зеленый газ красно-бурая жидкость (возгоняется) фиолетовые кристаллы с металлическим блеском черно-синие кристаллы
Слайд 14
Фотография Характеристика минерала Химический состав Na С l (галит) Цвет Бесцветный, красный, желтый, синий, голубой Плотность 2,2—2,3 г/см 3 Твердость 2,5 Нахождение галогенов в природе
Слайд 15
Нахождение галогенов в природе Фотография Характеристика минерала Химический состав AgBr ( бромаргирит ) — примеси к другим минералам Цвет Бесцветный, розовый, желтый Плотность 5,1—6,3г/см 3 Твердость 1,9
Слайд 16
Нахождение галогенов в природе Фотография Характеристика минерала Химический состав CaF 2 (флюорит) Цвет Бесцветный, желтый, голубой, фиолетовый Плотность 3,4—4,9 г/см 3 Твердость 3,3
Слайд 17
Фотография Характеристика минерала Химический состав 3 Ca(PO 4 ) 2 *CaF 2 ( апатит) Цвет Бесцветный, фиолетовый Плотность 3,9—5,6 г/см 3 Твердость 3,7 Нахождение галогенов в природе
Слайд 18
Галогены в живых организмах
Слайд 19
F Скелет, зубы С l Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
Слайд 20
Применение фтора Тефлон (посуда) Фреон- CF 2 Cl 2 ( хладогент) Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
Слайд 21
Применение хлора О тбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических веществ Получение неорганических хлоридов
Слайд 22
Применение йода Лекарственные препараты Фотография Красители AgI для создания искусственных осадков Галогеновые электролампы
Слайд 23
Применение брома Лекарственные препараты Красители Фотография Ветеринарные препараты Ингибиторы коррозии Присадки к бензину
Слайд 24
Составьте кроссворд по теме «Галогены» Ключевым словом является слово «АСТАТ». Решите задачу: Определите объем хлора (н.у), который образуется при действии на 5,8 г перманганата калия раствора соляной кислоты массой 100 г, с массовой долей кислоты 36%. Домашнее задание
Слайд 25
Живая ниточка связала всех навек, Фтор,бром,хлор,йод,астат Земля и человек. И ты за эту ниточку держись, Чтоб никогда не прекращалась на планете Земля жизнь !
Слайд 26
Я много узнал нового
Слайд 27
Я многое не понял
Слайд 28
Спасибо з а работу !
Что такое галогены в химии и каково их биологическое значение в жизни человека
Элементы, которые относятся к 17-й группе периодической системы, применяются во многих отраслях народного хозяйства, а вещества, содержащие их соединения, широко используются в быту. Вряд ли можно представить жизнь без этих химических элементов. Хотя все они являются токсичными, без микроскопических количеств галогенов в воде и продуктах невозможно нормальное существование организмов. Рассмотрим, что такое галогены, и каково их значение в химии и биологии.
Что такое галогены
Пожалуй, многих не раз интересовал вопрос, что такое галогены в химии. Это элементы, относящиеся к XVII группе таблицы Менделеева. Раньше их причисляли к главной подгруппе VII группы. К галогенам относят фтор, хлор, бром, йод, астат.
Некоторые химики причисляют к ним искусственно синтезированное вещество теннесин с номером 117. Это пример галогена, который обладает радиоактивностью.
Вещества этой группы причисляют к неметаллам. Они считаются сильнейшими окислителями, причем это химическое свойство галогенов изменяется по мере уменьшения порядкового номера. Наиболее активным окислителем является фтор, который способен взаимодействовать даже с кислородом с образованием фторида. Способны проявлять свойства восстановителя со степенью окисления +7 (высшая). Недаром раньше таблица Менделеева помещала галогены в 7 группу.
В процессе химического взаимодействия с металлами образуют соли (отсюда и название). На внешней оболочке содержится 7 электронов. Атомы присоединяют недостающий электрон и таким образом заполняют ее. Следовательно, степень их окисления равна -1. Однако хлор, бром, йод, астат могут иметь степени окисления 1, 3, 5, 7 со знаком плюс (являясь восстановителем).
В этом кроется ответ на вопрос, с чем взаимодействует галоген. Особенности строения этих веществ таковы, что они реагируют практически со всеми элементами.
Интересно! Название «фтор» происходит от греческого «разрушение». Это сильнейший окислитель, который взаимодействует почти с любыми веществами. Атомы фтора не реагируют с неоном, гелием и аргоном и некоторыми фторидами.
Характеристика веществ
Узнаем, что такое галогены в химии. Характеристика списка галогенов следующая:
- строение внешнего слоя электронов — nS2nP5,
- по мере роста номера в таблице радиус атома становится больше, электроотрицательность падает, свойства неметалла снижаются,
- являются выраженными окислителями, причем эта способность элементов снижается по мере увеличения массы атома (единственное, с чем не реагирует галоген, — это благородные газы),
- все молекулы содержат 2 атома,
- сила кислот увеличивается по мере роста относительной массы атома.
Периодическая таблица показывает, что чем выше находится элемент, тем сильнее его окислительные способности.
Окислительные свойства атомов
Фтор
При нормальных условиях является бледно-желтым газом. Можно получить путем электролиза КНF2. Реагирует с водой с образованием фтороводорода и кислорода. Реакция водорода и фтора происходит очень активно. Взаимодействует с металлами и неметаллами.
Хлористоводородная кислота является слабой, фтороводород обратимо диссоциирует в воде с выходом ионов Н+ и F-.
Фтороводородная кислота способна растворить стекло:
SiO2 + 4НF → SiF4 + 2Н2О.
Хлор
Является газом зеленоватого цвета с удушающим запахом. Примеры реакций, с помощью которых можно его получить:
- МnO2 + 4НCl → МnСl2 + Сl2+ 2Н2O,
- 2КМnO4 + 16НCl → 2МnСl2 + 5Сl2 + 2КСl + 8Н2O.
Узнаем, каковы химические свойства хлора:
- Взаимодействие с металлами: 2К + Сl2 → 2КСl.
- Реакция с неметаллами: 2Р + 3Сl2 → 2РСlЗ.
- Реакции с щелочами: Сl2 + Сa(ОH)2 → CaОCl2 + h3O.
- Вытеснение йода: Cl2 + 2→ 2 + I2.
Список распространенных кислот:
- хлорноватистая кислота HClO (степень окисления хлора +1),
- хлористая кислота HClO2 (степень окисления +3),
- хлорноватая кислота HClO3 (степень окисления +5),
- хлорная кислота HClO4 (степень окисления +7).
Это интересно! Для чего делают и что это такое гидролиз солей
Бром
Бром представляет собой тяжелую темную жидкость с плохим запахом. Многих интересует, с чем он реагирует. Этот элемент вступает в реакцию с:
- металлами: 2Nа + Вr2 → 2NаВr,
- неметаллами: Н2 + Вr2 → 2НВr,
- водой: Н2 + h3O → НВr + НВrO,
- восстановителями: Вr2 + Н2S → S + 2НВr.
Бромистый водород хорошо реагирует с солями, основаниями, окисями металлов.
Галогены
Йод
Йод — кристаллическое вещество темного фиолетового оттенка. Растворяется в спирте, четыреххлористом углероде. Молекулы взаимодействуют с:
- металлами: К + I → KI,
- водородом: h3 + I2 → 2HI,
- основаниями: 3I2 + 6КOH → 5КI + КIO3 + 3h3O.
Йодистоводородная кислота является сильнейшим восстановителем. При реакции солей с ляписом образуется нерастворимое йодистое серебро. Йодная кислота является очень сильным окислителем (степень окисления йода +7).
Что касается астата, его можно получить только искусственным путем. Восстанавливается с помощью диоксида серы, осаждается сероводородом. Реагирует с йодом и бромом. Растворяется слабой соляной и азотной кислотой.
Физические и химические свойства элемента теннесин изучены мало ввиду малой продолжительности существования его изотопов. Предполагается, что тяжелые радиоактивные элементы могут обладать восстановительной активностью.
Полезное видео: урок химии галогены
Биологическая роль
Биологическое значение галогенов велико: без них не могут происходить важнейшие жизненные процессы.
Фтор встречается в составе костной и зубной ткани. Значительная часть его находится в эмали зубов, отчего она является крепкой. Поступает в организм с жидкостью. Дефицит этого элемента способствует развитию кариеса, а избыток — флюороз.
Встречается в курином желтке, овсе, молоке, перьях, шерсти, костях. Максимум фтора накапливается в листьях. Повышение количества фтора в воздухе способно вызвать тяжелое отравление.
Без такого элемента как хлор невозможна деятельность организмов. Поступает в виде хлористого натрия (кухонной соли). Наличие его в плазме крови способствует сохранению электролитного равновесия. Без хлора невозможно образование хлористоводородной кислоты сока желудка. Практически все продукты содержат это вещество. В жизни применяются многие химические вещества, содержащие хлор. Газ обладает удушающим действием, в больших концентрациях смертельно опасен для живых организмов.
Это интересно! Основные факторы влияющие на скорость химической реакции
Бром оказывает влияние на процессы возбудимости нервной системы. В сравнительно значительном количестве находится в морской воде. Каждый год из воды морей в воздух поступает до 4 миллионов тонн брома. В больших количествах элемент проявляет раздражающее действие.
Без йода невозможна выработка гормонов щитовидки. Играет важнейшую роль в организме, влияя на процессы слаженной деятельности нервной системы. Под контролем этого вещества находятся:
- работа мышц,
- сердцебиение,
- аппетит,
- процессы пищеварения,
- работа мозга.
Проникает в организм с многими продуктами, особенно дарами моря. Особенно много этого микроэлемента в морской капусте. Значительное количество элемента поступает в организм с морским воздухом.
Биологическая роль астата изучена недостаточно.
Токсичность
Фтор, йод, бром, хлор в чистом виде и высокой концентрации ядовиты. Контакт газа с кожей в течение 2 секунд приводит к сильному ожогу. Даже в малых концентрациях фтор раздражает слизистые оболочки.
При попадании хлора в легкие происходит ожог, в результате чего у человека развивается удушье. Причем концентрация элемента в воздухе, при которой начинается поражение легочной ткани, лишь немногим больше порога ощущения неприятного хлорного запаха.
Обратите внимание! Фосген — соединение углерода, кислорода и хлора обладает чрезвычайно сильным удушающим действием, вызывающим необратимый отек легких и неизбежный летальный исход. Противоядия против фосгена не существует.
Пары брома очень ядовиты. Смертельная доза при пероральном приеме составляет 14 мг на килограмм веса. При попадании на кожу вещество вызывает очень болезненные ожоги.
Вдыхание паров йода приводит к сильному удушью. При попадании его внутрь развиваются сильные ожоги пищевода и желудка.
Попадание в организм астата вызывает удушье и сильное радиоактивное облучение.
Использование
Значение любого галогена в жизни человека огромно.
Без фтора невозможно представить себе зубную пасту. Практически все ее виды содержат соединения этого элемента. Основной потребитель фтора — ядерная промышленность. Не меньше фтора потребляет и электротехника. В жизни все чаще применяются фторсодержащие пластмассы — тефлоны.
Хлор используют для отбеливания бумаги, ткани. Без него невозможен синтез пластмасс, каучука, почти всех видов красителей, клеев и растворителей. Большинство хлорсодержащих соединений ядовиты, поэтому их применяют для борьбы с сельскохозяйственными вредителями. До недавнего времени хлор использовали для хлорирования воды. К сожалению, история знает случаи применения хлора в качестве отравляющих веществ.
Это интересно! Уроки химии: катионы и анионы – что это такое
Без брома сложно представить развитие фотографии. Фотобумага содержит слой бромида серебра, которое под воздействием света разлагается. В ходе этой реакции серебро выпадает в осадок.
Йод широко применяется в медицине в качестве обеззараживающего средства в виде настойки на спирту. Входит в состав большого количества лекарственных препаратов. Используется и при получении фотоматериалов высокой светочувствительности.
Изотоп астата применяется в медицине для проведения специальных исследований для определения рака. Существуют способы применения галогенов в медицине для лечения рака.
Полезное видео: биологическое значение и применение галогенов
Вывод
Знание, какие элементы относят к галогенам, очень важно. Они находят применение практически во всех сферах человеческой деятельности. Без них невозможно функционирование любого живого организма. В то же время обладают чрезвычайно высокой химической активностью, могут вызвать тяжелые отравления даже при небольших концентрациях, так что работать с такими веществами нужно очень осторожно.
галоген | Элементы, примеры, свойства, использование и факты
Галоген , любой из шести неметаллических элементов, которые составляют группу 17 (группа VIIa) периодической таблицы. Элементами галогена являются фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Им было дано название галоген , от греческих корней hal — («соль») и — gen («производить»), потому что все они производят натриевые соли с аналогичными свойствами, из которых хлорид натрия — таблица соль или галит — наиболее известны.
Таблица МенделееваСовременная версия периодической таблицы элементов.
Encyclopædia Britannica, Inc.Популярные вопросы
Что такое галогенные элементы?
Каковы основные свойства галогенных элементов?
Галогенные элементы очень реактивны. Они производят соли с натрием, из которых наиболее известна поваренная соль (хлорид натрия, NaCl). Галогенные элементы имеют семь валентных электронов на внешней электронной оболочке. Следовательно, когда эти элементы могут получать электрон от другого атома, они образуют очень стабильные соединения, поскольку их внешняя оболочка заполнена.
Для чего используются галогенные элементы?
Почему эти элементы называются галогенами?
При взаимодействии этих элементов с натрием они образуют соли. Самым известным из них является хлорид натрия или обычная поваренная соль (также называемая галитом). Слово галоген происходит от греческих корней hal- , что означает «соль», и -gen , что означает «производить».
Из-за своей высокой реакционной способности свободные галогеновые элементы не встречаются в природе.В комбинированной форме фтор — самый распространенный из галогенов в земной коре. Процентное содержание галогенов в магматических породах земной коры составляет 0,06 фтора, 0,031 хлора, 0,00016 брома и 0,00003 йода. Астатин и теннессин не встречаются в природе, поскольку состоят только из короткоживущих радиоактивных изотопов.
Галогеновые элементы очень похожи друг на друга по своему общему химическому поведению и по свойствам их соединений с другими элементами.Однако происходит постепенное изменение свойств от фтора через хлор, бром и йод до астата — разница между двумя последовательными элементами наиболее выражена для фтора и хлора. Фтор является наиболее реактивным из галогенов и, фактически, из всех элементов, и у него есть некоторые другие свойства, которые отличают его от других галогенов.
Хлор — самый известный из галогенных элементов. Свободный элемент широко используется в качестве агента для очистки воды и используется в ряде химических процессов.Поваренная соль, хлорид натрия, конечно же, одно из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в водопроводную воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазок. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве общих пестицидов. В прошлом дибромид этилена широко использовался в качестве добавки к этилированному бензину.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасВероятно, наиболее важное обобщение, которое можно сделать в отношении галогенных элементов, состоит в том, что все они являются окислителями; то есть они повышают степень окисления или степень окисления других элементов — свойство, которое раньше приравнивалось к комбинации с кислородом, но теперь интерпретируется с точки зрения переноса электронов от одного атома к другому. При окислении другого элемента восстанавливается сам галоген; то есть степень окисления 0 свободного элемента снижается до -1.Галогены могут объединяться с другими элементами с образованием соединений, известных как галогениды, а именно фторидов, хлоридов, бромидов, йодидов и астатидов. Многие из галогенидов можно рассматривать как соли соответствующих галогенидов водорода, которые представляют собой бесцветные газы при комнатной температуре и атмосферном давлении и (за исключением фтороводорода) образуют сильные кислоты в водном растворе. Действительно, общий термин соль происходит от каменной соли или поваренной соли (хлорид натрия). Склонность галогенных элементов образовывать солеоподобные (т.е.е., высокоионный) соединения увеличивается в следующем порядке: астат <йод <бром <хлор <фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или йодиды. (Часто астат не упоминается в общих обсуждениях галогенов, потому что о нем известно меньше, чем о других элементах.)
ионная связь: хлорид натрия или поваренная сольИонная связь в хлориде натрия. Атом натрия (Na) отдает один из своих электронов атому хлора (Cl) в химической реакции, в результате чего положительный ион (Na + ) и отрицательный ион (Cl —) образуют стабильное ионное соединение. (хлорид натрия; поваренная соль) на основе этой ионной связи.
Encyclopædia Britannica, Inc.Окислительная сила галогенов увеличивается в том же порядке, то есть от астата к фтору. Поэтому из галогенных элементов сложнее всего получается элементарный фтор, а с наименьшими — йод. Как класс, галогеновые элементы являются неметаллами, но астат проявляет определенные свойства, напоминающие свойства металлов.
Химическое поведение галогенных элементов наиболее удобно обсуждать с точки зрения их положения в периодической таблице элементов.В периодической таблице галогены составляют группу 17 (в соответствии с системой нумерации, принятой Международным союзом теоретической и прикладной химии), группу, непосредственно предшествующую благородным газам. Атомы галогена несут семь валентных электронов в своей внешней электронной оболочке. Эти семь крайних электронов находятся на двух разных типах орбиталей, обозначенных s (с двумя электронами) и p (с пятью). Потенциально атом галогена мог бы удерживать еще один электрон (на орбитали p ), что дало бы полученному галогенидному иону такое же расположение (конфигурацию), что и благородный газ рядом с ним в периодической таблице.Эти электронные конфигурации исключительно стабильны. Эта выраженная тенденция галогенов приобретать дополнительный электрон делает их сильными окислителями.
атом хлорамодель атома хлора Бора.
© Димитар Маринов / Dreamstime.comПри комнатной температуре и атмосферном давлении галогеновые элементы в своем свободном состоянии существуют в виде двухатомных молекул. В молекулярном фторе (F 2 ) атомы удерживаются вместе связью, образованной объединением орбитали p от каждого атома, причем такая связь классифицируется как сигма-связь.Следует отметить, что энергия диссоциации фтора (энергия, необходимая для разрыва связи F ― F) более чем на 30 процентов меньше, чем у хлора, но аналогична энергии йода (I 2 ). Слабость одинарной связи F ― F по сравнению с хлором может быть приписана небольшому размеру фтора, что приводит к уменьшению перекрытия связывающих орбиталей и увеличению отталкивания несвязывающих орбиталей. В йоде, однако, орбитали p более диффузны, что означает, что связь становится слабее, чем в хлоре или броме.
Группа 7 — галогены — Группа 7 — галогены — Редакция GCSE Chemistry (Single Science) — Другое
Элементы группы 7 называются галогенами . Они помещены в вертикальный столбец , второй справа в периодической таблице.
Хлор, бром и йод — три общих элемента группы 7. Элементы 7-й группы образуют соли при взаимодействии с металлами. Термин «галоген» означает «солеобразователь».
Свойства и применение галогенов
В этой таблице обобщены некоторые свойства и применения трех галогенов:
| Элемент | Свойства | Типичное применение |
|---|---|---|
| Хлор | Зеленый газ | Стерилизация вода |
| Бром | Оранжевая жидкость | Изготовление пестицидов и пластмасс |
| Йод | Серое твердое вещество | Стерилизация ран |
Йод образует нагретый пурпурный пар.
Свойства галогенов | Введение в химию
Цель обучения
- Опишите физические и химические свойства галогенов.
Ключевые моменты
- Галогены — неметаллы 17 (или VII) группы периодической таблицы Менделеева. Вниз по группе размер атома увеличивается. Как двухатомная молекула, фтор имеет самую слабую связь из-за отталкивания электронов малых атомов.
- Из-за увеличения силы Ван-дер-Ваальса, понижающей группу, температуры кипения галогенов увеличиваются.Следовательно, физическое состояние элементов в группе изменяется с газообразного фтора на твердый йод.
- Из-за высокого эффективного ядерного заряда галогены обладают высокой электроотрицательностью. Следовательно, они обладают высокой реакционной способностью и могут получить электрон в результате реакции с другими элементами. Галогены в достаточных количествах могут быть вредными или смертельными для биологических организмов.
Условия
- галогены Группа 17 (или VII) в периодической таблице, состоящая из фтора (F), хлора (Cl), брома (Br), йода (I) и астата (At).У них схожие химические свойства.
- электроотрицательность: Склонность атома притягивать к себе электроны.
Галогены представляют собой ряд неметаллических элементов из 17 группы периодической таблицы (ранее VII). Галогены включают фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Искусственно созданный элемент 117 (ununseptium) также может считаться галогеном.
Физические свойства
Атомы увеличиваются в группе по мере заполнения дополнительных электронных оболочек.Когда фтор существует в виде двухатомной молекулы, связь F – F оказывается неожиданно слабой. Это связано с тем, что атомы фтора являются наименьшими из галогенов — атомы тесно связаны друг с другом, что приводит к отталкиванию между свободными электронами в двух атомах фтора.
Точки кипения галогенов увеличиваются по группе из-за увеличения силы Ван-дер-Ваальса по мере увеличения размера и относительной атомной массы атомов. Это изменение проявляется в изменении фазы элементов из газовой (F 2 , Cl 2 ) в жидкую (Br 2 ), в твердую (I 2 ).Галогены — единственная группа периодической таблицы, содержащая элементы во всех трех известных состояниях вещества (твердое, жидкое и газообразное) при стандартной температуре и давлении.
Физические состояния галогенов Галогены представляют собой все три знакомых состояния вещества: (слева направо) хлор — газ, бром — жидкость, а йод — твердое тело. Высокоактивный фтор на рисунке не представлен.Химические свойства
Электроотрицательность — это способность атома притягивать электроны или электронную плотность к себе внутри ковалентной связи.Электроотрицательность зависит от притяжения между ядром и связывающими электронами во внешней оболочке. Это, в свою очередь, зависит от баланса между количеством протонов в ядре, расстоянием между ядром и связывающими электронами и экранирующим эффектом внутренних электронов. В галогенидах водорода (HX, где X — галоген) связь H-X удлиняется по мере увеличения количества атомов галогена. Это означает, что общие электроны находятся дальше от ядра галогена, что увеличивает экранирование внутренних электронов.Это означает, что электроотрицательность уменьшается по группе.
Галогены обладают высокой реакционной способностью и в достаточных количествах могут быть вредными или смертельными для биологических организмов. Эта реактивность обусловлена высокой электроотрицательностью и высоким эффективным зарядом ядра. Галогены могут получить электрон, вступая в реакцию с атомами других элементов.
Фтор — один из самых реактивных элементов. Он реагирует с инертными материалами, такими как стекло, и образует соединения с более тяжелыми инертными газами.Это едкий и очень токсичный газ. Реакционная способность фтора означает, что, как только он вступает в реакцию с чем-либо, он связывается настолько прочно, что образующаяся молекула становится инертной и нереактивной. Фтор может реагировать со стеклом в присутствии небольшого количества воды с образованием тетрафторида кремния (SiF4). Таким образом, с фтором необходимо обращаться с такими веществами, как инертное фторорганическое соединение тефлон.
Фтор активно реагирует с водой с образованием кислорода (O 2 ) и фтороводорода:
[латекс] 2 F_2 (г) + 2 H_2O (l) \ вправо O_2 (г) + 4 HF (водн.) [/ Латекс]
Хлор имеет максимальную растворимость 7.1 г на кг воды при температуре окружающей среды (21 ° C). Растворенный хлор реагирует с образованием соляной кислоты (HCl) и хлорноватистой кислоты (HClO), раствора, который можно использовать в качестве дезинфицирующего средства или отбеливателя:
[латекс] Cl_2 (г) + H_2O (л) \ стрелка вправо HCl (водн.) + HClO (водн.) [/ Латекс]
Бром имеет растворимость 3,41 г на 100 г воды. Медленно реагирует с образованием бромистого водорода (HBr) и бромистоводородной кислоты (HBrO):
[латекс] Br_2 (г) + H_2O (l) \ rightarrow HBr (водн.) + HBrO (водн.) [/ Латекс]
Йод минимально растворим в воде с растворимостью 0.03 г на 100 г воды. Однако йод образует водный раствор в присутствии иодид-иона. Это происходит при добавлении йодида калия (KI) с образованием трииодид-иона.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
галогенов | Безграничная химия
Свойства галогенов
Галогены (фтор, хлор, бром, йод, астат) — это неметаллические элементы, обладающие высокой электроотрицательностью и реакционной способностью.
Цели обучения
Опишите физические и химические свойства галогенов.
Основные выводы
Ключевые моменты
- Галогены — это неметаллы 17 (или VII) группы периодической таблицы Менделеева. Вниз по группе размер атома увеличивается. Как двухатомная молекула, фтор имеет самую слабую связь из-за отталкивания электронов малых атомов.
- Из-за увеличения силы Ван-дер-Ваальса, понижающей группу, температуры кипения галогенов увеличиваются.Следовательно, физическое состояние элементов в группе изменяется с газообразного фтора на твердый йод.
- Из-за высокого эффективного ядерного заряда галогены обладают высокой электроотрицательностью. Следовательно, они обладают высокой реакционной способностью и могут получить электрон в результате реакции с другими элементами. Галогены в достаточных количествах могут быть вредными или смертельными для биологических организмов.
Ключевые термины
- электроотрицательность : тенденция атома притягивать к себе электроны.
- галогены : Группа 17 (или VII) в периодической таблице, состоящая из фтора (F), хлора (Cl), брома (Br), йода (I) и астата (At). У них схожие химические свойства.
Галогены представляют собой ряд неметаллических элементов из 17 группы периодической таблицы (ранее VII). Галогены включают фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Искусственно созданный элемент 117 (ununseptium) также может считаться галогеном.
Физические свойства
Атомы увеличиваются в группе по мере заполнения дополнительных электронных оболочек. Когда фтор существует в виде двухатомной молекулы, связь F – F оказывается неожиданно слабой. Это связано с тем, что атомы фтора являются наименьшими из галогенов — атомы тесно связаны друг с другом, что приводит к отталкиванию между свободными электронами в двух атомах фтора.
Точки кипения галогенов увеличиваются по группе из-за увеличения силы Ван-дер-Ваальса по мере увеличения размера и относительной атомной массы атомов.Это изменение проявляется в изменении фазы элементов из газовой (F 2 , Cl 2 ) в жидкую (Br 2 ), в твердую (I 2 ). Галогены — единственная группа периодической таблицы, содержащая элементы во всех трех известных состояниях вещества (твердое, жидкое и газообразное) при стандартной температуре и давлении.
Физические состояния галогенов : Галогены представляют собой все три знакомых состояния вещества: (слева направо) хлор — это газ, бром — жидкость и йод — твердое тело.Высокоактивный фтор на рисунке не представлен.
Химические свойства
Электроотрицательность — это способность атома притягивать электроны или электронную плотность к себе внутри ковалентной связи. Электроотрицательность зависит от притяжения между ядром и связывающими электронами во внешней оболочке. Это, в свою очередь, зависит от баланса между количеством протонов в ядре, расстоянием между ядром и связывающими электронами и экранирующим эффектом внутренних электронов.В галогенидах водорода (HX, где X — галоген) связь H-X удлиняется по мере увеличения количества атомов галогена. Это означает, что общие электроны находятся дальше от ядра галогена, что увеличивает экранирование внутренних электронов. Это означает, что электроотрицательность уменьшается по группе.
Галогены обладают высокой реакционной способностью и в достаточных количествах могут быть вредными или смертельными для биологических организмов. Эта реактивность обусловлена высокой электроотрицательностью и высоким эффективным зарядом ядра. Галогены могут получить электрон, вступая в реакцию с атомами других элементов.
Фтор — один из самых реактивных элементов. Он реагирует с инертными материалами, такими как стекло, и образует соединения с более тяжелыми инертными газами. Это едкий и очень токсичный газ. Реакционная способность фтора означает, что, как только он вступает в реакцию с чем-либо, он связывается настолько прочно, что образующаяся молекула становится инертной и нереактивной. Фтор может реагировать со стеклом в присутствии небольшого количества воды с образованием тетрафторида кремния (SiF4). Таким образом, с фтором необходимо обращаться с такими веществами, как инертное фторорганическое соединение тефлон.
Фтор активно реагирует с водой с образованием кислорода (O 2 ) и фтороводорода:
[латекс] 2 \ text {F} _2 (\ text {g}) + 2 \ text {H} _2 \ text {O} (\ text {l}) \ rightarrow \ text {O} _2 (\ text { g}) + 4 \ text {HF} (\ text {aq}) [/ latex]
Хлор имеет максимальную растворимость 7,1 г на кг воды при температуре окружающей среды (21 ° C). Растворенный хлор реагирует с образованием соляной кислоты (HCl) и хлорноватистой кислоты (HClO), раствора, который можно использовать в качестве дезинфицирующего средства или отбеливателя:
[латекс] \ text {Cl} _2 (\ text {g}) + \ text {H} _2 \ text {O} (\ text {l}) \ rightarrow \ text {HCl} (\ text {aq}) + \ text {HClO} (\ text {aq}) [/ latex]
Бром имеет растворимость 3.41 г на 100 г воды. Медленно реагирует с образованием бромистого водорода (HBr) и бромистоводородной кислоты (HBrO):
[латекс] \ text {Br} _2 (\ text {g}) + \ text {H} _2 \ text {O} (\ text {l}) \ rightarrow \ text {HBr} (\ text {aq}) + \ text {HBrO} (\ text {aq}) [/ latex]
Йод минимально растворим в воде, его растворимость составляет 0,03 г на 100 г воды. Однако йод образует водный раствор в присутствии иодид-иона. Это происходит при добавлении йодида калия (KI) с образованием трииодид-иона.
Галогенные соединения
Галогены обладают высокой реакционной способностью и могут образовывать галогениды водорода, галогениды металлов, органические галогениды, интергалогены и полигалогенированные соединения.
Цели обучения
Обсудите галогенные соединения и их свойства.
Основные выводы
Ключевые моменты
- Галогениды водорода представляют собой бинарные соединения галогенов с водородом. При растворении в воде они являются сильными галогеноводородными кислотами, за исключением HF.Все эти кислоты опасны; некоторые из них широко используются на химических заводах.
- Галогениды металлов представляют собой соединения галогенов и металлов. Они включают высокоионные соединения, мономерные ковалентные соединения и полимерные ковалентные соединения. Галогениды металлов могут быть получены прямым соединением или нейтрализацией основной соли металла галогеноводородной кислотой.
- Межгалогенные соединения образуются при взаимодействии галогенов друг с другом. Некоторые из них напоминают чистые галогены в некоторых отношениях, но в основном их свойства и поведение являются промежуточными по сравнению с двумя родительскими галогенами.Однако некоторые свойства не обнаруживаются ни у одного из исходных галогенов.
- Галогенированные соединения или органические галогениды — это органические соединения, содержащие атомы галогена. В организме человека некоторые галогены выполняют несколько регулирующих функций, а другие не являются необходимыми. Органогалогены синтезируются посредством реакции нуклеофильного отрыва.
- Соединения, замещенные несколькими галогенами, известны как полигалогенированные соединения. Многие из них очень токсичны и биоаккумулируются в организме человека, но у них есть много потенциальных применений.
Ключевые термины
- межгалоген : бинарное соединение двух разных галогенов.
- полигалогенированное соединение : соединение с несколькими атомами галогенов.
- галогенид : соединение галогена и одного или нескольких элементов.
Галогениды водорода
Все галогены образуют бинарные соединения с водородом, и эти соединения известны как галогениды водорода: фтористый водород (HF), хлористый водород (HCl), бромистый водород (HBr), йодоводород (HI) и водородный астатид (HAt). .Все они, кроме HF, при растворении в воде являются сильными химическими кислотами. Однако плавиковая кислота действительно обладает довольно разрушительными свойствами по отношению к животным тканям, в том числе к тканям человека.
В водном растворе галогениды водорода известны как галогенводородные кислоты. Названия этих кислот следующие:
- плавиковая кислота
- соляная кислота
- кислота бромистоводородная
- иодистоводородная кислота
Все эти кислоты опасны, и с ними необходимо обращаться с большой осторожностью.Некоторые из этих кислот также широко используются на химических заводах. Водородный астатид также должен быть сильной кислотой (гидростатическая кислота), но он редко включается в презентации о галогеноводородных кислотах из-за крайней радиоактивности астатина (через альфа-распад) и того факта, что он легко разлагается на составляющие его элементы (водород и астатин). ).
Галогениды металлов
Галогены образуют много соединений с металлами. К ним относятся высокоионные соединения, такие как хлорид натрия, мономерные ковалентные соединения, такие как гексафторид урана, и полимерные ковалентные соединения, такие как хлорид палладия.Галогениды металлов обычно получают путем прямого комбинирования или, чаще, путем нейтрализации соли основного металла галогенводородной кислотой.
Хлорид серебра : Хлорид серебра — это осадок, образующийся при добавлении раствора нитрата серебра к раствору хлорида.
Межгалогенные соединения
Галогены реагируют друг с другом с образованием межгалогенных соединений. Двухатомные межгалогенные соединения, такие как BrF, ICl и ClF, в некоторых отношениях напоминают чистые галогены.Свойства и поведение двухатомного межгалогенного соединения имеют тенденцию быть промежуточными по отношению к свойствам и поведению его родительских галогенов. Однако некоторые свойства не обнаруживаются ни у одного из исходных галогенов. Например, Cl 2 и I 2 растворимы в CCl 4 , а ICl — нет, поскольку это полярная молекула (из-за разницы в электроотрицательности между I и Cl).
Органические галогениды
Многие синтетические органические соединения, такие как пластмассовые полимеры, а также некоторые природные органические соединения содержат атомы галогена; они известны как галогенированные соединения или органические галогениды.Хлор является наиболее распространенным из галогенов и единственным, необходимым (в виде ионов хлора) в относительно больших количествах для человека. Например, ионы хлора играют ключевую роль в работе мозга, опосредуя действие тормозящего передатчика ГАМК. Они также используются организмом для выработки желудочного сока. Йод необходим в незначительных количествах для выработки гормонов щитовидной железы, таких как тироксин. С другой стороны, ни фтор, ни бром не считаются необходимыми для человека. Органогалогены также синтезируются посредством реакции нуклеофильного отрыва.
Полигалогенированные соединения
Полигалогенированные соединения — это промышленно созданные соединения, замещенные множеством галогенов. Многие из них очень токсичны и биоаккумулируются в организме человека, но у них есть много возможных применений. Полигалогенированные соединения включают широко разрекламированные ПХД, ПБДЭ и ПФУ, а также множество других соединений.
Использует галоген
Хотя галогены и их соединения могут быть токсичными, некоторые из них необходимы для функционирования человеческого организма и используются в повседневных продуктах.
Цели обучения
Обсудите использование различных галогенов.
Основные выводы
Ключевые моменты
- Фторид можно найти во многих повседневных продуктах, включая зубную пасту, витаминные добавки, детские смеси и даже воду из общего пользования. Однако чрезмерное потребление фтора может быть фатальным.
- Хлор составляет около 0,15 процента массы тела человека и играет несколько важных ролей в функционировании организма. Соединения хлора и брома используются в качестве дезинфицирующих средств при стерилизации.
- Йод необходим для работы щитовидной железы. Без йода не могут вырабатываться гормоны щитовидной железы, что приводит к гипотиреозу.
- Лекарства-кандидаты, в которые включены атомы галогена, обычно более липофильны и менее водорастворимы, чем их аналоги, и поэтому имеют улучшенное проникновение через липидные мембраны и ткани. Из-за этого некоторые галогенированные препараты могут накапливаться в жировой ткани.
- Полигалогенированные соединения (PHC) обладают высокой реакционной способностью и также накапливаются в организме человека; некоторые из них обладают токсичными и канцерогенными свойствами.ПМСП используются в большом количестве промышленных товаров и в борьбе с вредителями.
Ключевые термины
- гипотиреоз : болезненное состояние, вызванное недостаточной выработкой тироидных гормонов щитовидной железой.
- полигалогенированные соединения : Соединения с несколькими атомами галогена.
- дезинфицирующее средство : Вещество, убивающее микробы и / или вирусы.
Фторид
Несмотря на свою токсичность, фтор можно найти во многих повседневных продуктах, включая зубную пасту, витаминные добавки, детские смеси и даже воду из общего пользования.Многие стоматологические продукты содержат фтор для предотвращения кариеса, но чрезмерное потребление фтора может быть фатальным.
Хлор
Хлор составляет около 0,15 процента массы тела человека. Хлор в основном используется для производства соляной кислоты, которая секретируется париетальными клетками желудка и используется для поддержания кислой среды для пепсина. Он играет жизненно важную роль в поддержании правильного кислотно-щелочного баланса жидкостей организма. В кишечнике он нейтрализуется бикарбонатом натрия.
Хлор также реагирует с натрием с образованием хлорида натрия, более известного как поваренная соль.
И хлор, и бром используются в качестве дезинфицирующих средств для питьевой воды, плавательных бассейнов, свежих ран, спа, посуды и поверхностей. Они убивают бактерии и другие потенциально опасные микроорганизмы с помощью процесса, известного как стерилизация. Хлор и бром также используются при отбеливании. Гипохлорит натрия, производимый из хлора, является активным ингредиентом большинства отбеливателей для тканей.Отбеливатели на основе хлора также используются при производстве некоторых бумажных изделий.
Йод
Йод — незаменимый минерал для организма. Он используется в щитовидной железе, но также может быть обнаружен в тканях груди, слюнных железах и надпочечниках. Без йода не могут вырабатываться гормоны щитовидной железы, что приводит к состоянию, называемому гипотиреозом. Без лечения щитовидная железа раздувается и образует видимый зоб. У детей с гипотиреозом может развиться умственная отсталость.У женщин гипотиреоз может привести к бесплодию, выкидышам, раку груди и яичников. Проблемы с щитовидной железой были обычной проблемой на протяжении многих лет, особенно у женщин среднего возраста; исследования коррелируют это с тем фактом, что уровень йода в общей популяции за последние годы значительно снизился. Из-за определенных проблем со здоровьем многие люди потребляли меньше соли, которая обычно содержит йод.
При открытии лекарств включение атомов галогена в ведущее лекарство-кандидат приводит к появлению аналогов, которые обычно являются более липофильными и менее растворимыми в воде.Следовательно, атомы галогена используются для улучшения проникновения через липидные мембраны и ткани. Отсюда следует, что некоторые галогенированные препараты имеют тенденцию накапливаться в жировой ткани.
Полигалогенированные соединения
Полигалогенированные соединения (ПГС) представляют особый интерес и важность, поскольку галогены, как правило, обладают высокой реакционной способностью и биоаккумулируются в организме человека. Галогены также являются частью расширенного набора, который включает многие токсичные и канцерогенные промышленные химические вещества: ПБДЭ, ПХД, диоксины (ПХДД) и ПФУ являются полигалогенированными соединениями.
ДДТ
ДДТ (дихлордифенилтрихлорэтан) — полигалогенированный пестицид, который был запрещен в США в 1972 году из-за потенциально вредного воздействия на здоровье человека. Во второй половине Второй мировой войны он использовался для борьбы с малярией и тифом среди гражданского населения и войск. Швейцарский химик Пауль Герман Мюллер был удостоен Нобелевской премии по физиологии и медицине в 1948 г. «за открытие высокой эффективности ДДТ в качестве контактного яда против нескольких членистоногих.«После того, как было признано вредное воздействие ДДТ на окружающую среду, он был запрещен в сельском хозяйстве во всем мире в соответствии со Стокгольмской конвенцией, но его ограниченное использование для борьбы с переносчиками болезней продолжается и по сей день, хотя остается спорным. Ученые называют запрет США на ДДТ одним из основных факторов возвращения белоголового орлана, национальной птицы Соединенных Штатов, из состояния близкого к исчезновению.
Химическая структура ДДТ : ДДТ (дихлордифенилтрихлорэтан) представляет собой хлорорганическое соединение, используемое в качестве инсектицида.В настоящее время он запрещен в США из-за его потенциально вредного воздействия на здоровье человека. Обозначения: атомы хлора: зеленый, атомы углерода: черный, атомы водорода: белый.
PHC обычно не смешиваются с органическими растворителями или водой, но смешиваются с некоторыми углеводородами, из которых их часто получают. ПМСП используются в широком спектре продуктов и отраслей, таких как:
- Обработка дерева
- Антипригарные, водостойкие и огнестойкие покрытия
- Косметика
- Медицина (e.г., лечение рака, хирургия и медицинская визуализация)
- Электронные жидкости
- Пластмассы (например, пищевые контейнеры и упаковка)
- Автомобили
- Самолеты
- Одежда и ткани
- Изоляция
- Клеи
- Краски
- Пенополиуретан
- Борьба с вредителями (ДДТ)
Химия галогенов
Химия Галогены
В Галогены
В группе VIIA, предпоследний столбец, шесть элементов. периодической таблицы.Как и ожидалось, у этих элементов есть определенные общие свойства. Все они образуют двухатомные молекулы (H 2 , F 2 , Cl 2 , Br 2 , I 2 и На 2 ), например, и все они образуют отрицательно заряженные ионы (H — , F — , Cl — , Br — , I — и At — ).
Когда обсуждается химия этих элементов, водород отделены от других, а астатин игнорируется, потому что он радиоактивный.(Наиболее стабильные изотопы астата имеют период полураспада менее минуты. В результате наибольший образцов соединений астата, изученных на сегодняшний день, было меньше, чем 50 нг.) Обсуждения химии элементов в Группе Поэтому VIIA сосредотачивается на четырех элементах: фтор, хлор, бром и йод. Эти элементы называются галогенами . (от греческого hals «соль» и gennan , «формировать или генерировать»), потому что они буквально солеобразователи.
Ни один из галогенов не встречается в природе в их элементарной форме. форма. Они неизменно встречаются в виде солей галогенида . ионы (F — , Cl — , Br — и I — ). Ионы фтора содержатся в минералах, таких как флюорит (CaF 2 ). и криолит (Na 3 AlF 6 ). Ионы хлорида содержится в каменной соли (NaCl) океанов, которая составляет примерно 2% Cl — иона по весу, а в озерах с высоким содержанием соли, например как Большое Соленое озеро в штате Юта, которое составляет 9% ионов Cl — на масса.Ионы бромида и йодида обнаруживаются при низких концентрации в океанах, а также в скважинах с рассолом в Луизиана, Калифорния и Мичиган.
Галогены в их элементальная форма
Фтор (F 2 ), высокотоксичный бесцветный газ, является самый реактивный элемент, известный настолько реактивный, что асбест, вода, и кремний загорелся в его присутствии. Это так реактивно он даже образует соединения с Kr, Xe и Rn, элементами, которые были когда-то считалось инертным.Фтор — такой мощный окислитель. агент, что он может уговорить другие элементы на необычно высокий степени окисления, как в AgF 2 , PtF 6 и IF 7 .
Фтор настолько реактивен, что трудно найти тара, в которой его можно хранить. F 2 атакует оба стекло и кварц, например, и вызывает взрыв большинства металлов в пламя. Фтор обрабатывается в оборудовании, изготовленном из определенных материалов. сплавы меди и никеля.Он все еще вступает в реакцию с этими сплавами, но он образует на поверхности слой фторида, который защищает металл от дальнейшей реакции.
Фтор используется в производстве тефлона или поли (тетрафторэтилен), (C 2 F 4 ) n , который используется для всего: от подкладок для кастрюль и сковородок до прокладок инертные к химическим реакциям. Большое количество фтора также потребляются каждый год для производства фреонов (например, CCl 2 F 2 ) используется в холодильниках.
Хлор (Cl 2 ) — высокотоксичный газ с бледным желто-зеленый цвет. Хлор — очень сильный окислитель, который используется в коммерческих целях как отбеливающий агент и как дезинфицирующее средство. Он достаточно силен, чтобы окислять красители, дающие древесная масса, например, желтого или коричневого цвета, тем самым отбеливающий этот цвет и достаточно сильный, чтобы уничтожить бактерии и тем самым действовать как бактерицид. Большое количество хлора используется каждый год для производства растворителей, таких как четыреххлористый углерод (CCl 4 ), хлороформ (CHCl 3 ), дихлорэтилен (C 2 H 2 Cl 2 ), и трихлорэтилен (C 2 HCl 3 ).
Бром (Br 2 ) — жидкость красновато-оранжевого цвета с неприятный запах удушья. Название элемента, по сути, идет от греческого слова bromos , «зловоние». Бром используется для приготовления антипиренов, средств пожаротушения, седативные средства, антидетонационные средства для бензина и инсектициды.
Йод — твердое вещество интенсивного цвета с почти металлическим блеск. Это твердое вещество относительно летучее и возгоняется, когда нагревается до образования фиолетового газа.Йод использовался для много лет как дезинфицирующее средство в «настойке йода». Соединения йода используются в качестве катализаторов, лекарств и красителей. Серебро йодид (AgI) играет важную роль в фотографическом процессе и в попытках вызвать дождь, засевая облака. Йодид также добавлен в соль для защиты от зоба, дефицита йода заболевание, характеризующееся отеком щитовидной железы.
Некоторые химические и физические свойства галогенов приведены в таблице ниже.Наблюдается регулярное увеличение многие свойства галогенов, когда мы спускаемся вниз по столбец от фтора до йода, включая температуру плавления, температура кипения, интенсивность цвета галогена, радиус соответствующего галогенид-иона и плотности элемента. С другой стороны, наблюдается закономерное снижение первых энергия ионизации при спуске по столбцу. В результате там регулярное снижение окислительной способности галогенов от фтора до йода.
| F 2 > Cl 2 > Br 2 > Я 2 |
| окислительная способность |
Эта тенденция отражается увеличением восстановительной силы соответствующих галогенидов.
| I — > Br — > Класс — > F — |
| снижение прочности |
Некоторые свойства F 2 , Класс 2 , Br 2 , и я 2
| Плавка Путевая точка (С) | Кипячение Путевая точка (С) | Цвет | Натуральный Изобилие (частей на миллион) | 1-й Ионизация Энергия (кДж / моль) | Электрон Родство (кДж / моль) | Ионный Радиус (нм) | Плотность (г / см 3 ) | |||||||||
| Ф. 2 | -218.6 | -188,1 | бесцветный | 544 | 1680,6 | 322,6 | 0,133 | 1,513 | ||||||||
| Класс 2 | -101.0 | -34,0 | бледно-зеленый | 126 | 1255,7 | 348,5 | 0,184 | 1,655 | ||||||||
| Br 2 | -7.3 | 59,5 | темно-красно-коричневый | 2,5 | 1142,7 | 324,7 | 0,196 | 3,187 | ||||||||
| I 2 | 113.6 | 185,2 | очень темно-фиолетовый почти черный | 0,46 | 1008,7 | 295,5 | 0,220 | 3,960 |
Методы Получение галогенов из их галогенидов
Галогены могут быть получены реакцией раствора галогенида ион с любым веществом, которое является более сильным окислителем.Йод, например, можно получить путем реакции иодид-иона с либо бром, либо хлор.
| 2 I — ( водн. ) | + | Br 2 ( водн. ) | I 2 ( водн. ) | + | 2 Br — ( водн. ) |
Бром впервые был получен А.Ж. Балард в 1826 г. бромид-ионы с раствором Cl 2 , растворенного в вода.
| 2 Br — ( водн. ) | + | Класс 2 ( водн. ) | Br 2 ( водн. ) | + | 2 класса — ( водн. ) |
Для получения Cl 2 нам понадобится особо прочный окислитель, такой как диоксид марганца (MnO 2 ).
| 2 класса — ( водн. ) | + | MnO 2 ( водн. ) | + | 4 часа + ( водн. ) | Класс 2 ( водн. ) | + | Mn 2+ ( водн. ) | + | 2 H 2 O ( л ) |
Синтез фтора ускользнул от усилий химиков для почти 100 лет.Частично проблема заключалась в том, чтобы найти окислитель. агент, достаточно сильный, чтобы окислить ион F — до F 2 . Задача получения фтора осложнялась еще и тем, что необычайная токсичность как F 2 , так и водорода фторид (HF) использовался для его изготовления.
Лучший способ получения сильного восстановителя — это пропустить электрический ток через соль металла. Натрий, для Например, может быть получен электролиз расплавленного натрия хлористый.
| электролизный | ||||
| 2 NaCl ( л ) | 2 Na ( с ) | + | Класс 2 ( г ) |
Теоретически тот же процесс можно использовать для создания сильных окислители, такие как F 2 .
Попытки получить фтор электролизом, однако, были изначально неудачный. Хэмфри Дэви, приготовивший калий, натрий, барий, стронций, кальций и магний путем электролиза неоднократно пытались получить F 2 электролизом флюорита (CaF 2 ), и ему удалось только погубить его здоровье. Жозеф Луи Гей-Люссак и Луи Жак Тенар, которые впервые приготовили элементарный бор, также пробовали приготовили фтор и пострадали от очень болезненного воздействия фтороводород.Джордж и Томас Нокс были сильно отравлены во время их попыток получить фтор, и Полин Луйе и Джером Никлз умер от отравления фтором.
Наконец, в 1886 году Анри Муассан успешно изолировал F 2 газ от электролиза смешанной соли KF и HF и отметил что кристаллы кремния вспыхивают при смешивании с этим газ. Электролиз KHF 2 все еще используется для приготовления фтор сегодня, как показано на рисунке ниже.
| электролизный | ||||||
| 2 KHF 2 ( с ) | H 2 ( г ) | + | F 2 ( г ) | + | 2 KF ( с ) |
Обычное окисление Номера галогенов
Фтор — самый электроотрицательный элемент в периодической Таблица.В результате он имеет степень окисления -1 во всех его соединения. Поскольку хлор, бром и йод меньше электроотрицательный, можно приготовить соединения, в которых эти элементы имеют степени окисления +1, +3, +5 и +7, так как показано в таблице ниже.
Общее число окисления галогенов
| Окисление Число | Примеры | |
| -1 | CaF 2 , HCl, NaBr, AgI | |
| 0 | F 2 , Cl 2 , Br 2 , I 2 | |
| +1 | HClO, ClF | |
| +3 | HClO 2 , ClF 3 | |
| +5 | HClO 3 , BrF 5 , BrF 6 — , IF 5 | |
| +7 | HClO 4 , BrF 6 + , IF 7 |
Общие тенденции в Галогенная химия
В химии галогенов существует несколько закономерностей.
1. Ни двойные, ни тройные связи не нужны для объяснения химия галогенов.
2. Химия фтора упрощена тем, что он самый электроотрицательный элемент в периодической таблице и тот факт, что в его валентной оболочке нет d орбиталей, поэтому он не может расширить свою валентную оболочку.
3. Хлор, бром и йод имеют валентную оболочку d орбитали и могут расширять свои валентные оболочки, чтобы удерживать до 14 валентных электронов.
4. В химии галогенов преобладают окислительно-восстановительные реакции.
Галогениды водорода (HX)
Галогениды водорода представляют собой соединения, содержащие водород присоединен к одному из галогенов (HF, HCl, HBr и HI). Все эти соединения представляют собой бесцветные газы, растворимые в вода. До 512 мл газообразного HCl может раствориться в одном мл вода при температуре 0 o C и давлении 1 атм, например.Каждый из галогениды водорода ионизируются, по крайней мере, в некоторой степени, когда он растворяется в воде.
| H 2 O | ||||
| HCl ( г ) | H + ( водн. ) | + | Класс — ( водн. ) |
Некоторые галогениды водорода могут быть получены непосредственно из элементы.Смеси H 2 и Cl 2 , для например, реагируйте взрывным насилием при наличии света с образованием HCl.
| H 2 ( г ) | + | Класс 2 ( г ) | 2 HCl ( г ) |
Поскольку химики обычно больше интересуются водными растворов этих соединений, чем чистые газы, эти соединения обычно синтезируются в воде.Водные растворы галогениды водорода часто называют минеральными кислотами , потому что это буквально кислоты, приготовленные из минералов. Соляной кислоту получают реакцией поваренной соли с серной кислотой, для Например, плавиковую кислоту получают из флюорита и серная кислота.
| 2 NaCl ( с ) | + | H 2 SO 4 ( водн. ) | 2 HCl ( водн. ) | + | Na 2 SO 4 ( водн. ) | |
| CaF 2 ( с ) | + | H 2 SO 4 ( водн. ) | 2 HF ( водн. ) | + | CaSO 4 ( водн. ) |
Эти кислоты очищают с использованием легкость, с которой газ HF и HCl выкипает из этих растворов.При нагревании одного из этих растворов выделяется газ. собираются, а затем повторно растворяются в воде, чтобы получить относительно чистый образцы минеральной кислоты.
Интергалоген Соединения
Межгалогенные соединения образуются в результате реакций между разные галогены. Все возможные межгалогенные соединения Тип XY известны. Бром реагирует с хлором, так как Например, чтобы получить BrCl, который является газом при комнатной температуре.
| Br 2 ( л ) | + | Класс 2 ( г ) | 2 BrCl ( г ) |
Межгалогенные соединения общей формулы XY 3 , XY 5 , и даже XY 7 являются образуется при реакции пар галогенов. Хлор реагирует с фтор, например, с образованием трифторида хлора.
| Класс 2 ( г ) | + | 3 ф. 2 ( г ) | 2 ClF 3 ( г ) |
Эти соединения легче всего образовать, когда Y фтор. Йод — единственный галоген, который образует XY 7 межгалогенное соединение, причем только с фтором.
ClF 3 и BrF 5 чрезвычайно реактивны соединения. ClF 3 настолько реактивен, что древесина, асбест, и даже вода самопроизвольно загорается в его присутствии. Эти соединения являются отличными фторирующими агентами, которые склонны вступать в реакцию друг с другом с образованием положительных ионов, таких как ClF 2 + и BrF 4 + и отрицательные ионы, такие как IF 2 — и BrF 6 — .
| 2 BrF 5 ( л ) | [BrF 4 + ] [BrF 6 –] ( с ) |
Нейтральные оксиды Галогены
При определенных условиях можно изолировать нейтраль оксиды галогенов, такие как Cl 2 O, Cl 2 O 3 , ClO 2 , Cl 2 O 4 , Cl 2 O 6 , и Cl 2 O 7 .Cl 2 O 7 , для Например, может быть получена дегидратация хлорной кислоты, HClO 4 . Эти оксиды являются заведомо нестабильными соединениями, которые взрываются при подвергается тепловому или физическому удару. Некоторые так нестабильные, они детонируют при нагревании до температуры выше -40 o С.
Оксикислоты Галогены и их соли
Хлор реагирует с ионом OH — с образованием хлорида. ионы и ионы гипохлорита (OCl — ).
| Класс 2 ( водн. ) | + | 2 OH — ( водн. ) | Класс — ( водн. ) | + | OCl — ( водн. ) | + | H 2 O ( л ) |
Это реакция диспропорционирования, в которой половина атомы хлора окисляются до ионов гипохлорита, а другие половина восстанавливается до ионов хлора.
Когда раствор горячий, эта реакция дает смесь хлорид и хлорат (ClO 3 — ) ионы.
| 3 Класс 2 ( водн. ) | + | 6 OH — ( водн. ) | 5-й класс — ( водн. ) | + | ClO 3 — ( водн. ) | + | 3 H 2 O ( л ) |
В тщательно контролируемых условиях возможно преобразовать смесь ионов хлората и гипохлорита в раствор, содержащий хлорит (ClO 2 — ) ион.
| ClO 3 — ( водн. ) | + | ClO — ( водн. ) | 2 ClO 2 — ( водн. ) |
Последний представитель этого класса соединений, перхлорат. ион (ClO 4 — ), производится электролизом растворы хлорат-иона.
В названиях оксианионов галогенов используются окончания — ite и — ели для обозначения низкой и высокой степени окисления и префиксы hypo — и на — для обозначения очень низкие и очень высокие степени окисления, как показано на Таблица ниже. Каждый из этих ионов может быть преобразован в оксикислоту, который назван заменой — ite , заканчивающейся на — ous и — съел , заканчивая — ic .
Оксианионы и оксикислоты хлора
| Оксианионы | Оксикислоты | ||||||||
| Состояние окисления хлора | Соединение | Имя | Соединение | Имя | |||||
| +1 | ClO — | гипохлорит | HClO | хлорноватистая кислота | |||||
| +3 | ClO 2 — | хлорит | HOClO | хлорноватистая кислота | |||||
| +5 | ClO 3 — | хлорат | HOClO 2 | хлорная кислота | |||||
| +7 | ClO 4 — | перхлорат | HOClO 3 | хлорная кислота | |||||
Галогены — Таблица Менделеева — Руководства для экспертов — Отдел новостей
Келлинг Дональд, доцент химии, работает с элементами Периодической таблицы.В частности, он может говорить с группой элементов, известной как галогены, которую он использует в своих исследованиях как теоретик и химик-компьютерщик.
«Все, что мы действительно можем увидеть и потрогать, все, что можно выразить словом« материя », на Земле представляет собой некую комбинацию атомов природных элементов, — сказал Дональд.
Исследовательская группа Дональда исследует молекулы с участием элементов из Периодической таблицы. В одной из написанных им статей обсуждается, как элементы бериллий, магний, кальций, стронций, барий, цинк, кадмий, ртуть и другие элементы образуют связи с кольцевой структурой, полностью состоящей из углерода и водорода.
«Результатом этого соединения является то, что мы в химии называем сэндвич-компаундом», — сказал Дональд.
Одна из любимых групп Дональда элементов — это галогены, в которые входят фтор, хлор, бром и йод.
«Они химически интересны и универсальны: фтор, например, имеет тенденцию быть очень реактивным; однако специальное соединение фтора с углеродом позволяет тефлоновым горшкам быть« антипригарными ». поведение содержащих их молекул, особенно явление, называемое галогеновыми связями », — пояснил Дональд.
Периодическая таблица — Галогены
Галогены
Да здравствуют галогены
Пять элементов расположены в пятом ряду p-блока: фтор (F), хлор (Cl), бром (Br), йод (I) , и астатин (At).Когда их силы объединяются, они вызывают величайшего чемпиона Земли… капитана Галогена! К сожалению, это не так, но элементы окрестили галогенной группой.
Галогены находятся в группе 7 (или 17).
Как вы могли заметить, галогены расположены в предпоследнем столбце периодической таблицы, в 17 строках слева. Согласно международному постановлению, это означает, что галогены находятся в группе 17. Некоторые учебники и учителя могут также относить этот столбец к группе 7.Так что же дает? Какое числовое обозначение правильное? Мы знаем, что вы очень хотите знать.
Знайте (и поймите) ярлыки своей группы.
На самом деле галогены находятся в группе 17 и группе 7 . Это просто зависит от того, с кем вы разговариваете или что читаете. В большинстве современных периодических таблиц оба числа указаны вверху каждого столбца, чтобы избежать путаницы. Мы не можем забыть упомянуть метки A и B, следующие за числами. (Они важнее, чем кажется.) Метка «A» означает, что элемент находится в s- или p-блоке, а метка «B» означает, что элемент находится в d-блоке.Так же случилось и три 8B. Не переживайте. Это просто то, что было решено. Смирись с этим.
Группа 17 элементов — неметаллы, а — двухатомные . Это означает, что когда они находятся в своей чистой элементальной форме, они все напарники и имеют формулу X 2 , где X — элемент. Однако эти элементы очень реактивны, поэтому галогены никогда не встречаются в природе в чистом виде. Вместо этого они почти всегда находятся в комплексах с формальным зарядом -1.
Минус один… минус один… Можем ли мы придумать вескую причину, по которой галогены любят , находящиеся в состоянии -1? Галогены имеют конфигурацию валентных электронов n s 2 n p 5 , где n — период, который они называют своим домом.Это означает, что им нужно получить только один электрон (с зарядом минус один), чтобы получить сверхстабильную конфигурацию благородного газа. В этом смысле галогены похожи на любой другой элемент периодической таблицы. Им нужна стабильность.
Какие элементы любят , чтобы потерять один электрон? Он начинается щелочью и заканчивается металлом. Щелочные металлы и галогены — это сочетание реакционной способности, заключенное на небесах. То, что является мусором одного элемента, является сокровищем другого элемента. Как следствие, щелочноземельные металлы и галогены легко реагируют с образованием солевых комплексов MX.(Для справки: термин галоген означает «солеобразователь».)
2M + X 2 → 2MX
(где M = щелочной металл, а X = галоген)
Теперь мы знаем, что галогены реакционноспособны, но это самый реактивный? Вы можете удивиться, а можете и не быть удивлены, узнав, что не все галогены так взволнованы или с энтузиазмом реагируют на них, как другие. Фтор, безусловно, является наиболее реактивным и соединяется почти со всеми другими элементами периодической таблицы. По мере продвижения вниз по столбцу группы 7 реакционная способность галогенов снижается.
Фтор (F) — самый реактивный галогенный элемент.
При комнатной температуре группа галогенов отображает все три фазы (твердую, жидкую и газовую). Йод и астатин твердые вещества. Фтор и хлор — газы. Бром — жидкость. Фактически, бром — один из двух элементов, находящихся в жидком состоянии при комнатной температуре. (Ртуть также является жидкостью при комнатной температуре.)
Все галогенные элементы чрезвычайно электроотрицательны из-за их сильного желания получить дополнительный электрон.Фактически, фтор — самый электроотрицательный элемент в таблице Менделеева. Угадайте, что общего между галогенами и песней Бритни Спирс? Они токсичны.
Фтор (F, Z = 9) был впервые выделен в 1886 году французским химиком Анри Муассаном. 15 Это самый распространенный галоген, обнаруженный в земной коре. 11 При комнатной температуре это бледно-желтый газ, который, как мы уже упоминали, чрезвычайно токсичен. Это также один из наиболее широко используемых галогенов. Например, комплексы фтора используются при производстве тефлона (который используется для всего, от облицовки кастрюль и сковородок до автомобильных деталей) и фреонов (которые используются в качестве охлаждающих жидкостей в холодильниках).