Галогены
Галогены
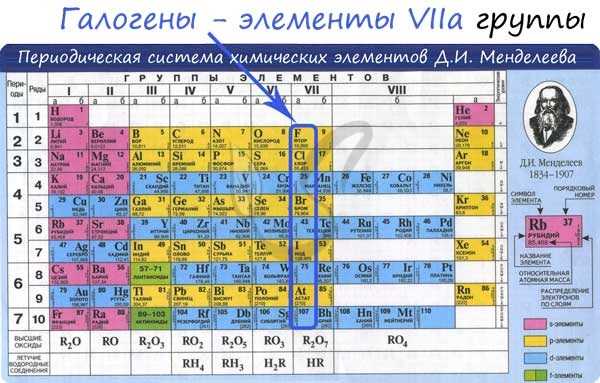
Галогены – это элементы VII A группы главной подгруппы. К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.
Все эти элементы являются типичными неметаллами. Галогены, означает «рождающие соли».
Так как это элементы VII A группы, значит на внешнем энэргетическом уровне у них семь электронов. До завершения уровня им не хватает одного электрона, поэтому они берут этот недостающий электрон у атомов металлов, при этом образуется ионное соединение – соль, где степень окисления галогена -1.
Галогены – сильные окислители, самый сильный из них фтор, который может быть только окислителем и проявлять степень окисления -1.
Остальные галогены могут проявлять и восстановительные свойства
В группе сверху вниз – от фтора к йоду – радиус атома увеличивается, поэтому усиливаются восстановительные и металлические свойства.
Все галогены представляют собой двухатомные молекулы, связь между атомами –
Галогены в природе существуют только в виде соединений с другими элементами. Наиболее распространены хлор и фтор, их содержание составляет 0,19% и 0,03% от массы земной коры.
Например, фтор входит в соcтав плавикового шпата, хлор входит в состав каменной соли, бром содержится в морской воде, а йод в подземных буровых водах.
Рассмотрим таблицу, в которой отражены физические свойства галогенов. Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.
|
Вещество |
Агрегатное состояние при н.у. |
Цвет |
Плотность, г/см3 |
Температура плавления, 0С |
Температура кипения, 0С |
|
Фтор F2 |
Газ |
Светло-жёлтый |
0,0017 |
-220 |
-188 |
|
Хлор Cl2 |
Газ |
Жёлто-зелёный |
0,0032 |
-101 |
-34 |
|
Бром Br2 |
Жидкость |
Буровато-коричневый |
3,1 |
-7 |
+58 |
|
Йод I2 |
Твёрдое вещество |
Чёрно-серый (пары фиолетовые) |
4,9 |
+114 |
+186 |
Из таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность. Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия. От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.
Фтор самый активный галоген, который при нагревании реагирует даже с золотом, серебром и платиной. Алюминий и цинк в атмосфере фтора воспламеняются. Так, в реакции цинка с фтором образуется фторид цинка. Цинк повышает свою степень окисления с 0 до +2, а фтор, наоборот, понижает степень окисления с 0 до -1. Атом цинка отдаёт по два электрона молекуле фтора. Цинк является восстановителем, а фтор – окислителем.
Остальные галогены реагируют с металлами в основном только при нагревании.
Медная проволока также сгорает в парах брома. При этом образуется бромид меди два. Медь повышает свою степень окисления с 0 до +2, а бром понижает свою степень окисления с 0 до -1. Каждый атом меди отдаёт по 2 электрона молекуле брома. Медь – восстановитель, а бром – окислитель.
Йод реагирует с алюминием, катализатором в этой реакции является вода. Алюминий повышает свою степень окисления с 0 до +3, а йод понижает свою степень окисления с 0 до -1. Каждый атом алюминия отдаёт по 3 электрона молекуле йода. Алюминий является восстановителем, а йод – окислителем. В результате этого взаимодействия образуется йодид алюминия.
Галогены также вытесняют друг друга из солей. Так, более активный галоген вытесняет из раствора соли менее активный.
Например, хлор вытесняет бром из раствора его соли, потому что хлор более активный галоген, чем бром. Хлор в данной реакции понижает свою степень окисления с 0 до -1, а бром повышает с -1 до 0. В результате чего, каждый бром отдаёт по 2 электрона молекуле хлора. Образуется новая соль – хлорид натрия и молекулярный бром. Хлор является окислителем, а бром – восстановителем.
Бром вытесняет йод из раствора йодида калия. В этой реакции бром понижает свою степень оксиления с 0 до -1, а йод повышает свою степень окисления с -1 до 0. При этом 2 электрона от йода переходят к молекуле брома. В результате взаимодействия образуется соль – бромид калия и простое вещество – йод. Бром является окислителем, а йод – восстановителем.
Для фтора эта реакция не характерна, потому что он взаимодействует с водой, а эти реакции протекают в растворе.
Галогены реагируют с водородом с образованием галогеноводородов. Например, с фтором водород реагирует со взрывом, с хлором – в присутствии света, а с бромом – при нагревании. В результате взаимодействия водорода с фтором образуется фтороводород, в результате взаимодействия водорода с хлором – хлороводород, в результате взаимодействия водорода с бромом – бромоводород.
Получение галогенов оказалось сложным процессом. Например: фтор в свободном виде получен впервые только в 1886 году французским химиком Муассаном, который был удостоен за это
Хлор открыт шведским химиком Шееле в 1774 году. Элемент получил название за цвет простого вещества (от греческого хлорос – жёлто-зелёный).
Бром открыт в 1826 г. французским химиком Баларом. Элемент назван так за запах простого вещества (от греческого бромос – зловонный).
Йод получен в 1811 г. французским учёным Куртуа, а название он получил за цвет паров простого вещества (от греческого иодэс – фиолетовый
Таким образом, галогены – это элементы VII A группы, их молекулы двухатомны. Они являются сильными окислителями, самый сильный – фтор. Степень окисления фтора – -1, остальные галогены могут иметь степень окисления и +1, +3, +5, +7. В природе встречаются только в виде соединений. Физические свойства их разнообразны: это газы (фтор и хлор), жидкость – бром и твёрдое вещество – йод. С увеличением молекулярной массы у галогенов увеличиваются температуры кипения и плавления. Они вступают во взаимодействие с металлами, с водородом и растворами солей, при этом более активный галоген вытесняет из соли менее активный.
videouroki.net
Химические свойства галогенов — урок. Химия, 8–9 класс.
Галогены относятся к химически активным веществам. В реакциях с металлами и большинством неметаллов, а также со сложными веществами галогены проявляют сильные окислительные свойства. Наиболее активен в химических реакциях фтор. С увеличением молекулярной массы активность галогенов снижается.
Взаимодействие с металлами
При взаимодействии галогенов с металлами образуются соли: фториды, хлориды, бромиды, иодиды.
Фтор реагирует со всеми металлами (даже с золотом и платиной), с большинством — при обычных условиях:
Ca+F2=CaF2,
2Au+3F2=t2AuF3.
Остальные галогены реагируют с металлами при нагревании:
2Fe+3Cl2=t2FeCl3,
Cu+Br2=tCuBr2,
2Al+3I2=t2AlI3.
Взаимодействие с водородом
В реакциях галогенов с водородом образуются газообразные галогеноводороды.
Фтор взаимодействует с водородом со взрывом с образованием фтороводорода:
h3+F2=2HF.
Смесь хлора с водородом взрывается только при поджигании или освещении. В результате реакции образуется хлороводород:
h3+Cl2=t2HCl.
Бром начинает реагировать с водородом только при нагревании, и реакция происходит без взрыва. Продукт реакции — бромоводород:
h3+Br2=t2HBr.
Реакция иода с водородом идёт медленно даже при нагревании. Иод с водородом образуют газ иодоводород:
h3+I2=t2HI.
На примере этих реакций прослеживается снижение химической активности веществ в ряду: фтор — хлор — бром — иод.
Все галогеноводороды хорошо растворяются в воде. Их растворы представляют собой кислоты:
HF — плавиковая, HCl — соляная, HBr — бромоводородная, HI — иодоводородная.
Сила кислот в этом ряду увеличивается. Самая слабая из них — плавиковая кислота, самая сильная — иодоводородная.
Вытеснение галогенов друг другом из солей
В реакциях галогенов с галогенидами проявляется следующая закономерность: более активный галоген вытесняет менее активный из его солей. Так, хлор взаимодействует с водными растворами бромидов и иодидов, выступая в этих реакциях окислителем:
2KBr−1+Cl02=Br02+2KCl−1,
2NaI−1+Cl02=I02+2NaCl−1.
Бром способен вытеснить иод из иодидов, а с хлоридами не реагирует:
2KI−1+Br02=I02+2KBr−1.
У иода способность вытеснять другие галогены отсутствует, так как его окислительные свойства в ряду галогенов самые слабые.
Реакции фтора с водными растворами солей невозможны по причине его взаимодействия с водой.
www.yaklass.ru
Галогены в природе. Применение галогенов и их соединений — урок. Химия, 8–9 класс.
Галогены в природе
Галогены — химически активные вещества, поэтому в природе они находятся только в виде соединений.
Фтор встречается в виде флюорита CaF2, криолита Na3AlF6 и некоторых других минералов.

Флюорит

Криолит
Наиболее распространённые соединения хлора — каменная соль (галит) NaCl и сильвинит KCl⋅NaCl.

Галит
Сильвинит
Бром и иод собственных минералов не образуют. Их соединения содержатся в морской воде и накапливаются водорослями.
Бурые водоросли
Галогены в живых организмах
Все галогены ядовиты, но их соединения жизненно необходимы живым организмам, в том числе и человеку.
Соединения фтора входят в состав костной ткани и эмали зубов. При недостатке фтора зубная эмаль разрушается, и появляется кариес.
Хлор относится к макроэлементам и необходим для нормального функционирования организмов. Хлорид натрия входит в состав плазмы крови, поддерживает деятельность всех клеток. Из него образуется соляная кислота, содержащаяся в желудочном соке.
Соединения брома регулируют процессы торможения и возбуждения нервной системы.
Иод обязательно должен поступать в организм, так как участвует в образовании гормонов щитовидной железы, контролирующих обмен веществ. При его недостатке развивается зоб — заболевание щитовидной железы. Для профилактики зоба используют иодированную соль (в поваренную соль добавляют иодид калия).
Применение галогенов и их соединений
Фторид кислорода применяется как окислитель ракетного топлива. Тефлон (фторосодержащий полимер) используется для термостойких покрытий.
Соединения фтора входят в состав зубных паст для профилактики кариеса.
Молекулярный хлор применяется для обеззараживания воды, для отбеливания тканей, бумаги, древесины.
Большое количество хлора расходуется при производстве соляной кислоты, а также пластмасс, каучуков, растворителей, красителей.
Поваренная соль добавляется в пищу, а калийную соль (хлорид калия) вносят в почву в качестве калийного удобрения.
Соединения брома и иода используются в медицине для лечения и профилактики некоторых заболеваний. Спиртовой раствор иода применяется при обработке ран и царапин.
www.yaklass.ru
Характерные химические свойства водорода и галогенов.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген | Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром и йод вытесняют серу из растворов сульфидов и или сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
scienceforyou.ru
Химические свойства галогенов. Конспект по химии
Химические свойства галогенов
Ключевые слова конспекта: химические свойства галогенов, реакция галогенов с металлами, реакции с неметаллами, реакции галогенов с водой, со щелочами, с солями-галогенидами.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
1. Реакция с металлами.
Галогены реагируют практически со всеми металлами (кроме благородных металлов) с образованием галогенидов. Например, натрий горит в хлоре: 2Na + Cl2 = 2NaCl
Со фтором реакции идут очень бурно, с йодом – только при нагревании, часто требуется вода как катализатор.
Окислительная активность галогенов снижается от фтора к йоду. Это можно продемонстрировать на примере окисления железа (обратите внимание на его степень окисления в галогенидах):
В ходе реакции с бромом Вг2 может образоваться как FeBr3, так и FeBr2:
В реакции с йодом I2 при температуре 500 °С образуется Fel2:
Фтор, хлор и бром окисляют железо глубже (до Fe3+), чем йод.
2. Реакции с неметаллами.
Окислительную способность галогенов можно сопоставить и в реакциях с неметаллами. Галогены реагируют со многими неметаллами (исключением являются благородные газы, азот N2, кислород O2).
Галогены реагируют с водородом, при этом условия проведения реакции зависят от того, с каким из галогенов проводится реакция:
Со фтором реакция может начинаться даже при t° = –250 °С, с хлором реакция идёт при сгорании водорода в хлоре или даже при комнатной t° на свету. С бромом и йодом реакция идёт при температуре 350–500 °С или при наличии катализатора платины Pt. Реакция образования йодоводорода HI обратима. Таким образом, по мере увеличения относительной молекулярной массы галогена от фтора F2 к иоду I2 условия проведения реакции должны быть более жёсткими.
Галогены реагируют с серой. Фтор взаимодействует с серой даже при температуре жидкого воздуха, окисляя её до высшей степени окисления:
Реакция серы с хлором приводит к образованию либо SCl2, либо S2Cl2:
Обратите внимание: здесь встретилась сравнительно редкая для серы степень окисления +2.
С йодом сера не реагирует. Более глубокое окисление серы в реакции со фтором демонстрирует более высокую окислительную способность фтора.
Галогены реагируют с фосфором. Красный и белый фосфор уже при комнатной температуре самовоспламеняется во фторе и хлоре, реагирует с жидким бромом. При этом в реакции со фтором происходит более глубокое окисление фосфора:
В реакциях фосфора с хлором и бромом могут образоваться РCl3 и РВг3, но по мере повышения температуры в результате окисления фосфора глубина окисления возрастает – образуются РCl5 и РВг5.
Фтор реагирует с графитом при температуре выше 900 °С:
Остальные галогены не реагируют с простыми веществами, образованными углеродом (алмазом, графитом).
3. Реакции с водой.
Рассмотрим реакции галогенов со сложными веществами. Галогены взаимодействуют с водой. При этом фтор окисляет кислород воды. Пары воды горят в атмосфере F2:
Хлор обратимо реагирует с водой, но при этом не происходит окисление кислорода. В этой реакции хлор сам является как окислителем, так и восстановителем (такие реакции называют реакциями диспропорционирования):
4. Реакции со щелочами.
Хлор, бром и йод реагируют со щелочами, в ходе реакции хлор является и окислителем, и восстановителем:
5. Реакции галогенов с солями-галогенидами.
Галогены способны вытеснять друг друга из солей-галогенидов и из галогеноводородов. Фтор F2 вытесняет все остальные галогены из галогеноводородов и галогенидов (в растворах параллельно идёт реакция окисления воды). Хлор Cl2 вытесняет бром и йод из НВг, бромидов, HI и иодидов. Бром Вг2 вытесняет йод из йодидов и йодоводорода. Йод I2 не вытесняет другие галогены:
Признаком данной реакции в растворе является изменение окраски с бесцветной на жёлтую.


Конспект урока по химии «Химические свойства галогенов». Выберите дальнейшее действие:
uchitel.pro
Общая характеристика галогенов
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
Образовательные:
- Охарактеризовать особенности положения галогенов в Периодической системе Д.И.Менделеева.
- Охарактеризовать особенности строения атомов галогенов.
- Охарактеризовать физические свойства галогенов.
- Охарактеризовать химические свойства галогенов.
- Обобщить знания учащихся об областях применения галогенов, их роли в работе организма человека.
Развивающие:
- Продолжить формирование умений учащихся описывать положение элементов в Периодической системе, строение атомов, исходя из этого положения.
- Продолжить формирование умений учащихся описывать химические свойства элементов исходя из их положения в Периодической системе и строения атомов этих элементов.
- Закрепить знания, умения и навыки учащихся по составлению уравнений окислительно-восстановительных реакций.
Воспитывающие: Развить у учащихся навыков логического мышления, умений делать выводы, обобщать и сравнивать.
Оборудование:
- Периодическая система химических элементов Д.И.Менделеева,
- Учебник «Химия – 8» под редакцией Н.Е.Кузнецовой, 2011 г.
- компьютер,
- проектор,
- Электронная презентация урока Power Point «Галогены» (Презентация)
Реактивы:
- иод кристаллический
- круглодонная колба
- спиртовка
- спички
Подготовка к уроку:
Класс разбивается на группы, которые получают задание подготовить дополнительный материал по темам
- Применение и действие на организм фтора.
- Применение и действие на организм хлора.
- Применение и действие на организм брома.
- Применение и действие на организм иода.
Тип урока: изучение нового учебного материала.
Вид урока: смешанный
Ход урока
I. Организационный момент
- приветствие
- подготовка учащихся к работе
- наличие учащихся
II. Вводная часть:
Сегодня мы с Вами поговорим об элементах, расположенных в одной группе периодической системы (седьмая группа, главная подгруппа) (Слайд № 3). Эти элементы объединены одним названием «Галогены», что в переводе с греческого означает рождающие соли (греч. hals — соль и genes — рождающий, рожденный). Галогены так названы потому, что при взаимодействии с металлами они непосредственно (сразу) образуют соли.
III. Основная часть урока.
1. Положение в Периодической системе.
Галогены находятся в VII группе главной подгруппе.
К галогенам относятся
- ФТОР 2 период
- ХЛОР 3 период
- БРОМ 4 период
- ИОД 5 период
- АСТАТ 6 период (Слайд 4)
2. Строение атомов (Заполнение таблицы Слайд № 5)
Как вниз по группе изменяется относительная атомная масса?
Какой физический смысл имеет номер периода, в котором находится элемент?
Как вниз по группе изменяется число электронных слоев?
Как вниз по группе изменяется радиус атомов?
Какой физический смысл имеет номер группы, в которой находится элемент?
Сколько же электронов на внешнем слое у галогенов?
Как вниз по группе изменяются неметаллические свойства?
Как вниз по группе изменяются окислительно-восстановительные свойства?
| Элемент | Ar | Число электронных слоев | Радиус атома | Числовалентных электронов | не Металлические свойства | Окислительные свойства |
| F | 19 | 2 слоя | увеличивается | 7 электронов | уменьшаются | уменьшаются |
| Cl | 35, 5 | 3 слоя | 7 электронов | |||
| Br | 80 | 4 слоя | 7 электронов | |||
| I | 127 | 5 слоев | 7 электронов | |||
| At | [210] | 6 слоев | 7 электронов |
Итак, мы выяснили, как изменяются свойства элементов вниз по группе и что общего в их строении.
Наличие 7 электронов на внешнем слое определяет общее в строении молекул галогенов.
3. Строение молекулы галогенов.
Строение молекулы галогенов рассмотрим на примере хлора. Построим двухатомную молекулу хлора. (На доске это задание выполняет ученик) Проверка осуществляется с помощью слайда презентации. (Слайд № 6)
Все галогены образуют двухатомные молекулы – F2, Cl2, Br2, I2.
Связь одинарная.
Тип связи – ковалентная неполярная связь.
Как вы думаете, какая кристаллическая решетка характерна для галогенов?
Какие физические свойства характерны для веществ с молекулярной кристаллической решеткой?
4. Физические свойства галогенов.
Рассмотрим фотографии галогенов (Слайды №7 – №11)
Фтор и хлор газы, бром летучая жидкость ( все пространство в ампуле заполнено парами брома). Иод твердое вещество, но он тоже обладает свойством летучести. Для него характерна возгонка – процесс перехода из твердого состояния в газообразное, минуя жидкость. Посмотрим возгонку иода на опыте. (Опыт демонстрирует учитель)
Заполним таблицу (Слайд №12)
| Галоген | Агрегатное состояние | Цвет | Запах | T плавления | Т кипения |
| F2 | газ | Бледно-желтый | Резкий, раздражающий запах | − 219,7°С | − 188,2°С |
| Cl2 | газ | Желто-зеленый | Резкий, неприятный запах | − 100°С | − 34°С |
| Br2 | жидкость | Красно-бурый | Резкий удушающий, пары токсичны | − 7,2°С | 58,8°С |
| I2 | тв. вещество | Темно-фиолетовый | Специфический резкий запах | 113,5°С | 184,3°С |
Астат – радиоактивный элемент. (Слайд № 13)
Астат был вторым (после технеция) элементом, синтезированным искусственно.
Он является наиболее редким элементом среди всех, обнаруженных в природе.
В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.
Образует сине-чёрные кристаллы.
Очень радиоактивен, поэтому о нём сравнительно мало известно.
Период полураспада наиболее долгоживущего изотопа астата-210 равен 8,1 часа.
Химические свойства мало изучены.
5. Нахождение галогенов в природе.
Галогены в свободном виде в природе не встречаются.
Фтор распространен в виде минерала флюорита (плавиковый шпат) СаF2. (Слайд № 14)
Хлор встречается в виде минерала галит (каменная соль) NaCl (Слайд № 15) и сильвин KCl (Слайд № 16)
Бром и иод встречаются в виде соединений в природных водах. Много иода содержится в морских водорослях ламинарии. (Слайд № 17)
6. Химические свойства галогенов. (Слайд № 18)
На уроке рассмотрены следующие химические свойства:
- А) Взаимодействие с металлами (Слайд № 19)
- Б) Взаимодействие с водородом (Слайд № 20)
- В) Взаимодействие с водой (Слайд № 21)
- Г) Взаимодействие со сложными веществами. (Слайд № 22)
Ребята записывают уравнения реакций, разбирают их как
urok.1sept.ru
Галогены, подготовка к ЕГЭ по химии
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F — 2s22p5
- Cl — 3s23p5
- Br — 4s24p5
- I — 5s25p5
- At — 6s26p5
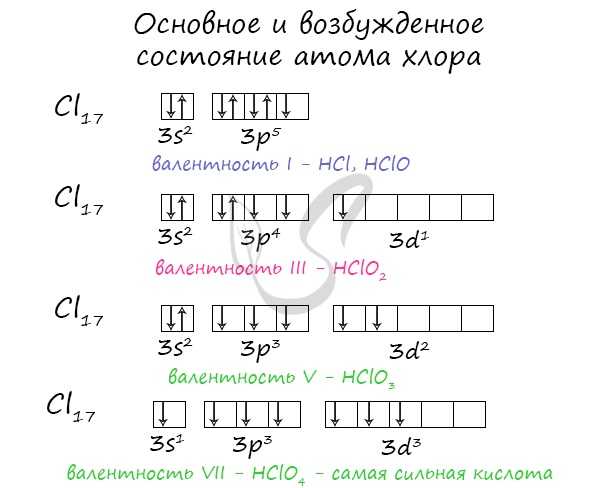
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит

Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
HF → F2 + H2
Более активные галогены способны вытеснить менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

В лабораторных условиях галогены могут быть получены следующими реакциями.
HCl + MnO2 → MnCl2 + Cl2 + H2O
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Al + F2 → AlF3
Cu + Cl2 → CuCl2
Na + Br2 → NaBr
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F—)
Br2 + I2 → BrI3 (бром более электроотрицателен, чем йод — I—)
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KCl + F2 → KF + Cl2
KBr + Cl2 → KCl + Br2
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
Получение
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
H2 + Cl2 → HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H2SO4 → NaHSO4 + HCl↑
CaF2 + H2SO4 → CaSO4 + HF
PBr3 + H2O → HBr↑ + H3PO3
H2S + I2 → S + HI
Химические свойства
- Кислотные свойства
- С солями
- Восстановительные свойства
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Mg + HBr → MgBr2 + H2↑
Zn + HCl → ZnCl2 + H2↑

Галогеноводороды реагируют с основными, амфотерными оксидами и основаниям с образованием соответствующих солей.
Na2O + HCl → NaCl + H2O
ZnO + HI → ZnI2 + H2O
KOH + HCl → KCl + H2O (реакция нейтрализации)

Cr(OH)3 + HCl → CrCl3 + H2O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO3 + HCl → AgCl + HNO3
Li2CO3 + HBr → LiBr + H2CO3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
HI + MnO2 → I2 + MnI2 + H2O
HI + H2SO4 → I2 + H2S + H2O
HI + O2 → H2O + I2
HI + Br2 → HBr + I2
HCl + H2SO4 → Cl2 + SO2 + H2O

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
