Характерные химические свойства водорода и галогенов.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.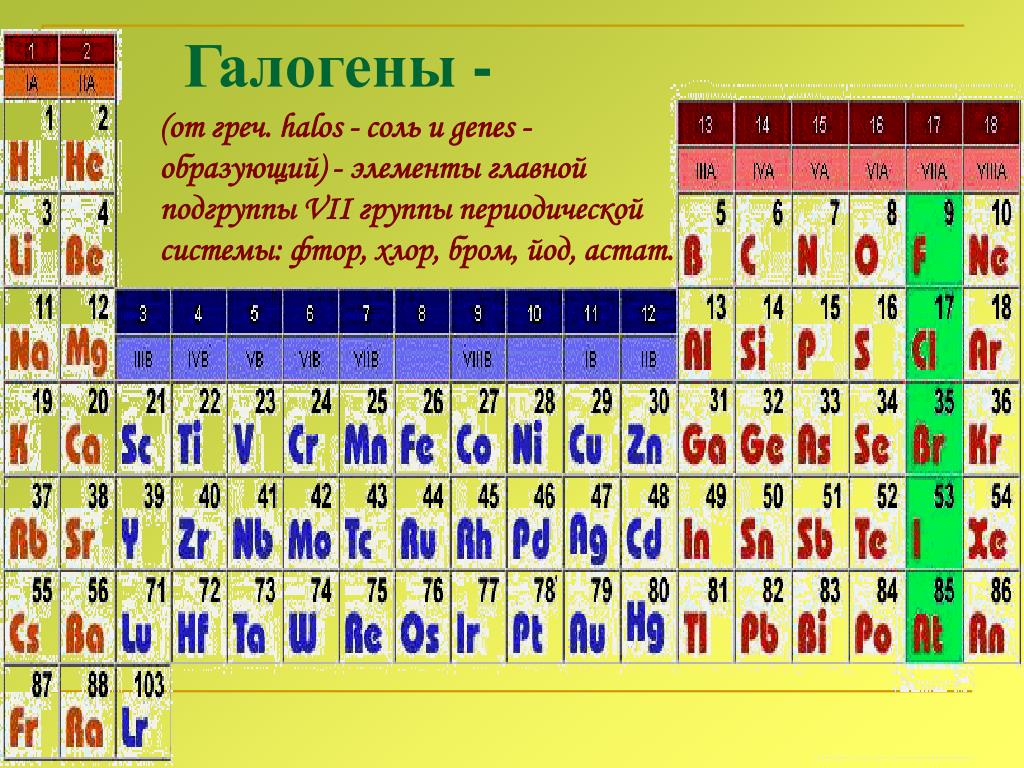
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
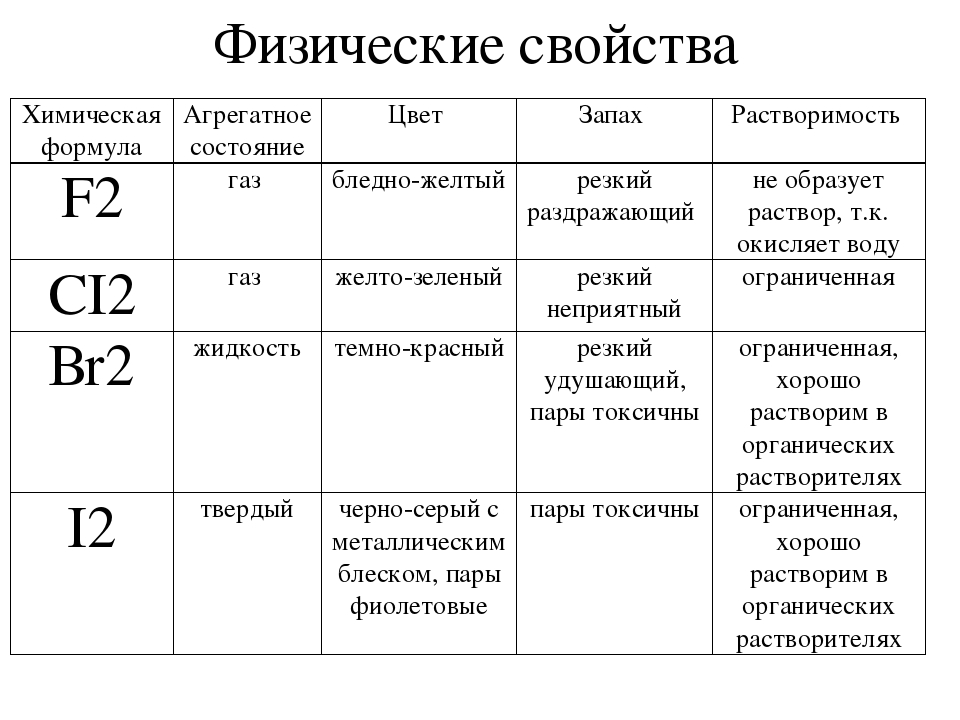
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген | Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
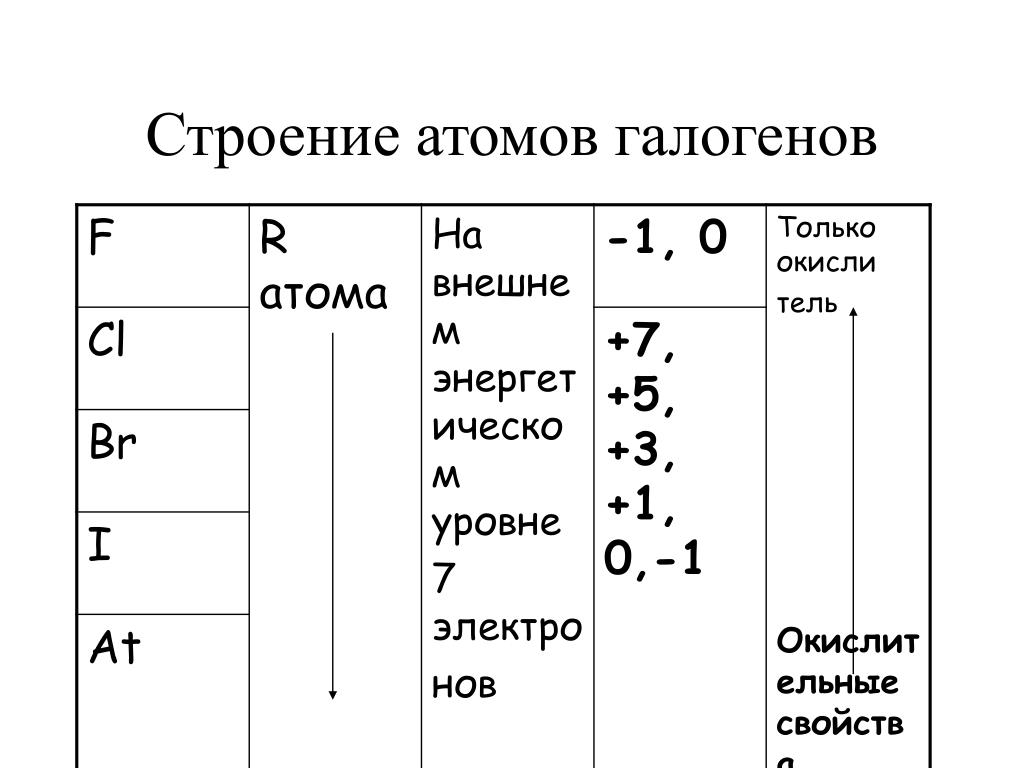
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).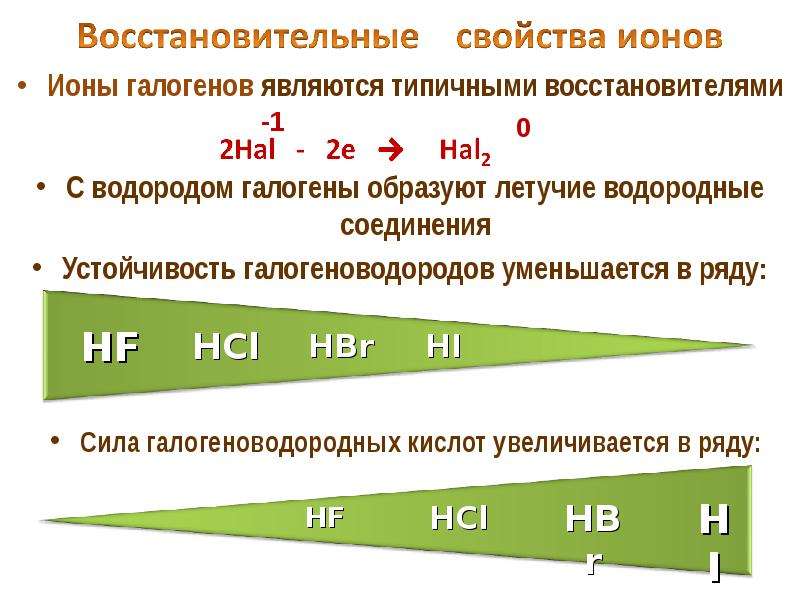 При этом происходит образование пентафторида фосфора:
При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т. е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Элементы — Общая и неорганическая химия
p-Элементы III группы
К p-элементов III группе относятся бор B, алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные — металлы. В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам.
 Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе — металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.
Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе — металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns2np1. В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор — достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
p-Элементы IV группы
К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb.
 Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns2np2. Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.
Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns2np2. Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.Углерод и кремний — типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения. Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи.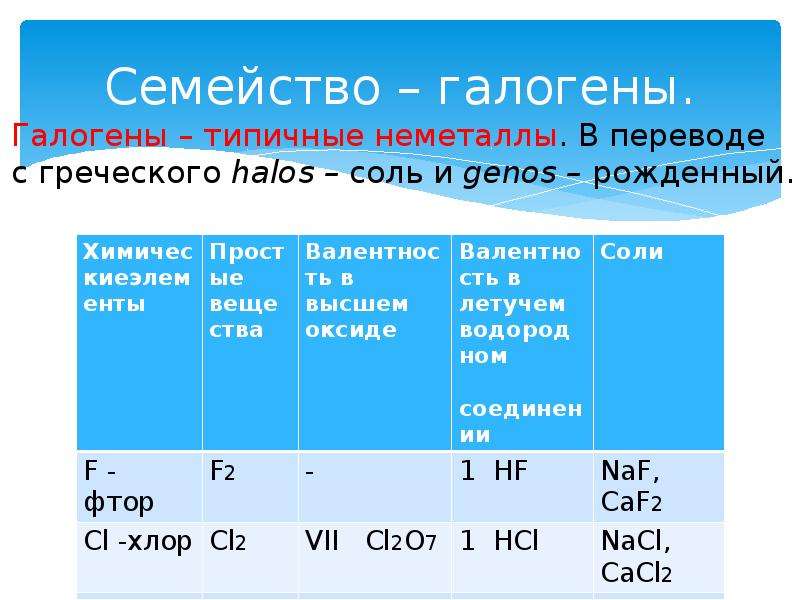
p-Элементы V группы
К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns2np3.
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи.
В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N — P — As — Sb — Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
p-Элементы VI группы
К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали. Например, в кислых водных растворах существуют ионы гидроксонию H3O+, в которых атом кислорода соединен с тремя атомами водорода ковалентными связями. В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до 6.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns2np6. Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O — S — Se — Te — Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности. Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических. Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
p-Элементы VII группы — галогены
К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астату At.
 Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns2np5.
Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns2np5.На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств. Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1. Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F — Cl — Br — I — At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
p-Элементы VIII группы
К p-элементов VIII группы относятся гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rh, которые составляют главную подгруппу. Атомы этих элементов имеют завершенные внешние электронные слои, поэтому электронная конфигурация валентных подуровней их атомов в основном состоянии имеет вид 1s
Криптон (4s24p6), ксенон (5s25p6) и радон (6s26p6) отличаются от предыдущих благородных газов большими размерами атомов и, соответственно, меньшими энергиями ионизации.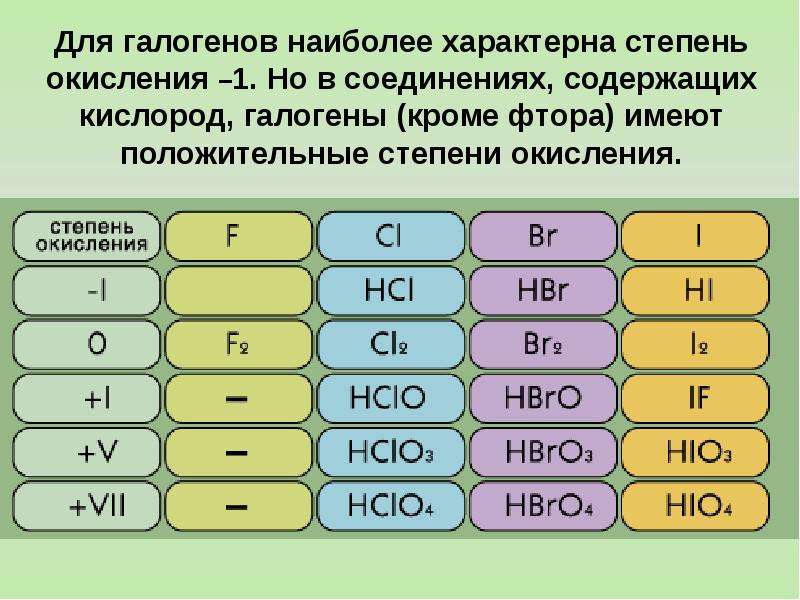 Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
| Тема работы: | Галогены, их соединения и биологическое значение в жизни человека | Краткое содержание: | Содержание Введение 2 Введение Галогены — это химические элементы главной подгруппы VII группы таблицы Менделеева. В группу галогенов входят: фтор F, хлор Cl, бром Br, иод I , астат At. |
Урок на тему: Галогены — химические элементы и простые вещества. 8 класс
«Галогены как химические элементы и простые вещества»
разработка урока для 8-го класса
Цель урока: Познакомить учащихся с естественным семейством химических элементов Галогенами, как наиболее активными неметаллами.
Задачи урока: — рассмотреть сходство и различие галогенов на основе их положения в Периодической системе и теории строения атома, узнать о распространении галогенов в природе и важнейших областях применения галогенов, о пользе и вреде галогенов для организма человека;
— развивать умения учащихся записывать электронную и электронно-графическую формулы, сопоставлять факты и сравнивать простые вещества по определённым признакам, развивать абстрактное мышление учащихся;
— воспитывать самостоятельность, ответственность, интерес к предмету.
Оборудование: На демонстрационном столе предметы: зубная паста с фтором, йодомарин, йод, белизна, бром, камфора, фотография, соль поваренная, морская капуста, тефлон. Сообщения учащихся об использовании и значении галогенов (опережающее задание).
Ход урока:
I. Организационный момент.
1) Психологический настрой.
а) отгадывание загадок
1….молчал и думал: «Эх!..
Ведь приду – окислю всех…» (фтор)
2… хвалился: «Нет мне равных!
Галоген я самый главный.
Зря болтать я не люблю:
Всё на свете отбелю!» (хлор)
3.Не боюсь я:
Пусть пожжёт,
Раз полезен этот ….
4.Вот лекарство. Ты не бойся:
Для здоровья и красы
Детям мажут им коленки,
Локти, щёки и носы.(йод)
5.Два элемента химических
В метаграмме я вам загадал:
С X – элемент металлический,
А с Б – я уже неметалл. (бром)
(бром)
Мы изучим непременно,
Элементы галогены
(А по-русски – солероды),
Все от фтора и до йода.
Даже новенький астат
Быть в семействе этом рад.
2) Сообщение темы и цели и плана урока.
II.Изучение нового материала
История открытия
Фтор в свободном виде получил впервые в 1886 г. французский химик Анри Муассан, который был удостоен за это Нобелевской премии. Свое название элемент получил от греческого фторос – «разрушающий».
Хлор открыт шведским химиком К. Шееле в 1774 г. Элемент получил название за свой цвет (греч. хлорос – желто – зеленый ). В жидком состоянии его впервые получил Майкл Фарадей.
Бром открыт 1826 г. французским химиком А. Баларом. Элемент назван так за свой запах ( греч. бромос – «зловонный»). Кроме того А. Балар назвал данный элемент мурид.
бромос – «зловонный»). Кроме того А. Балар назвал данный элемент мурид.
Йод получен в 1811 г. французским ученым Б. Куртуа, а название получил за цвет своих паров (греч. иодэс – фиолетовый). Академик А. Е. Ферсман назвал его «вездесущий».
По выданному тексту заполнить таблицу
Знак химического элементаЭтимология названия
Год открытия, автор
2.положение галогенов в таблице
Учащиеся работают самостоятельно по плану:
1. Химический знак и порядковый номер.
2. Положение в Периодической системе
3. Строение атома.
4. Возможные степени окисления а)положительные
б) отрицательные
5. Формула водородного соединения.
6. Формула высшего оксида.
3.Строение атомов
На внешнем электронном слое атомов галогенов находятся 7 электронов.
- Название
Схема строения атома
Электронная формула
Фтор
F +9)2)7
…2s22p5
Хлор
Cl +17)2)8)7
…3s23p5
Бром
Br +35)2)8)18)7
…4s24p5
Йод
I +53)2)8)18)18)7
…5s25p5
1) Общая электронная конфигурация внешнего энергетического уровня — nS2nP5.
Размеры атомов увеличиваются сверху вниз, самый маленький радиус из всех галогенов имеет фтор, поэтому у него самая высокая (даже среди всех химических элементов) относительная электроотрицательность. По этой причине не существует веществ, в которых фтор имел бы положительную степень окисления, не говоря о высшей степени окисления, соответствующей номеру группы (+7).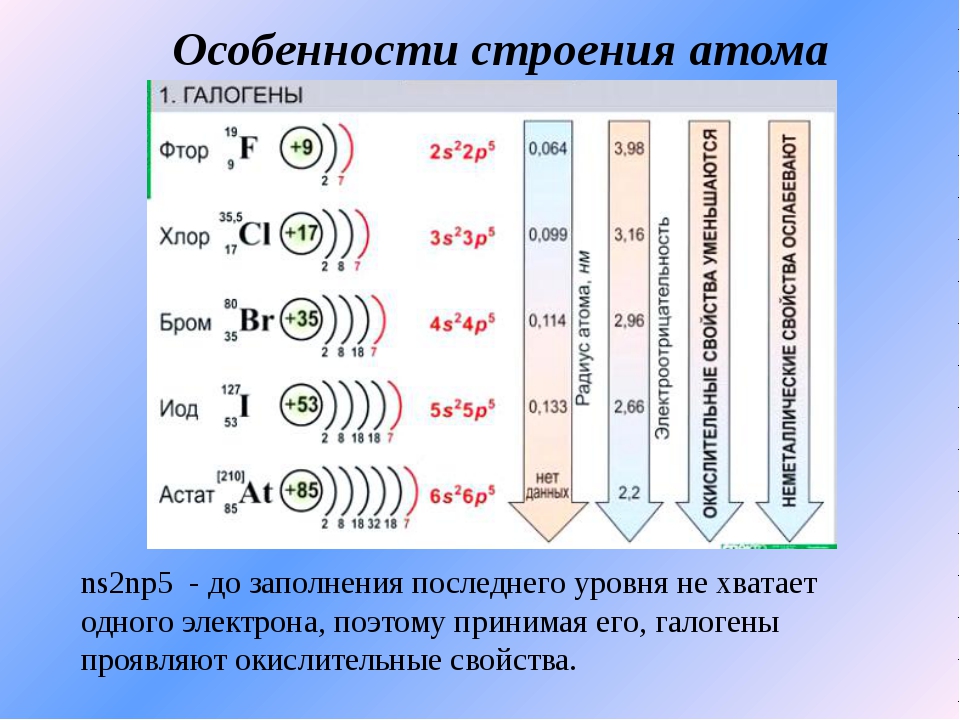 Для фтора возможны степени окисления только –1 и 0. Остальные галогены в соединении с более электроотрицательным кислородом могут образовывать вещества, в которых степень окисления их атомов положительна. Таким образом, для Cl, Br, I характерны степени окисления -1, 0, +1, +3, +5, +7.
Для фтора возможны степени окисления только –1 и 0. Остальные галогены в соединении с более электроотрицательным кислородом могут образовывать вещества, в которых степень окисления их атомов положительна. Таким образом, для Cl, Br, I характерны степени окисления -1, 0, +1, +3, +5, +7.
4. нахождение в природе
Содержание галогенов в земной коре снижается от фтора к астату. Причем, если фтор, бром и йод можно отнести к распространенным химическим элементам, то содержание астата в земной коре крайне мало. Галогены входят в состав многих минералов. Исключение составляет астат. Астат обнаружен в продуктах радиоактивного распада урана.
5.состав молекул, связь, кристаллические решетки
Хлор хвалился: “Нет мне равных!”,
Галоген я самый главный.
Зря болтать я не люблю:
Все на свете отбелю!”
Йод своей красой гордился,
Твердым был, но испарился.
Фиолетовый, как ночь,
Далеко умчался прочь.
Бром разлился океаном,
хоть зловонным, но — румяным,
Бил себя он грозно в грудь:
“Я ведь бром! Не кто-нибудь…”.
Фтор молчал и думал: “Эх!..
Ведь приду – окислю всех ….”
В свободном состоянии галогены образуют вещества, состоящие из двухатомных молекул F2, Cl2, Br2, I2.
Двухатомные молекулы галогенов связаны ковалентной неполярной связью.
или Г — Г,
а кристаллическое строение галогенов представлено молекулярными кристаллическими решетками. Следовательно, при обычных условиях F2 и Сl2 — газы, Вr2 — бурая жидкость, а I2 — твердое кристаллическое вещество, способное к возгонке (демонстрация). Указывают, что в ряду F2, Сl2,Вr2, I2 — плотность простых веществ растет, а интенсивность окраски увеличивается. Следовательно, подчеркивает учитель, в изменении свойств атомов и простых веществ — галогенов проявляется одинаковая закономерность: с увеличением порядкового номера неметаллические свойства ослабевают, а металлические — усиливаются.
Вывод:
1.общее в строении атомов галогенов — число электронов на внешнем электронном слое; 2. различие строения атомов галогенов — заряд ядра.
3. Галогены являются — сильными окислителями;
III.закрепление
«Вездесущий» – так назвал этот галоген академик А.Е Ферсман. Назовите этот галоген.
а – бром; б – фтор; в – хлор; г – йод.
2. Этот галоген назвали «всесъедающий», хотя он входит в состав зубной эмали.
а – бром; б – фтор; в – хлор; г – йод.
3. Галоген, возможность существования которого предсказал Д.И. Менделеев.
а – бром; б – астат; в – хлор; г – йод.
4. Назовите форму существования галогенов в природе.
а – простых веществ; б – свободных атомов; в – соединений ; г – не знаю..
5. Как изменяется радиус атомов галогенов с увеличением относительной атомной массы?
а – уменьшается; б – не знаю; в – увеличивается ; г – не изменяется
ответ:1 – г; 2 – б; 3 – б; 4 – в; 5 — в. ( гббвв)
( гббвв)
Творческие задания для учащихся
1. В вашем доме есть бутыль с жидким отбеливателем, но этикетка с инструкцией потеряна. Препарат имеет сильный запах хлора. Вы решили обработать им белье. Какую посуду вы выберете: алюминиевый таз, эмалированный бак с поврежденной поверхностью или пластмассовый таз?
2. Вы пролили йод на белую салфетку. Попытались вывести пятно с помощью белизны, в которой есть хлор, но неудачно. Однако пятно через несколько дней само исчезло. Почему хлор не справился с йодом? И чем можно объяснить исчезновение пятна через несколько дней?
3. Поспорили два друга. Один из них утверждал что, в поваренной соли есть хлор, другой говорил, что его там нет. Кто из них прав?
§54, до стр.231
4. “Он такой забавный и такой милый! Но это хрупкое создание; нуждается в защите. Восемь из десяти попугайчиков подвержены тяжелому заболеванию щитовидной железы, если в рационе не хватает йода” — так рекламируют свой продукт производители специального корма для попугаев “Трилл”, содержащий йод.
Как вы думаете, авторы рекламы просто пугают владельцев попугайчиков, чтобы продавать больше своей продукции или дефицит йода в самом деле может привести к серьезному заболеванию ваших питомцев?
5. Реклама зубной пасты по частоте стоит на втором месте после рекламы жевательной резинки. А из рекламируемых зубных паст на первом месте, конечно, “Blend-a-med”. Нас уверяют, что уникальная фтористая система флористат эффективно укрепляет зубную эмаль, и демонстрируют опыт с куриным яйцом, которое после обработки этой пастой не растворяется в кислоте. Конечно, это можно проверить самостоятельно, но сначала попробуйте разобраться теоретически.
Что такое флористат? Вы не найдете этого слова в справочниках и даже в химической энциклопедии. Этим термином фирма изготовитель обозначает то фтористое соединение, а чаще их смесь, которое включено в состав зубной пасты.
100 самых питательных продуктов в мире. Сало — в десятке
- Редакция
- BBC Future
Автор фото, Unsplash
Ученые проанализировали более 1000 пищевых продуктов и оценили их питательные и полезные для организма человека свойства.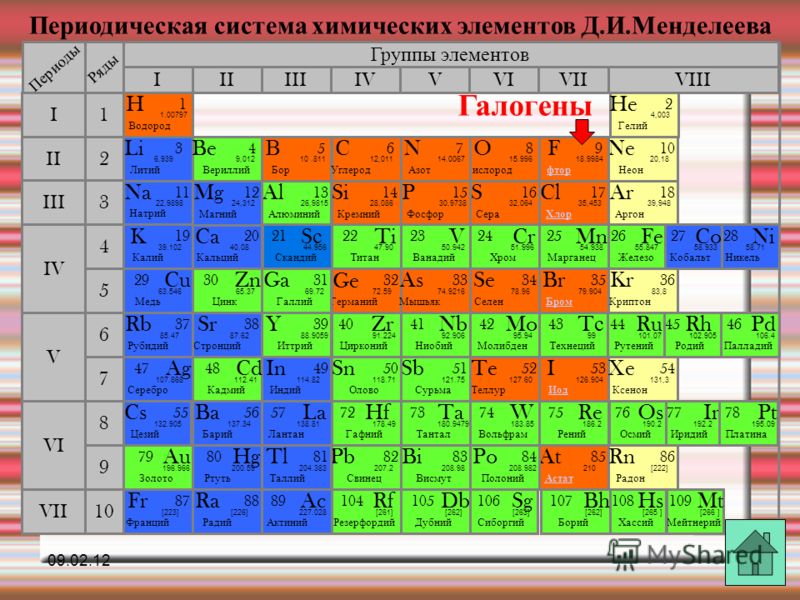 Кое-что в этом списке удивило и самих исследователей.
Кое-что в этом списке удивило и самих исследователей.
Представьте себе идеальный продукт, содержащий не меньше и не больше питательных веществ, чтобы удовлетворить ежедневную потребность организма. Если бы такая еда была, можно было бы спокойно есть только ее, не заботясь о сбалансированном питании.
Но в природе ее нет. Однако есть много продуктов с высокой питательной ценностью. Если составить из них хорошо сбалансированную диету, мы сможем обеспечить организм всеми необходимыми элементами.
Ученые изучили более тысячи пищевых продуктов и присвоили каждому из них индекс питательности. Чем выше индекс, тем больше этот продукт соответствует ежедневным потребностям организма в том или ином элементе.
Внимание: некоторые продукты происходят от животных или растений, которые исчезают. Мы бы не рекомендовали употреблять их.
100. СЛАДКИЙ КАРТОФЕЛЬ/БАТАТ (р — растение)
Этот ярко-оранжевый клубень, довольно дальний родственник картофеля. Он богат бета-каротином.
Он богат бета-каротином.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 49
Инжир выращивают с древнейших времен. В свежем или высушенном виде он является источником марганца.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 49
Содержит много антиоксидантов. В медицине его используют как стимулятор пищеварения и для лечения простудных заболеваний.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 49
Автор фото, Unsplash
Підпис до фото,Имбирь — прекрасное средство от простуды
Тыква содержит много желтого и оранжевого пигмента, прежде всего, эфир ксантофила и бета-каротин.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
96. КОРЕНЬ ЛОПУХА (р)
Его используют в народной медицине и как овощ. Корень лопуха способствует похудению и уменьшает воспалительные процессы.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
95. БРЮССЕЛЬСКАЯ КАПУСТА (р)
Как свидетельствует название, появилась в Брюсселе в XVI веке. Богата кальцием и витамином С.
Богата кальцием и витамином С.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
94. БРОККОЛИ (р)
Головки брокколи содержат недозревшие цветочные бутоны и стебли. Потребление брокколи в США возросло в пять раз за последние 50 лет.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
93. ЦВЕТНАЯ КАПУСТА (р)
В отличие от брокколи головки цветной капусты является вырожденными кончиками побегов. Они не содержат хлорофилла, а потому остаются белыми.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
92. ВОДЯНОЙ ОРЕХ (р)
Водяной орех вообще не является орехом. Это — водное растение, которое обычно растет на болотах.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
91. МУСКУСНАЯ ДЫНЯ (р)
Богата глутатионом. Антиоксидант, который защищает клетки от токсинов, в том числе свободных радикалов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
Автор фото, Getty Images
Підпис до фото,Дыня канталупа — антиоксидант
90. ЧЕРНОСЛИВ (р)
Сушеные сливы содержат очень много питательных веществ, полезных для здоровья, в частности антиоксиданты и антоцианы.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
89. ОСЬМИНОГ ОБЫКНОВЕННЫЙ
Хотя мясо осьминога очень питательное, недавно ученые определили, что оно может содержать вредные токсины и аллергены моллюсков.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
Морковь впервые появилась в Афганистане 1100 лет тому. Оранжевую морковь выращивают в Европе с XVI века.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 50
87. ТЫКВА ЗИМНЯЯ (р)
В отличие от летних тыкв, зимние едят, когда они полностью созреют. В пищу употребляют только мякоть.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 51
86. ПЕРЕЦ ХАЛАПЕНЬО (р)
ПЕРЕЦ ХАЛАПЕНЬО (р)
Зрелый красный перец халапеньо содержит в 35 раз больше каротиноидов, чем зеленый.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 51
Ревень богат минералами, витаминами, клетчаткой и природными фитохимическими веществами, которые играют важную роль в здоровье организма.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 51
Своим насыщенным красным цветом гранат обязан пигментам антоцианы, которые обладают антиоксидантными и противовоспалительными свойствами.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 51
Автор фото, Unsplash
83. КРАСНАЯ СМОРОДИНА (р)
Антоцианы содержатся и в красной смородине. К этому виду также относится белая смородина, а вот черная является отдельным видом.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 51
82. АПЕЛЬСИН (р)
Апельсины — самый распространенный вид цитрусовых, который выращивают в мире. Кислотность апельсина снижается с созреванием.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 51
Эта рыба содержит около 18% белка, 6% жира и вообще не содержит сахара.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 51
80. ТЫКВА ГИГАНТСКАЯ (р)
Это разновидность тыквы Cucurbita maxim. В отличие от последней, она имеет форму, похожую на слезу.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 52
Автор фото, Unsplash
Цитрусовый фрукт, похожий на овальный апельсин, но размером со сливу. Он полностью съедобен, вместе с тонкой кожурой.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 52
Рыба семейства ставридовых.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 52
Горбуша богата жирными кислотами омега-3, которые нормализуют уровень холестерина в крови.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 52
Вишня (Prunus cerasus) является разновидностью черешни (P. avium). Из нее готовят много блюд или замораживают.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 53
75. РАДУЖНАЯ ФОРЕЛЬ
РАДУЖНАЯ ФОРЕЛЬ
Эта тихоокеанская рыба среднего размера — близкий родственник лосося. Она также богата жирными кислотами омега-3.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 53
Беременным и кормящим женщинам есть окуня не рекомендуется. Хоть эта рыба питательная, она может содержать следы ртути.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 53
73. СТРУЧКОВАЯ ФАСОЛЬ (р)
Стручковая или спаржевая фасоль богата сапонинами — соединениями, которые снижают уровень холестерина в крови.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
72. КРАСНЫЙ САЛАТ-ЛАТУК (р)
Исторические данные свидетельствуют, что салат выращивали еще в 4500 до н.э. Он практически не содержит жиров или сахара и богат кальцием.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
71. ЛУК-ПОРЕЙ (р)
Близкий родственник лука и чеснока. Дикий предок порея растет в средиземноморском бассейне.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
Автор фото, Getty Images
Підпис до фото,Из развернутых листьев лука-порея можно сделать лазанью, которая будет полезнее, чем из макаронных изделий
70. КАЙЕНСКИЙ ПЕРЕЦ (р)
Эту приправу производят из уникального сорта перца Capsicum annuum.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
Киви на самом деле родом из Китая. А в Новую Зеландию этот фрукт попал лишь в начале 1900-х, куда его привезли миссионеры.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
68. ЖЕЛТЫЙ КИВИ (р)
Киви — съедобная ягода, богатая калием и магнием, а желтый киви еще и лидер по содержанию антиоксидантов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
67. ГРЕЙПФРУТ (р)
Грейпфрут (Citrus paradisi) родом из Вест-Индии. Родственник большего по размеру помело.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
Рыба семейства скумбриевых. Одна порция макрели содержит в 10 раз больше полезных жирных кислот, чем постная рыба, например, треска.
Одна порция макрели содержит в 10 раз больше полезных жирных кислот, чем постная рыба, например, треска.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
Еще один сорт рыбы, богатый жирными кислотами, которые снижают уровень холестерина. Консервированная нерка с костями является источником кальция.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 54
Разновидность салата с высоким содержанием глюкозинолатов, которые защищают от рака и сердечно-сосудистых заболеваний.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 55
63. ШНИТТ-ЛУК (р)
Несмотря на низкую калорийность, этот вид лука содержит много витаминов А и К, а зеленые листья — ряд полезных антиоксидантов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 55
Автор фото, Getty Images
Приправа, которую также готовят из перца вида Capsicum annuum, имеет высокое содержание антиоксиданта аскорбиновой кислоты.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 55
61. КРАСНЫЕ ПОМИДОРЫ (р)
КРАСНЫЕ ПОМИДОРЫ (р)
Низкокалорийный питательный продукт, который является прекрасным источником фолиевой кислоты, калия и витаминов А, С и Е.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 56
60. ЗЕЛЕНЫЕ ПОМИДОРЫ (р)
Это недозрелые плоды красных помидоров. Потребление этого овоща снижает риск развития рака.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 56
59. САЛАТ-ЛАТУК (р)
Культивируемый салат (Lactuca sativa) является близким родственником дикого салата (L. serriola), распространенного в Америке сорняка.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 56
58. ЛИСТЬЯ ТАРО (р)
Молодые листья таро содержат гораздо больше белка, чем корень этого растения, который чаще употребляют в пищу.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 56
57. ЛИМСКАЯ ФАСОЛЬ (р)
Также известная как масляные бобы, эта разновидность фасоли содержит много углеводов, белков и марганца, и одновременно мало жира.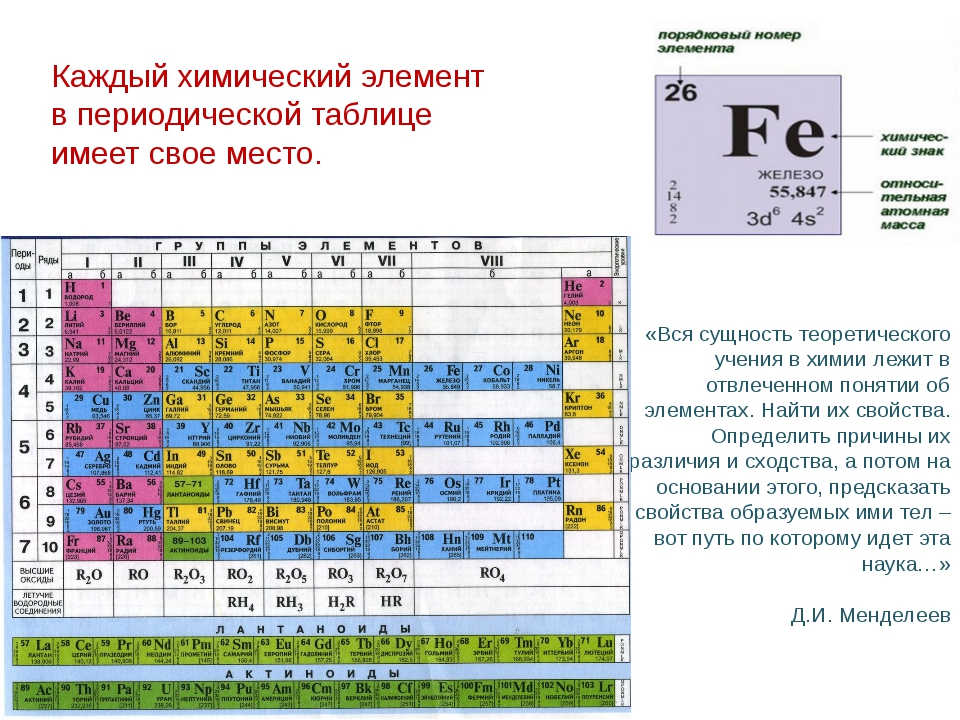
ИНДЕКС ПИТАТЕЛЬНОСТИ: 56
Является хорошим источником рибофлавина (витамина В2), хотя кожная слизь угря может содержать вредные морские токсины.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 56
Большая рыба, богатая кислотами омега-3. Беременным женщинам рекомендуется ограничить потребление тунца из-за его поражения ртутью.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 56
54. СЕРЕБРИСТЫЙ ЛОСОСЬ
Тихоокеанская рыба, другое название — кижуч. Имеет относительно высокое содержание жира и длинноцепочечных жирных кислот.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 56
53. ЛЕТНИЕ ТЫКВЕННЫЕ (р)
Разновидности тыквенных, которые собирают недозревшими, когда кожура плода тонкая и съедобная. Название свидетельствует о коротком сроке хранения овоща.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 57
Автор фото, Emily Rose Brookshire
52. КВАСОЛЯ НЕВИ (р)
КВАСОЛЯ НЕВИ (р)
Также известна как гороховая фасоль. Клетчатка этой фасоли уменьшает риск рака толстой кишки.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 57
Плантан, как и другие виды бананов, содержит разнообразные антиоксиданты, обладает антимикробными и гипогликемическими свойствами, предотвращает развитие диабета.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 57
Автор фото, Getty Images
Підпис до фото,Разновидность бананов — плантан
50. СТРУЧКОВЫЙ ГОРОХ
Горох является отличным источником белков, углеводов, пищевых волокон, минералов и водорастворимых витаминов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 58
49. КОРОВИЙ ГОРОХ (р)
Или вигна китайская. Как и многие другие бобовые, содержит углеводы и больше белка, чем зерновые растения.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 58
48. САЛАТ ПОСЕВНОЙ (р)
Другое название — салат сливочный. Низкокалорийный, популярен в Европе.
Низкокалорийный, популярен в Европе.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 58
47. ВИШНЯ КРАСНАЯ (р)
Разновидность кислой вишни (Prunus cerasus), растет в Европе и Азии.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 58
46. ГРЕЦКИЙ ОРЕХ (р)
Грецкие орехи содержат много а-линоленовой кислоты и растительных жирных кислот омега-3, чрезвычайно полезных для здоровья.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 58
45. СВЕЖИЙ ШПИНАТ (р)
Содержит больше минералов и витаминов (прежде всего, витамин А, кальций, фосфор и железо), чем многие другие виды салатов. Шпинат занимает в списке две позиции 45 и 24 в свежем и замороженном виде соответственно. Способ его приготовления влияет на пищевую ценность.
Свежий шпинат может утратить питательную ценность, если его хранят при комнатной температуре, и имеет более низкий питательный уровень, чем замороженный шпинат.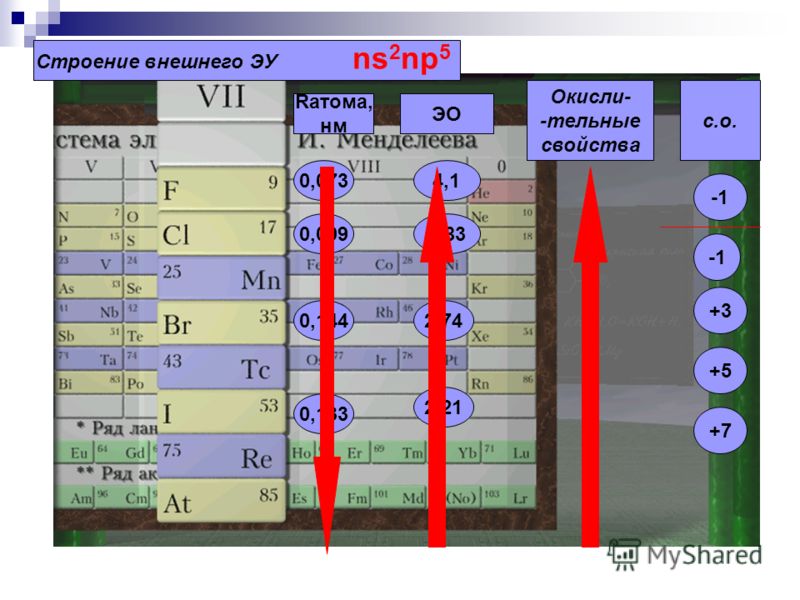
ИНДЕКС ПИТАТЕЛЬНОСТИ: 59
Автор фото, Unspalsh
44. ПЕТРУШКА (р)
Родственница сельдерея, петрушка была очень популярна у древних греков и римлян. Содержит немало полезных минералов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 59
Атлантическая рыба, входит в пятерку самых популярных столовых сортов. Богата жирными кислотами омега-3.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 59
42. МОРСКОЙ ОКУНЬ
Родовое название для ряда родственных жирных сортов рыб среднего размера. Популярный в средиземноморском регионе.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 59
Автор фото, Getty Images
Підпис до фото,Рыбные блюда богаты жирными кислотами омега-3, которые нормализуют уровень холестерина в крови
41. ПЕКИНСКАЯ КАПУСТА (р)
Капуста вида Brassica rapa, принадлежит к тому же роду, что и брокколи и цветная капуста. Низкокалорийная.
Низкокалорийная.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 60
40. КРЕСС-САЛАТ (р)
Другое название — клоповник посевной. Содержит много железа.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 60
Относится к косточковым плодам, имеет сравнительно высокое содержание сахара, фитоэстрогенов и антиоксидантов, в частности бета-каротина.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 60
Икра рыбы содержит много витамина В-12 и жирных кислот омега-3.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 60
37. РЫБА БЕЛЫХ СОРТОВ
Это виды маслянистых пресноводных рыб, родственников лосося. Распространены в северном полушарии. Богаты кислотами омега-3.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 60
36. КОРИАНДР (р)
Травянистое растение, богатое каротиноидами, используется для лечения болезней, в частности расстройств пищеварения, кашля, боли в груди и лихорадки.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 61
35. САЛАТ-РОМЕН (р)
Разновидность латука. Чем свежее листья, тем больше питательных веществ они содержат.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 61
Одна из древнейших специй, содержит вещество синигрин, которое, как полагают, имеет мощные противовоспалительные свойства.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 61
33. АТЛАНТИЧЕСКАЯ ТРЕСКА
Крупная рыба с белым мясом и низким содержанием жира, богатая белками. Печень трески является источником рыбьего жира, богатого кислотами омега-3 и витамином D.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 61
Разновидность тресковых, водится в Атлантическом океане, в Украине — в Черном море.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 61
31. КАПУСТА КАЛЕ (р)
Разновидность капусты, богатая минералами, фосфором, железом и кальцием, а также витаминами группы А и С.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 62
Автор фото, Getty Images
Підпис до фото,Капуста кале — отличный гарнир, она содержит много минералов и витаминов
30. КАПУСТА РОМАНЕСКО (р)
Не следует путать с брокколи. Имеет тонкие стебли и небольшие соцветия, является родственником репы.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 62
29. ПЕРЕЦ ЧИЛИ (р)
Острые высушенные плоды растения Capsicum. Чили содержит много капсаицина (благодаря чему он такой жгучий), каротиноидов и антиоксидантов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 62
28. МОРСКОЙ МОЛЛЮСК
Постный, богатый белками морепродукт. Съедобный моллюск не требует длительной тепловой обработки, хотя употреблять его следует с осторожностью, чтобы избежать пищевых отравлений.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 62
27. БРАУНКОЛЬ (р)
Еще одна разновидность капусты, близкий родственник кале.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 63
Пряное, сладкое травянистое растение, защищает от сердечно-сосудистых заболеваний, а также имеет противогрибковые и антибактериальные свойства.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 63
25. МОЛОТЫЙ ПЕРЕЦ ЧИЛИ (р)
Источник фитохимических веществ, например, витаминов С, Е и А, а также фенольных соединений и каротиноидов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 63
24. ЗАМОРОЖЕННЫЙ ШПИНАТ (р)
Замораживание шпината сохраняет питательные вещества, поэтому в списке он имеет более высокий индекс, чем свежий шпинат (45).
ИНДЕКС ПИТАТЕЛЬНОСТИ: 64
23. ЛИСТЬЯ ОДУВАНЧИКА (р)
Превосходный источник витамина А и С и кальция.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 64
22. РОЗОВЫЙ ГРЕЙПФРУТ (р)
Красный цвет мякоти розового грейпфрута придают каротиноиды и ликопеновые пигменты.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 64
21. МОРСКИЕ ГРЕБЕШКИ
Моллюски с низким содержанием жира и высоким содержанием белка, жирных кислот, калия и натрия.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 64
Автор фото, Getty Images
20. ТИХООКЕАНСКАЯ ТРЕСКА
Близкая родственница атлантической трески. Ее печень является значительным источником рыбьего жира, богатого жирными кислотами и витамином D.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 64
19. КРАСНАЯ КАПУСТА (р)
Ее диким предком было растение, которое росло на побережье Средиземного моря.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 65
18. ЗЕЛЕНЫЙ ЛУК (р)
Содержит много меди, фосфора и магния. Один из самых богатых источников витамина К.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 65
17. МИНТАЙ ДАЛЬНЕВОСТОЧНЫЙ
Нежирная (менее 1% жира) рыба, которая водится в Беринговом море и заливе Аляски.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 65
Быстрый пресноводный хищник. Его мясо очень питательное, но из-за риска загрязнения ртутью беременным женщинам употреблять его рекомендуется.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 65
15. ЗЕЛЕНЫЙ ГОРОШЕК (р)
Содержит много фосфора, магния, железа, цинка, меди и пищевых волокон.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 67
14. МАНДАРИН (р)
Аппетитные цитрусовые фрукты. Содержат много сахара и каротиноиды криптоксантина — предшественника витамина А.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 67
13. ВОДЯНАЯ ХРЕННИЦА (р)
Уникальное овощное растение, которое растет в проточной воде. Обладает прекрасными целебными свойствами и пряным ароматом, похожим на запах хрена.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 68
12. СУШЕНЫЙ СЕЛЬДЕРЕЙ (р)
Высушенные хлопья сельдерея используют как приправу. Они являются важным источником витаминов, минералов и аминокислот.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 68
11. СУШЕНАЯ ПЕТРУШКА (р)
Сушеную и измельченную петрушку используют как пряность. Она имеет высокое содержание бора, фтора и кальция, необходимых для здоровых костей и зубов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 69
Автор фото, Getty Images
Підпис до фото,Посыпать блюдо петрушкой — хорошая идея
Разновидность окуней, морская рыба. Наиболее распространен — красный луциан. Мясо питательное, но может содержать опасные токсины.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 69
9. ЛИСТЬЯ СВЕКЛЫ (р)
Свекольная ботва содержит много кальция, железа, витамина К и группы В (прежде всего, рибофлавина).
ИНДЕКС ПИТАТЕЛЬНОСТИ: 70
Хороший источник витаминов и минералов. Сало — более ненасыщенный и полезный продукт, чем бараний или говяжий жир.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 73
Очень редкий диетический источник беталаина, фитохимического вещества, которое считают эффективным антиоксидантом и которое имеет множество других полезных свойств.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 78
6. ТЫКВЕННЫЕ СЕМЕЧКИ (р)
Семечки различных видов тыкв — одни из самых богатых растительных источников железа и марганца.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 84
5. СЕМЕЧКИ ЧИА (р)
Крошечная черная семечка содержит большое количество пищевых волокон, белка, а-линоленовой кислоты, фенольной кислоты и витаминов.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 85
Камбала или палтус, обычно не содержит ртути и является отличным источником витамина В1.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 88
3. ОКЕАНСКИЙ ОКУНЬ
Атлантический глубоководный вид рыбы, содержит много белка и мало насыщенных жиров.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 89
Тропическое растение с мясистой и сладкой белой мякотью. Богата сахаром и витаминами А, С, В1, В2, а также калием.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 96
Автор фото, Unsplash
Підпис до фото,Лідером за кількістю поживних речовин є мигдаль
Богат ненасыщенными жирными кислотами. Предотвращает сердечно-сосудистые заболевания и диабет.
ИНДЕКС ПИТАТЕЛЬНОСТИ: 97
- Научное исследование «Питательные свойства пищи», опубликованное в журнале PLoS ONE.
- Нормативная база данных питательных веществ Министерства сельского хозяйства США, выпуск 28.
- Энциклопедия пищевых продуктов и здоровья.
Контрольная работа по теме»Галогены и их соединения»
Контрольная работа по теме «Галогены и их соединения» предназначена для учащихся 9 класса (базовый уровень) и может быть использована для подготовки к государственной итоговой аттестации в качестве тренировочного теста по конкретной теме, так как многие задания работы составлены и оформлены в формате ОГЭ и ЕГЭ по химии. На выполнение работы отводится 45 минут.
Контрольная работа по теме «Галогены и их соединения»
1. Выберите среди предложенных элементов галогены и расположи их в порядке усиления окислительных свойств
1) Br 2) S 3) I 4) O 5) F
Запишите номера выбранных элементов в определенной последовательности
Ответ:__________
2. Выберите степени окисления, характерные для хлора
1) +2 2) -1 3) + 7 4) + 5 5) -3
Запишите номера правильных ответов
Ответ:__________
3. Строение внешнего энергетического уровня у атомов галогенов можно описать общей формулой
1) ns1 2) ns2np3 3) ns2 4) ns2np1 5) ns2np5
Запишите номер правильного ответа
Ответ:__________
4. Какой вид химической связи характерен для простых веществ галогенов
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
5) водородная
Запишите номер правильного ответа
Ответ:__________
5. Какой вид кристаллической решетки характерен для простых веществ галогенов
1) ионная
2) атомная
3) молекулярная
4) металлическая
Запишите номер правильного ответа
Ответ:__________
6. Соотнесите название вещества и его физические свойства
Название вещества | Свойства вещества |
А) фтор | 1) жидкость бурого цвета с неприятным запахом |
Б) хлор | 2) желто-зеленый газ с резким удушливым запахом |
В) бром | 3) твердое вещество, способное к возгонке |
Г) иод | 4) светло-желтый газ с резким раздражающим запахом |
5) бесцветный газ с резким запахом |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
7. Дана схема превращений:
+ NaBr +H2
Cl2 → X → Y
Определите, какие из указанных веществ будут веществами X и Y
1) хлорид натрия
2) натрий
3) бром
4) хлороводород
5) бромоводород
Ответ:
8. Вычислите объем фтороводорода, который образуется при взаимодействии 2 л водорода и 4 л фтора (н.у.)
1) 2 л 2) 3 л 3) 4 л 4) 6 л 5) 8 л
Запишите номер правильного ответа
Ответ:__________
9. Установите соответствие между уравнением химической реакции и окислительно-восстановительными свойствами хлора в ней
Уравнение реакции | Свойство хлора |
А) Cl2 + H2O → HCl + HClO | 1) является только окислителем |
Б) Cl2 + 2 Na → 2NaCl | 2)является только восстановителем |
В) CaCl2 + 2AgNO3→ Ca(NO3)2 + 2AgCl | 3) является и окислителем и восстановителем |
4) не проявляет окислительно-восстановительных свойств |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
10. Из предложенного списка выбери формулу самой сильной кислоты:
1) HBr 2) HCl 3) HF 4) HI
Запишите номер правильного ответа
Ответ:__________
11. Из предложенного перечня выбери названия веществ, с которыми реагирует плавиковая кислота
1) оксид кремния
2) оксид углерода (IV)
3) гидроксид алюминия
4) хлорид натрия
5) нитрат калия
Запишите номера правильных ответов
Ответ:__________
12. Установите соответствие между веществами и реактивом, с помощью которого их можно различить.
Вещества | Реактив |
А) HCI(p-p) и KCl(p-p) | 1) NaOH(p-p) |
Б) NaCl(p-p) и NaBr(p-p) | 2) AgNO3(p-p) |
В) CaF2(тв) и СаI2(тв) | 3) лакмус |
4) вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
13. В пробирку с гидроксидом меди (II) добавили сильную кислоту Х. Через полученный раствор пропустили электрический ток, в результате реакции на одном из электродов выделился газ Y. Определите вещества Х и Y.
1) сероводородная кислота
2) водород
3) бромовоород
4) хлор
5) соляная кислота
Ответ:
14. Какая масса хлора выделится при взаимодействии 174 граммов оксида марганца(IV) с концентрированной соляной кислотой, если выход хлора равен 90 % от теоретически возможного?
1) 142 г 2) 63,9 г 3) 127,8 г 4) 31,95 г 5) 71 г
Запишите номер правильного ответа
Ответ:__________
15. Установите соответствие между элементом и его биологическим значением
Химический элемент | Биологическая роль |
А) бром | 1) Стимулирует обмен веществ в организме, усиливает рост волос, входит в состав желудочного сока |
Б) хлор | 2) Входит в состав гормона щитовиной железы, регулирует работу мышц |
В) фтор | 3) Входит в состав лекарственных препаратов, применяется для обработка ран и ссадин |
4) Входит в состав зубной эмали и костей скелета |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
Ответы и примерные критерии оценивания
1) 3,1,5
2) 2,3,4 (порядок цифр может быть любой)
3) 5
4) 3
5) 3
6) 4,2,1,3
7) 3,5
8) 3
9) 3,1,4
10) 4
11) 1,3
12) 3,2,4
13) 5,4
14) 3
15) 2,1,4
Вопросы 1-5,8,10,14 оцениваются 1 баллом
Вопросы 6,7,9,11-13,15 оцениваются 2 баллами, в случае ошибки в одном из элементов – 1 баллом
Максимально-22 балла
«5» — 20 — 22 (от 90%)
«4» — 15 — 19 (от 70%)
«3» — 10 – 14 (от 45%)
Природные источники галогенов
Отсутствие d-подуровня у атома фтора является причиной ряда особенностей в физических и химических свойствах этого элемента по сравнению с остальными галогенами. Поскольку в структуре атомов галогенов недостает лишь по обному электрону до устойчивой конфигурации внешнего уровня, то для всех этих элементов характерна валентность I и степень окисления -1. Этим и исчерпываются валентные возможности фтора.
Хлор и другие галогены инеют незаполненный d-подуровень и разъединение спаренных электронов, спопровождающееся образованием новых связей, здесь может быть энергетически выгодным. Поскольку каждое распаривание электронов увеличивает валентность на две единицы, хлор, бром, йод проявляют характерную нечетную валентность I, III, V, VII. Электронная структура хлора в нормальном и возбужденном состояниях:
3s 3p 3s 3p 3d
Cl | ↓↑ | ↑↓ | ↓↑ | ↑ | Cl* | ↑↓ | ↓↑ | ↓ | ↓ | ↓ |
Cl*
↓↑
↓
↓
↓
↓
↓
Cl*
↓
↓
↓
↓
↓
↓
↓
По электронной конфигурации фтор и хлор являются типическими элементами, а бром, йоди и астат относятся к подгруппе брома. Строение внешнего электронного слоя атомов галогенов показывает возможность перехода хлора, брома и астата в возбужденные состояния, отвечающие положительным степеням окисления; этим они отличаются от фтора, который имеет единственную не нулевую степень окисления — -1.
Подобно оксидам, фториды подразделяют на основные, кислотные и амфотерные. Причем, кислотными являются фториды IVа – VIIа групп ПСЭ. Они реагируют с основными фторидами:
2NaF + SiF4 = Na2[SiF6]
Атомы этой группы энергично присоединяют недостающий электрон, проявляя степень окисления -1, валентность I-VII. С повышением порядкового номера элементов в ряду F – Cl – Br – I увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства и окислительная способность элементов (табл. 25.).
Таблица 25
Атомные характеристики элементов
Элемент | F | Cl | Br | I |
Массовое число | 18,9984 | 53,4527 | 79,904 | 126,9045 |
Порядковый номер | 9 | 17 | 35 | 53 |
Ковалентный радиус, нм | 0,073 | 0,099 | 0,114 | 0,133 |
Ионный радиус, нм -1 +7 | 0,133 | 0,181 0,027 | 0,196 0,039 | 0,220 0,053 |
Энергия ионизации, эВ | 17,42 | 12,07 | 11,84 | 10,45 |
Сродство атома к электрону, эВ | 3,45 | 3,61 | 3,37 | 3,08 |
Электро-отрицательность | 4,0 | 2,83 | 2,74 | 2,21 |
Степень окисления | -1 | -1, +1, +3, +4, +5, +6, +7 | -1, +1, +3, +5, +7 | -1, +1, +4, +5, +7 |
Это типичные, очень активные неметаллы. С увеличением радиуса, уменьшаются неметаллические свойства. Наиболее активным галогеном является фтор, а наименее активным – астат.
Фтор получают электролизом расплавленного гидрофторида калия (KHF2) в плавиковой кислоте — HF (жидком фтористом водороле), часто с добавкой фторида лития.
Хлор получают окислением соляной кислоты или ее солей различными окислителями (MnO2, KMnO4, K2Cr2O7):
MnO2 + 4HCl = MnCl2 + Cl2↑ + H2O
MnO2 + 2NaCl + 2H2SO4 = MnSO4 + Na2SO4 + Cl2↑ + 2H2O
В промышленности хлор получают электролизом растворов или расплавов NaCl:
2NaCl + 2H2O = 2NaOH + H2 + Cl2↑
Подобно хлору, бром и йод получают при взаимодействии HBr и HI (а также бромидов или йодидов в кислой среде) с теми же окислителями. Йод и бром могут быть получены действием хлора на их соли:
2HBr + Cl2 = 2HCl + Br2
2HI + Cl2 = 2HCl + I2
Таким образом, в основе получения галогенов лежит окислительно-восстановительный процесс.
Физико-химические свойства простых веществ представлены в табл. 26.
Таблица 26
Список галогенов (групп элементов)
Галогенные элементы расположены в группе 17 или VIIA периодической таблицы, которая является предпоследним столбцом таблицы. Это список элементов, которые принадлежат к группе галогенов, и обзор общих свойств.
Ключевые выводы: галогены
- Галогены — элементы 17-й группы периодической таблицы Менделеева. Это предпоследний столбец элементов в правой части таблицы.
- Элементами галогена являются фтор, хлор, бром, йод, астат и, возможно, теннессин.
- Галогены — неметаллические элементы с высокой реакционной способностью. Обычно они образуют ионные связи с металлами и ковалентные связи с другими неметаллами.
- Галогены — единственная группа элементов, которая включает элементы во всех трех основных состояниях материи: газах, жидкостях и твердых телах.
Список галогенов
В зависимости от того, кого вы спросите, галогенов бывает 5 или 6.Фтор, хлор, бром, йод и астат определенно являются галогенами. Элемент 117, tennessine, может иметь некоторые общие свойства с другими элементами. Несмотря на то, что он находится в том же столбце или группе периодической таблицы, что и другие галогены, большинство ученых считают, что элемент 117 ведет себя больше как металлоид. Произведено так мало, что это вопрос прогнозов, а не эмпирических данных.
Свойства галогена
Эти элементы обладают некоторыми общими свойствами, которые отличают их от других элементов периодической таблицы.
- Это высокореакционные неметаллы.
- Атомы, принадлежащие к группе галогенов, имеют 7 электронов во внешней (валентной) оболочке. Этим атомам нужен еще один электрон, чтобы иметь стабильный октет.
- Обычная степень окисления атома галогена -1.
- Галогены обладают высокой электроотрицательностью и сродством к электрону.
- Точки плавления и кипения галогенов увеличиваются при увеличении атомного номера (при перемещении вниз по таблице Менделеева).
- Элементы изменяют свое материальное состояние при комнатной температуре и давлении, когда вы увеличиваете атомный номер. Фтор и хлор — газы. Бром — жидкий элемент. Йод — твердое вещество. Ученые предсказывают, что теннессин остается твердым веществом при комнатной температуре.
- Галогены цветные, даже как газы. Фтор — самый бледный элемент, но даже в виде газа он имеет отчетливый желтый цвет.
Более пристальный взгляд на элементы
- Фтор имеет атомный номер 9 с символом элемента F.При комнатной температуре и давлении чистый фтор представляет собой бледно-желтоватый газ. Но этот элемент настолько реактивен, что в основном встречается в соединениях.
- Хлор имеет атомный номер 17 с символом элемента Cl. В обычных условиях хлор представляет собой газ желтовато-зеленого цвета.
- Бром — элемент 35 с символом Br. Это жидкость при комнатной температуре и давлении.
- Йод — это элемент 53 с символом I. В обычных условиях он является твердым телом.
- Астатин — атомный номер 85 с символом At.Это самый редкий природный элемент земной коры. Астатин — радиоактивный элемент без стабильных изотопов.
- Tennessine — это элемент 117 с символом Ts. Это синтетический радиоактивный элемент.
Использует галоген
Более легкие галогены встречаются в живых организмах. Это фтор, хлор, бром и йод. Из них хлор и йод необходимы для питания человека, хотя другие элементы также могут потребоваться в следовых количествах.
Галогены — важные дезинфицирующие средства. Хлор и бром используются для дезинфекции воды и поверхностей. Их высокая реакционная способность также делает эти элементы важными компонентами некоторых типов отбеливателей. Галогены используются в лампах накаливания, чтобы они светились при более высокой температуре и имели белый цвет. Галогеновые элементы являются важными компонентами лекарства, поскольку они способствуют проникновению лекарства в ткани.
Источники
- Бончев, Данаил; Каменская, Вергиния (1981).«Прогнозирование свойств 113–120 трансактинидных элементов». Журнал физической химии . 85 (9): 1177–86. DOI: 10.1021 / j150609a021
- Эмсли, Джон (2011). Строительные блоки природы . ISBN 978-0199605637.
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Лиде, Д. Р., изд. (2003). CRC Справочник по химии и физике (84-е изд.). Бока-Ратон, Флорида: CRC Press.
- Morss, Lester R .; Эдельштейн, Норман М .; Фугер, Жан (2006). Морсс, Лестер Р.; Эдельштейн, Норман М; Фугер, Жан (ред.). Химия элементов актинидов и трансактинидов . Дордрехт, Нидерланды: Springer Science + Business Media. DOI: 10.1007 / 978-94-007-0211-0. ISBN 978-94-007-0210-3.
галогенов | Химия для неосновных
Цели обучения
- Назовите галогены.
- Опишите физические свойства галогенов.
- Опишите химические свойства галогенов.
Как вы изучаете газ, которого нет в природе как таковой?
Это не так просто, как вы думаете. Фтор настолько реактивен, что мы не можем найти его свободным в природе. Ни один из галогенов не существует в природе в свободном виде (в отличие от некоторых металлов, таких как золото и серебро), потому что они очень реактивны. На видео ниже показано, как элементарный фтор бурно реагирует с другими материалами.
Некоторые элементы гораздо более реактивны, чем другие. Элементы Группы I (красный) и Группы II (желтовато-коричневый) могут легко терять электроны во время реакции. Элементы других групп с гораздо большей вероятностью будут принимать электроны в процессе реакции.
Элементы группы VIIA (новая группа 17 — фтор, хлор, бром, йод и астат) называются галогенами (желто-коричневый столбец). Термин «галоген» означает «солеобразователь», потому что эти элементы будут легко реагировать с щелочными и щелочноземельными металлами с образованием галогенидных солей.Все галогены имеют общую электронную конфигурацию нс 2 np 5 , что дает им семь валентных электронов. Им на один электрон не хватает полного внешнего подуровня s и p , что делает их очень реактивными.
Физические свойства галогенов
В качестве элементов хлор и фтор являются газами при комнатной температуре, бром — темно-оранжевой жидкостью, а йод — темно-пурпурно-серым твердым веществом.Астатин настолько редок, что его свойства в основном неизвестны. На рисунке 1 мы видим газообразный хлор слева (зеленый), твердый бром и пар в середине (оранжевый) и твердый йод (серый) справа. Фтор не показан на рисунке ниже, потому что он слишком агрессивен и разрушит стеклянную емкость.
Рисунок 1. Галогены
Рис. 2. Большое Соленое озеро
Ни один из этих элементов не встречается в природе в свободном виде из-за их реакционной способности. Фтор в сочетании с катионами содержится в нескольких минералах.Хлор содержится в поваренной соли, в океанах (которые содержат около 2% хлорид-иона по весу) и в таких озерах, как Большое Соленое озеро в штате Юта. Небольшие количества бромидных и йодистых солей можно найти в океанах и в колодцах с рассолом в нескольких штатах.
Посмотрите следующие два видео эксперимента с блочными элементами p :
Это первое видео о реакции брома с алюминием.
На втором видео показаны реакции галогенов.
Сводка
- Все галогены имеют семь электронов на внешних оболочках.
- Конфигурация электронов на внешней оболочке нс 2 np 5 .
- С увеличением атомного номера реакционная способность галогенов снижается.
- Фтор и хлор существуют в виде газов при комнатной температуре, бром — в жидком состоянии, а йод — в твердом состоянии.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch20/group7.php
- Являются ли галогенные элементы одноатомными или двухатомными молекулами?
- Почему мы мало знаем об астате?
- Опишите реакционную способность элементарного фтора.
- Перечислите одно применение для соединений фтора, хлора, брома и йода.
Обзор
- Перечислите галогены по названию, химическому символу и атомному весу.
- Что означает термин «галоген»?
- Какова электронная конфигурация внешней оболочки галогенов?
- Каково физическое состояние каждого галогена при комнатной температуре?
- Где находятся галогены?
Глоссарий
- галоген: Термин «галоген» означает «солеобразователь», потому что эти элементы легко реагируют с щелочными и щелочноземельными металлами с образованием галогенидных солей.Эти элементы можно найти в группе VII периодической таблицы.
Список литературы
- Пользователь: Cepheus / Wikimedia Commons, изменено Фондом CK-12. Периодическая таблица .
- Хлор: Пользователь: Greenhorn1 / Wikimedia Commons Бром: Пользователь: Tomihahndorf / De.Wikipedia; Йод: Бен Миллс (Викимедиа: Benjah-bmm27). Образцы галогенов.
- Предоставлено НАСА. Большое Соленое озеро.
галогенов — Таблица Менделеева | ChemTalk
Что такое галогены
Галогены, также известные как семейство галогенов, представляют собой группу реактивных элементов в группе 17 периодической таблицы, справа от халькогенов и слева от благородных газов.Фтор и хлор — это «детище галогенов». Это неметаллы, состоящие из двухатомных молекул.
Галоген означает «солеобразующий». Они производят соли, потому что, когда они реагируют с металлами (часто бурно), они производят ионные соединения, известные как соли. В 1811 году Джон Швайггер хотел назвать элемент хлор «галогеном», но ему это не удалось. В 1826 году шведский химик Йонс Берцелиус ввел термин галоген для обозначения всей группы элементов. Греческое слово «хал», означающее соль, также встречается в названии минерала галита, также известного как хлорид натрия.
Свойства галогенов
Галогены обладают высокой реакционной способностью и высокой токсичностью. Вдыхание паров любого из галогенов очень опасно, и они имеют характерный неприятный запах (хотя автор находит легкий запах брома странно интересным).
Фтор является наиболее химически активным из всех элементов и может храниться только в металлах, которые образуют пассивирующие слои фторидной соли. Эти уникальные свойства обусловлены наличием 7 электронов в их валентной оболочке.Из-за их реакционной способности они почти никогда не встречаются в природе в их элементарной форме.
При движении вниз по столбцу атомный радиус галогенов увеличивается, поскольку они добавляют дополнительные электронные оболочки. В элементарном состоянии они образуют двухатомные молекулы, соединенные неполярными ковалентными связями. Связь фтор-фтор самая слабая.
Точки кипения также увеличиваются из-за увеличения сил Ван-дер-Ваальса. Итак, фтор — это газ, а йод — твердое вещество. Это единственная группа в периодической таблице, которая имеет элементы в твердой, жидкой и газовой фазах при комнатной температуре.Все галогены имеют высокую электроотрицательность, но она уменьшается по мере движения вниз по столбцу. Фактически, фтор имеет самую высокую электроотрицательность из всех элементов.
Энергия ионизации также уменьшается при движении вниз, что облегчает образование более высоких степеней окисления. Первая энергия ионизации фтора настолько высока, что он не проявляет никаких положительных степеней окисления.
Все галогены имеют интересный цвет, который может меняться в зависимости от среды или того, в чем он растворен, см. Подробное объяснение здесь.
Список всех галогенов
Семейство галогенов включает фтор, хлор, бром, йод, астат и теннессин, элемент 117 — элемент, который был обнаружен совсем недавно. В этой статье мы сосредоточимся только на первых четырех галогенах.
Химия галогенов
Галогены бурно реагируют с щелочными металлами, щелочноземельными металлами и алюминием, особенно когда имеется большая площадь поверхности металла. Они также образуют такие анионы, как ионы гипохлорита, хлората, перхлората и бромата, которые являются очень сильными окислителями.Фтор обычно встречается в минералах, таких как флюорит, CaF 2 . Галогены также образуют множество различных межгалогенных соединений, например IF 7 , фторид йода (VII).
Почему они такие реактивные?
Галогены настолько реактивны, потому что они имеют 7 валентных электронов и очень близки к полной оболочке из 8 электронов. Галогены оторвут электрон от другого атома, чтобы достичь очень стабильного состояния 8 электронов на своей внешней оболочке.
Интересный факт о галогенах
- Многие фториды редкоземельных элементов нерастворимы в воде
- Студенты узнают, что хлорид серебра (I) нерастворим, но большинство людей не знают, что хлорид меди (I) также нерастворим в воде
- Бромид и бромат-ионы являются ключевыми ионами в знаменитой и красивой колебательной реакции, известной как реакция Белоусова-Жаботинского.
- Иодат-ионы играют ключевую роль во многих «часовых» реакциях, используемых для химических демонстраций
- Астатин — самый редкий элемент, который встречается естественно в земной коре.Образец чистого астата никогда не собирался. Все изотопы радиоактивны и короткоживущие.
- Хотя фтористоводородная кислота, HF, является слабой кислотой, это одна из самых опасных кислот. Он не только повреждает тело снаружи, но и может всасываться через кожу, проникая глубоко в ткани, вызывая серьезные системные травмы.
- Газообразный хлор убил тысячи солдат во время Первой мировой войны в 1915 году, когда использовался в качестве химического оружия. Хорошо, это не очень забавный факт.
- Йод возгоняется прямо из твердого тела в газ. Он также перейдет в жидкое состояние при 114 ° C, если его осторожно нагреть в не слишком «открытом» сосуде.
- Ион гипохлорита, ClO — , является активным ингредиентом отбеливателя.
Дополнительная литература
Щелочные металлы
Щелочноземельные металлы
Переходные металлы
Галогены Характеристики | Sciencing
Галогены — это химические элементы, которые составляют группу 17 периодической таблицы.
Шесть неметаллических элементов: фтор (F), хлор (Cl), бром (Br), йод (I), астат (As) и теннессин (Ts). Название «галоген» происходит от греческого слова, означающего «солеобразование», поскольку фтор, хлор и йод производят вещество, подобное морской соли, когда они образуют соединение с щелочным металлом.
Характеристики галогенов аналогичны во всех химических рядах, хотя наблюдается постепенное изменение свойств от фтора через хлор, бром, йод к астату.Фактически, фтор является наиболее реактивным элементом в семействе галогенов, проявляя определенные свойства, отличные от других галогенов в том же семействе.
Газообразный хлор (Cl 2 ) широко используется для очистки воды, а хлорид натрия — это обычная поваренная соль, которую вы используете каждый день. Фториды широко используются в зубных пастах для предотвращения разрушения зубов, в то время как органические фториды служат хладагентами и смазками. Соединения брома также используются в пестицидах, а йод (I 2 ) — хорошо известный антисептик.
Атомные характеристики Галогенов
••• адаптированы из chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Modules_and_Websites_(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/2_p-Block_Elements/Group_17%3A_The_Halogens/0Group_17%3A_Physical_Properties_of_the_Halogens
Семейства галогенного занимает Группу 17 (группа VII или VIIA) периодической таблицы, а номер группы обозначает количество валентных электронов. Галогены имеют семь валентных электронов в своей внешней оболочке, которые могут получать электрон от другого атома, чтобы удовлетворить правилу октетов и, таким образом, образовывать стабильные соединения.Из-за их высокой реакционной способности галогены встречаются в природе не как свободные элементы, а как двухатомные молекулы , например Cl 2 и I 2 .
Спускаясь вниз по строкам в периодической таблице, уровень энергии , поднимается, но не электронная конфигурация на самом высоком уровне. Валентная электронная конфигурация фтора — 2s 2 2p 5 , а у йода — 5s 2 5p 5 . Число слоев электронов вокруг ядра также увеличивается от фтора до хлора, от брома до йода.В результате атомный радиус увеличивается, поскольку большее количество слоев занимает больше места из-за отталкивания электронов.
Электроотрицательность — это мера способности атома притягивать к себе электроны. Обычно его измеряют по шкале Полинга, а значения определяют экспериментально. Фтор имеет самую высокую электроотрицательность 3,98 среди галогенов, и электроотрицательность уменьшается вниз по группе. Энергия ионизации — это количество энергии, необходимое для удаления электрона из атома.Чем электроотрицательнее элемент, тем выше энергия ионизации. Таким образом, фтор имеет самую высокую энергию ионизации среди галогенов.
Физические характеристики галогенов
••• По материалам chem.libretexts. (273.15 K или 0 ° C) и давлении (10 5 Па или 1 бар) фтор и хлор являются газами, бром — жидкостью, а йод — твердым веществом. Как правило, точки плавления и кипения повышаются по группе галогенов. Поскольку галогены существуют в виде двухатомных молекул, дисперсионные силы Ван-дер-Ваальса являются основными межмолекулярными силами между молекулами.
Эти силы более заметны в более крупных молекулах, поскольку вокруг ядра движется больше электронов, образуя временные диполи, которые создают силы Ван-дер-Ваальса.
Фтор бурно реагирует с водой с образованием фтороводорода, кислорода и озона. Хлор слегка растворяется в воде, образуя бледно-желтый раствор. Водный раствор брома принимает цвет от желтого до красновато-коричневого в зависимости от концентрации. Раствор йода бледно-коричневый, хотя твердое вещество и газ имеют кристаллический черный и фиолетовый цвет.
Химические свойства галогенов
Галогены — сильные окислители . Поскольку галогены имеют семь электронов в валентных оболочках, они имеют тенденцию отбирать электроны у других молекул и, таким образом, окислять их.Эта окислительная способность снижается по группе галогенов, причем фтор является самым сильным окислителем.
Окисляющая способность: F 2 > Cl 2 > Br 2 > I 2 > At 2
Например, фтор может окислять воду до кислорода и может заменять любые галогенид-ионы из его соединения, как показано в следующих уравнениях. Однако хлор может отбирать электроны только у ионов бромида, йодида и астатида, а бром — только у ионов йодида и астатида.
F 2 + 2Cl — → 2F — + Cl 2
F 2 + 2Br — → 2F — + Br 2
F60 + 2
F — → 2F — + I 2
F 2 + 2At — → 2F — + At 2
Для галогенид-ионов фторид-ион не проявляет восстанавливающих свойств, а иодид-ион является мягким восстановителем .Тенденция к снижению способности увеличивается от фторида к йодиду. Это демонстрируется в реакции йодида с концентрированной серной кислотой, в которой йодид восстанавливает серную кислоту в три стадии.
H 2 SO 4 → SO 2 → S → H 2 S
Степень окисления серы: +6 → +4 → 0 → -2
Степень окисления серы снижается с + От 6 в серной кислоте до -2 в сероводороде. Эта реакция является экзотермической и выделяет в качестве основных продуктов йод (пурпурный пар) и сероводород (запах «тухлого яйца»).
H 2 SO 4 + 8H + + 8I — → 4I 2 + H 2 S + 4H 2 O
Галогены также образуют соединения с водородом в виде галогенидов водорода . . Связь водород-галоген уменьшается от фторида к иодиду, и молекулы галогенида водорода образуют водородные связи друг с другом зигзагообразным образом. Кислотность соответствующей кислоты, когда галогенводород растворяется в воде, увеличивается от плавиковой кислоты до иодистоводородной кислоты.Бромистоводородная и йодистоводородная кислота являются сильными кислотами. Хотя фтористоводородная кислота является только слабой кислотой, по силе она аналогична органическим кислотам, таким как муравьиная кислота.
Применение галогенов
Фтор используется для получения различных фторидов. При растворении фтороводорода в воде образуется плавиковая кислота (HF). Несмотря на то, что они являются слабой кислотой, фторид-анионы в плавиковой кислоте могут образовывать прочную связь с молекулами кремния в стекле.
Плавиковая кислота поэтому широко используется в промышленности для матирования и травления стекла .Он также действует как средство для травления металлов и травление, удаляя оксиды и другие примеси из нержавеющей стали. Однако фтористоводородная кислота чрезвычайно агрессивна и может вызвать отравление и повреждение костей из-за воздействия на кожу или глаза.
В начале 20 века высокая концентрация фтора в питьевой воде была связана с гораздо меньшим распространением кариеса. Хотя использование фторида в питьевой воде для улучшения общего состояния зубов было спорным, фторид тем временем приобрел популярность в зубных пастах .
Компания Colgate представила «фторид олова» в 1955 году. Сегодня существует три типа фторидов, одобренных FDA для предотвращения кариеса: фторид олова, фторид натрия и монофторфосфат натрия.
Элементарный фтор также может реагировать с углеводородами с образованием фторуглеродов, в которых водород частично или полностью заменен фтором, что приводит к соединениям, которые обладают превосходными физическими и химическими свойствами, такими как химическая инертность и высокое электрическое сопротивление.
Политетрафторэтилен ((CF 2 CF 2 ) x , известный как PTFE или Teflon ) изготовлен из ненасыщенных фторуглеродов и обеспечивает антипригарную поверхность для посуды. Хлорфторуглероды (CFCs), такие как дихлордифторметан (Cl 2 CF 2 ), широко используются в качестве хладагентов в домашних условиях, но они играют активную роль в истощении озонового слоя. Его производство было запрещено в 1996 году Монреальским протоколом, и гидрохлорфторуглерод (ГХФУ) были использованы в качестве заменителей.
Фтор также используется в дизайне и разработке лекарств как средство усиления биологической активности и повышения химической или метаболической стабильности. Флуоксетин, который является антидепрессантом из класса селективных ингибиторов обратного захвата серотонина (SSRI), является таким примером с трифторметильной группой в молекуле.
Газообразный хлор (Cl 2 ) использовался во время Первой мировой войны в качестве химического оружия , поскольку он сильно раздражает дыхательную систему.Его раствор использовали в качестве дезинфицирующего средства для борьбы с эпидемией холеры, охватившей Европу в 1831 году.
Хлорид натрия (NaCl) или поваренная соль — одна из самых распространенных приправ. Он не только удовлетворяет наши кулинарные потребности, но и обеспечивает необходимые питательные вещества для обмена веществ. Хлор участвует в производстве соляной кислоты в желудке, а также играет важную роль в работе клеточного насоса. Слишком мало хлоридов в рационе может привести к нарушениям электролитного баланса, таким как гипохлоремия.
Еще одно известное применение хлора — отбеливатель для дезинфекции и санитарной обработки. Активным ингредиентом обесцвечивающего порошка (Ca (OCl) 2 ∙ CaCl 2 ∙ Ca (OH) 2 ∙ 2H 2 O) является гипохлорит кальция (Ca (OCl) 2 ), и он имеет использовался для дезинфекции бассейнов.
Хлор может реагировать с монооксидом углерода с образованием карбонилхлорида (COCl 2 ) или фосгена , который используется для синтеза изоцианатов и полиуретанов и в металлургии для преобразования оксидов в хлориды.Хлор также реагирует с диоксидом серы с образованием тионилхлорида (SO 2 Cl 2 ), который является обычным хлорирующим реагентом в органическом синтезе и используется при вулканизации резины.
Хлор также часто встречается в органических соединениях, таких как поливинилхлорид ( PVC ) и дихлордифенилтрихлорэтан ( DDT ). Он имеет большое значение в химической, материальной и фармацевтической промышленности.
Самый ранний вид брома — тирский пурпур, пурпурный краситель, сделанный финикийцами из моллюсков мурексов.Бром по-прежнему используется в красителях , таких как бромированные производные антрахинона.
Одно время дибромид этилена (C 2 H 4 Br 2 ) широко использовался в нефтяной промышленности . Его добавляли в бензин, чтобы предотвратить отложение свинца в двигателе. Однако в 1970-х годах использование этилированного бензина было прекращено. Дибромид этилена до сих пор используется в качестве пестицида для уничтожения нематод и вредителей в почвах.
В начале 20 века бромиды калия, натрия и кальция применялись в медицине как седативные средства .Бромированные антипирены (BRF) могут снизить воспламеняемость продуктов, содержащих их, таких как протекторы или крышки для электроприборов. Подобно хлориду и йодиду серебра, которые чувствительны к свету, бромид серебра (AgBr) является важным компонентом фотопленки.
Самым известным применением йода является его важность в рационе человека. В щитовидной железе йод превращается в тироксин , который является гормоном, необходимым для обмена веществ. Дефицит йода часто приводит к зобу (увеличению щитовидной железы) или микседему.Йодид калия (KI) часто добавляют в поваренную соль для защиты от этого дефицита. Йод также можно добавлять, употребляя богатые йодом пищевые продукты, такие как морские водоросли.
Йод широко используется как дезинфицирующее и антисептическое средство, часто в виде раствора йодида калия. Йод также используется в ранней фотографии . : В процессе дагерротипирования используются серебряные пластины, сенсибилизированные газообразным йодом. Соединения йода широко используются в химическом анализе .
Йодометрия измеряет высвобождение или поглощение йодной основы при титровании йода тиосульфатом натрия.Соединения йода также используются в качестве катализаторов для определенных органических реакций .
Элемент Инфографика — Группа 7 — Сложные проценты
На этом рисунке показаны галогены, обнаруженные в группе 7 Периодической таблицы. Эта группа состоит из элементов фтора, хлора, брома, йода и астата — еще не названный искусственный элемент 117, унунпентий, также может быть галогеном. Как всегда, ниже приведены несколько интересных фрагментов информации, которые слишком длинные, чтобы уместиться в самом графике.
Астатин раньше считался самым редким элементом на Земле, но в последнее время он был узурпирован на этих кольях Берклием, который может производиться в месторождениях урана с высокой концентрацией в результате радиоактивного распада. Тем не менее, он по-прежнему сохраняет титул самого редкого нетрансуранового элемента (то есть из всех элементов, включая уран). В качестве отказа от ответственности, хотя на графике указано, что астат не образует двухатомных молекул, точнее будет сказать, что еще предстоит доказать, так или иначе, существует ли двухатомный астат на самом деле.
В качестве еще одного заявления об отказе от ответственности, реакционная способность галогенов, уменьшающаяся по группе, на самом деле не связана с тем фактом, что становится все труднее добавить электрон. Тем не менее, это объяснение, предлагаемое большинством экзаменационных комиссий до уровня A в Англии, поэтому, несмотря на то, что это технически неточное объяснение, именно оно попадает на график.
Если вам нужна дополнительная информация о фтористоводородной кислоте, вы можете прочитать отличную публикацию The Chronicle Flask о ней и связанных с ней опасностях здесь.Короче говоря: на самом деле не проливайте на себя. На самом деле это не такая сильная кислота, как некоторые более распространенные кислоты, такие как соляная кислота или серная кислота, но справедливо сказать, что она намного неприятнее.
Как всегда, вы можете скачать PDF-файл с высоким разрешением, щелкнув здесь. Инфографика для других групп периодической таблицы также может быть загружена через раздел инфографики на сайте.
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 Международная лицензия. См. Рекомендации по использованию содержания сайта.
Как элементы сгруппированы в Периодической таблице?
В конце 19 века русский химик Дмитрий Менделеев опубликовал свою первую попытку сгруппировать химические элементы по их атомному весу. В то время было известно только около 60 элементов, но Менделеев понимал, что, когда элементы были организованы по весу, определенные типы элементов возникали через равные промежутки времени или периоды.
Сегодня, 150 лет спустя, химики официально признают 118 элементов (после добавления четырех новичков в 2016 году) и до сих пор используют периодическую таблицу элементов Менделеева для их организации.Таблица начинается с простейшего атома, водорода, а затем сгруппированы остальные элементы по атомному номеру, который представляет собой количество протонов, содержащихся в каждом. За некоторыми исключениями порядок элементов соответствует увеличению массы каждого атома.
В таблице семь строк и 18 столбцов. Каждая строка представляет один период; номер периода элемента показывает, сколько из его энергетических уровней содержат электроны. Например, натрий находится в третьем периоде, что означает, что атом натрия обычно имеет электроны на первых трех энергетических уровнях.Двигаясь вниз по таблице, периоды становятся длиннее, потому что для заполнения более крупных и сложных внешних уровней требуется больше электронов.
Столбцы таблицы представляют группы или семейства элементов. Элементы в группе часто выглядят и ведут себя одинаково, потому что у них одинаковое количество электронов во внешней оболочке — лице, которое они показывают миру. Элементы группы 18, например, в крайней правой части таблицы, имеют полностью сплошные внешние оболочки и редко участвуют в химических реакциях.
Элементы обычно классифицируются как металлические или неметаллические, но разделительная линия между ними нечеткая. Металлические элементы обычно являются хорошими проводниками электричества и тепла. Подгруппы металлов основаны на схожих характеристиках и химических свойствах этих коллекций. Согласно данным Лос-Аламосской национальной лаборатории, в нашем описании периодической таблицы элементов используются общепринятые группы элементов.
Щелочные металлы: Щелочные металлы составляют большую часть группы 1, первого столбца таблицы.Эти блестящие и достаточно мягкие, чтобы разрезать ножом, эти металлы начинаются с лития (Li) и заканчиваются францием (Fr). Они также чрезвычайно реактивны и воспламеняются или даже взрываются при контакте с водой, поэтому химики хранят их в маслах или инертных газах. Водород с одним электроном также находится в группе 1, но газ считается неметаллом.
Щелочноземельные металлы: Щелочноземельные металлы составляют группу 2 периодической таблицы, от бериллия (Be) до радия (Ra).Каждый из этих элементов имеет два электрона на внешнем энергетическом уровне, что делает щелочноземельные земли достаточно реактивными, чтобы их редко можно было найти в одиночку в природе. Но они не так реактивны, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Lanthanides: Третья группа слишком длинна, чтобы поместиться в третий столбец, поэтому она вырывается и переворачивается в сторону, чтобы стать верхней строкой острова, плавающего в нижней части таблицы.Это лантаноиды, элементы с 57 по 71 — от лантана (La) до лютеция (Lu). Элементы этой группы имеют серебристо-белый цвет и тускнеют при контакте с воздухом.
Актиниды: Актиниды выстилают нижний ряд острова и включают элементы от 89, актиний (Ac) до 103, лоуренсий (Lr). Из этих элементов только торий (Th) и уран (U) встречаются на Земле в значительных количествах. Все радиоактивны. Актиниды и лантаноиды вместе образуют группу, называемую внутренними переходными металлами.
Переходные металлы: Возвращаясь к основной части таблицы, остатки групп с 3 по 12 представляют собой остальные переходные металлы. Твердые, но податливые, блестящие и обладающие хорошей проводимостью, эти элементы — это то, о чем вы обычно думаете, когда слышите слово «металл». Здесь живут многие из лучших хитов металлического мира, включая золото, серебро, железо и платину.
Металлы после перехода: Перед прыжком в мир неметаллов общие характеристики не разделены аккуратно по вертикальным групповым линиям.Постпереходными металлами являются алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi), и они охватывают группы с 13 по 17. Эти элементы обладают некоторыми из классических характеристик переходных металлов, но они, как правило, более мягкие и проводят хуже, чем другие переходные металлы. Во многих периодических таблицах жирным шрифтом будет выделена линия «лестницы» под диагональю, соединяющей бор с астатом. Металлы постпереходного типа расположены в нижнем левом углу этой линии.
Металлоиды: Металлоиды: бор (B), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Te) и полоний (Po). Они образуют лестницу, символизирующую постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Неметаллы: Все остальное в правом верхнем углу лестницы — плюс водород (H), скрученный назад в Группе 1 — является неметаллом.К ним относятся углерод (C), азот (N), фосфор (P), кислород (O), сера (S) и селен (Se).
Галогены: Четыре верхних элемента Группы 17, от фтора (F) до астата (At), представляют собой одно из двух подмножеств неметаллов. Галогены довольно химически реактивны и имеют тенденцию образовывать пары со щелочными металлами с образованием различных типов солей. Например, поваренная соль на вашей кухне — это смесь щелочного металла натрия и галогенового хлора.
Благородные газы: Бесцветные, без запаха и почти полностью инертные, инертные или инертные газы завершают таблицу в группе 18.Многие химики ожидают, что оганессон, один из четырех недавно названных элементов, будет обладать этими характеристиками; однако, поскольку этот элемент имеет период полураспада, измеряемый в миллисекундах, никто не смог проверить его напрямую. Оганессон завершает седьмой период периодической таблицы, поэтому, если кому-то удастся синтезировать элемент 119 (а гонка за это уже ведется), он перейдет в цикл, чтобы начать восьмую строку в столбце щелочного металла.
Из-за цикличности, создаваемой периодичностью, дающей название таблице, некоторые химики предпочитают визуализировать таблицу Менделеева в виде круга.
Дополнительные ресурсы :
Фтор, хлор, бром, йод, астатин
Пять элементов; Фтор (F), хлор (Cl), бром (Br), йод (I) и астатин (At), принадлежащие к группе VII A современной таблицы Менделеева, вместе называются галогенами. Последний элемент, астатин, радиоактивен и очень недолговечен, поэтому его обычно исключают из исследования.
Слово галоген происходит от греческих слов Halos (морская соль) и Genes (производитель).Поскольку бинарные соединения галогена являются наиболее распространенными растворимыми солями, обнаруженными в море. Таким образом, галоген означает производителей соли.
Электронная конфигурация галогенов:
Sr. No. | Элементы | Атомный № | Электронная конфигурация | Конфигурация валентной оболочки |
1 | Фтор (F) | 9 | 2, 7 | 2s 2 2p 5 |
2 | Хлор (Cl) | 17 | 2, 8, 7 | 3-пол. 2 3-пол. 5 |
3 | Бром (Br) | 35 | 2, 8,18, 7 | 4s 2 4p 5 |
4 | Йод (I) | 53 | 2, 8, 18, 8, 7 | 5с 2 5 пол 5 |
5 | Астатин (Ат) | 85 | 2, 8, 18, 32, 18, 7 | 6с 2 6 пол 5 |
Характеристика электронной конфигурации галогенов:
- Все галогены содержат семь электронов на своей внешней оболочке.Все остальные оболочки полностью заполнены. Они имеют характерную конфигурацию внешней орбиты ns2 np5.
- Последний электрон во время конфигурации занимает p-орбиталь, следовательно, эти элементы являются p блочными элементами.
- Все орбиты, кроме последней, полностью заполнены. Следовательно, они нормальные элементы.
- Все галогены содержат семь электронов на своей внешней оболочке. Следовательно, они хранятся в группе VII-A (17) периодической таблицы Менделеева перед инертными газами.
- Во внешней оболочке семь электронов.Таким образом, для заполнения октета этим элементам требуется только один электрон.
Свойства галогенов:
Моновалентность галогенов:
Все галогены имеют корпус электронной конфигурации ns2 np5. Они содержат семь электронов в валентной оболочке. Им нужен один электрон для завершения своего октета. Они достигают октета, либо принимая электрон с образованием одновалентного аниона, X-, (F-, Cl-, Br- и I-), разделяя неспаренный электрон с неспаренным электроном другого атома с образованием ковалентной связи (как в Cl2, Br2, HCl, HF и т. д.).Следовательно, общая валентность семейства галогенов равна 1. Следовательно, они одновалентны.
Атомный радиус:
Атомный и ионный радиус — это расстояние от центра ядра до внешней оболочки атома или иона. При переходе от фтора к йоду атомный радиус увеличивается по следующим причинам.
Тренд: По мере спуска в группе атомный радиус увеличивается от фтора к йоду.
Пояснение: Спускаемся в группе
- Увеличивается атомный номер и номер оболочки.
- Эффективный ядерный заряд уменьшается.
- Эффект экранирования увеличивается.
Следует отметить, что каждый ион больше по размеру, чем соответствующий атом.
Степень окисления:
Характерная электронная конфигурация галогенов ns2 np5. Следовательно, они стремятся получить один электрон, чтобы сформировать стабильную электронную конфигурацию ближайшего атома благородного газа и проявлять — 1 однородную степень окисления.
Хлор, бром и йод имеют пустую n-‘d ’орбиталь.Эти элементы при объединении с более электроотрицательным элементом их электроны с n-й орбиты продвигаются на n-‘d ’орбиталь. Следовательно, они могут показывать положительные состояния окисления, такие как +1, +3, +5 и +7.
Фтор имеет только -1 степень окисления из-за отсутствия вакантных n-’d ’орбиталей.
Фтор имеет только -1 степень окисления:
Фтор является наиболее электроотрицательным элементом, имеющим наивысшую электроотрицательность 4. Он не имеет «d» -орбиталей в своей валентной оболочке. Таким образом, он не может расширить октет.Следовательно, фтор имеет только -1 степень окисления.
Потенциал ионизации (I.P.) или энтальпия ионизации:
Энергия, необходимая для удаления самого удаленного электрона из газообразного атома элемента, когда он находится в основном состоянии, называется потенциалом ионизации или энтальпией ионизации.
Поскольку атомные радиусы галогенов наименьшие в соответствующий период, их потенциалы ионизации очень высоки. У них нет тенденции терять электрон.
Среди галогенов I.Значение P. (I.E.) уменьшается с увеличением размера атома, то есть от фтора к йоду. Следовательно, неметаллические свойства снижаются от фтора к йоду. Йод твердый с металлическим блеском.
Фтор имеет наивысшую энтальпию ионизации:
Потенциал ионизации — это минимальная энергия, необходимая для удаления наиболее слабосвязанного электрона из внешней оболочки изолированного газового атома. Фтор имеет высокое значение. И. по следующим причинам.
- Он имеет наименьший атомный размер
- Последний электрон, находящийся на 2p-орбитали, которая находится ближе к ядру.
Следовательно, последний электрон более плотно удерживается ядром из-за большего заряда ядра. Таким образом, требуется большее количество энергии для удаления этого электрона и I.P. Больше.
Электроотрицательность (EN):
Относительная тенденция связанного атома в молекуле притягивать общую электронную пару к себе называется его электроотрицательностью.
Среди элементов того же периода галогены являются наиболее электроотрицательными из-за высокого заряда ядра и небольшого размера атома.Их электроотрицательность и неметаллический характер постепенно уменьшаются по группе с увеличением их атомного размера. Значения электроотрицательности следующие: F = 4, Cl = 3, B r = 2,8, 1 = 2,5 (Примечание: электроотрицательность кислорода составляет 3,51)
Фтор Шоу Высокая электроотрицательность:
Электроотрицательность — это тенденция атома притягивать общие электроны к себе в молекуле. Фтор обладает высокой электроотрицательностью по следующим причинам
- Он имеет наименьший атомный размер.
- Последняя орбита — вторая, которая ближе к ядру и имеет больший ядерный заряд.
Следовательно, расстояние между общей парой электронов и ядром фтора невелико. Таким образом, он имеет больше возможностей притягивать к себе общую пару электронов и больше электроотрицательности.
Сродство к электрону (EA):
Сродство к электрону — это энергия, выделяемая при добавлении электрона к нейтральному газообразному атому, образуя одновалентный отрицательный ион.Когда галогены получают электроны, они теряют энергию.
Каждый галоген имеет максимальное сродство к электрону за период, но в семействе галогенов оно уменьшается от фтора к йоду. Порядок сродства к электрону: Cl> F> Br> I. Это можно объяснить следующим образом
- Размер атома увеличивается
- Эффективный заряд ядра уменьшается
- Способность притягивать электроны уменьшается
- Эффект экранирования увеличивается
Сродство к электрону у фтора меньше, чем у хлора:
Сродство к электрону — это энергия, выделяющаяся, когда электрон присоединяется к нейтральному газообразному атому, образуя одновалентный отрицательный ион.Электронное сродство фтора меньше, чем у хлора. Это можно объяснить следующим образом.
- Фтор имеет чрезвычайно маленький атомный размер.
- Подоболочка 2p компактна по фтору.
- Максимальная емкость внешней орбиты по фтору составляет всего восемь электронов.
По указанным выше причинам добавленный электрон подходит слишком близко к другим валентным электронам, и это увеличивает электрон-электронное отталкивание. Это приводит к высвобождению меньшего количества энергии, когда атом фтора получает электрон и образует F-ионы.
Энергия диссоциации связи (энтальпия диссоциации связи):
Энергия диссоциации связи определяется как энергия, необходимая для разрыва определенной связи на атомы.
В общем, галогены представляют собой двухатомные молекулы, в которых ковалентная связь образуется путем перекрывания «p» -орбиталей. Поскольку размер атома увеличивается от хлора к йоду, длина связи увеличивается от хлора к йоду. По мере увеличения длины связи от Cl до I. Энергия диссоциации связи уменьшается от хлора к молекуле йода.
Энергия диссоциации фтора исключительно меньше:
Энергия диссоциации связи — это энергия, необходимая для разрыва связи между атомами в газовой молекуле. Энергия диссоциации связи F-F в F2 меньше, чем Cl2, Br2 по следующим причинам
Фтор имеет небольшой атомный размер, а у фтора 2p подоболочка компактна и близка к ядру. Из-за небольшого атомного размера количество электронов удерживается в компактном объеме, и между несвязанными электронами существует сильное отталкивание.Следовательно, связь становится слабой, хотя связь короткая. По этой причине энергия диссоциации связи у фтора меньше, чем у других галогенов.
Множественное связывание происходит в Cl2, Br2, I2 из-за наличия d-орбиталей, в то время как такой тип множественного связывания отсутствует во фторе из-за отсутствия d-орбиталей. Следовательно, для других галогенов энергия диссоциации связи высока. Порядок энергии диссоциации связи: Cl2> Br2> F2> I2
.Энергия диссоциации связи молекулы фтора намного меньше, чем у молекулы хлора.
Это связано с тем, что в молекуле фтора два атома фтора расположены довольно близко друг к другу (т.е. длина связи F-F очень мала) из-за полного размера атомов фтора. Это вызывает очень сильное отталкивание между несвязывающими электронами двух атомов. Следовательно, связь F-F становится слабой.
В молекуле хлора отталкивание значительно минимизируется за счет большей длины связи Cl-Cl из-за большего размера атомов хлора.
Общие свойства галогенов:
- Состояние: Фтор и хлор — газы, бром — жидкий, а йод — твердый.
- Цвет: Все окрашены, интенсивность цвета увеличивается от фтора до йода. Фтор — это светло-желтый / бледно-желтый газ. Хлор — зеленовато-желтый газ. Бром — это красновато-коричневая или оранжево-красная жидкость, а Йод — фиолетовое или блестящее черное твердое вещество.
- Точки плавления и кипения: Элементы имеют низкие точки кипения и плавления, так как их молекулы удерживаются вместе силами Слабого вала Вандера. Эти силы усиливаются с увеличением размера атома.Таким образом, температуры кипения и плавления увеличиваются от фтора к йоду. Таким образом, фтор и хлор являются газами, бром — летучей жидкостью, а йод — твердым веществом, которое легко сублимируется.

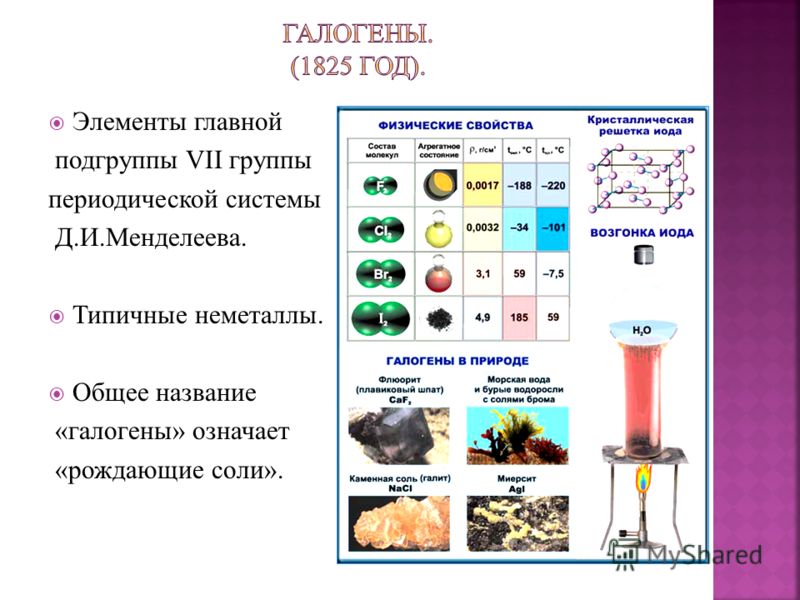 [3]
[3] И. Менделеева и изучить их значение в жизни человека.
И. Менделеева и изучить их значение в жизни человека.